Ácido Adípico: Propiedades, Producción y Usos
El ácido adípico, también conocido como ácido hexanodioico o ácido 1,4-butanodicarboxílico, tiene la fórmula química C6H10O4 y una masa molar de 146,14 g/mol. Tiene una importancia significativa como ácido dicarboxílico alifático ampliamente utilizado.
Si bien su aparición en la naturaleza es limitada, se sintetiza globalmente a gran escala. La principal aplicación de este compuesto es la producción de poliamida nailon 66 que fue descubierta por W. H. Carothers de DuPont a principios de la década de 1930.
Desde entonces, la fabricación de fibra de poliamida nailon 66 se ha convertido en un proceso dominante en la industria de las fibras sintéticas a escala mundial.
Tabla de contenido
1. Propiedades físicas del ácido adípico
El ácido adípico se obtiene en forma de cristales incoloros e inodoros con un sabor ácido característico. Demuestra alta solubilidad en metanol y etanol, y también es soluble en agua y acetona.
Sin embargo, su solubilidad en ciclohexano y benceno es bastante limitada. Cuando cristaliza, el ácido adípico forma prismas monoclínicos cuando se utiliza agua, acetato de etilo o acetona/éter de petróleo como disolventes.
Estas son algunas de sus propiedades físicas:
| Propiedad | Valor |
|---|---|
| pf, °C | 152.1 |
| pb, °C a 101,3 kPa | 337,5 |
| pb, °C a 13,3 kPa | 265 |
| pb, °C a 2,67 kPa | 222 |
| pb, °C a 0,67 kPa | 191 |
| pb, °C a 0,133 kPa | 159,5 |
| Densidad relativa (170 °C) | 1.085 |
| Densidad aparente, kg/m³ | 600 - 700 |
| Solubilidad, g/100 g de agua a 15 °C | 1,42 |
| Solubilidad, g/100 g de agua a 40 °C | 4.5 |
| Solubilidad, g/100 g de agua a 60 °C | 18.2 |
| Solubilidad, g/100 g de agua a 80 °C | 73 |
| Solubilidad, g/100 g de agua a 100 °C | 290 |
| Constantes de disociación k1 | 4,6 × 10-5 |
| Constantes de disociación k2 | 3,6 × 10-6 |
| Calor específico del líquido (200 °C), kJ kg⁻¹ K⁻¹ | 2.719 |
| Calor específico del vapor (300 °C), kJ kg⁻¹ K⁻¹ | 1.680 |
| Calor de fusión, kJ/kg | 115 |
| Calor de vaporización, kJ/kg | 549 |
| Calor de solución en agua, kJ/kg a 10 - 20 °C | -214 |
| Calor de solución en agua, kJ/kg a 90 - 100 °C | -241 |
| Viscosidad de la masa fundida, mPa · s a 160 °C | 4,54 |
| Viscosidad de la masa fundida, mPa · s a 193 °C | 2,64 |
2. Reacciones químicas del ácido adípico
El ácido adípico exhibe estabilidad en condiciones atmosféricas, sin embargo, al calentar el ácido fundido más allá de 230 – 250 °C, se produce un cierto grado de descarboxilación, lo que lleva a la formación de ciclopentanona, con un punto de ebullición de 131 °C.
Esta reacción está catalizada notablemente por sales metálicas, incluidas hierro, calcio y bario.
En comparación con los ácidos glutárico o succínico, el ácido adípico muestra una tendencia mucho menor a formar anhídridos cíclicos por pérdida de agua.
El ácido adípico muestra reactividad en uno o ambos grupos de ácido carboxílico, participando en la formación de sales, ésteres, amidas, nitrilos y otros compuestos.
Generalmente resiste la acción de la mayoría de los agentes oxidantes, como lo demuestra su producción en ácido nítrico, pero cuando se expone a ácido nítrico por encima de 180 °C, el ácido adípico experimenta un ataque autocatalítico, produciendo dióxido de carbono, agua y óxidos de nitrógeno.
3. Producción de ácido adípico
En las etapas iniciales de la producción comercial de ácido adípico, un proceso de dos pasos implicaba la oxidación del ciclohexano con aire. El primer paso fue la oxidación de ciclohexano a ciclohexanol y ciclohexanona con baja conversión, seguida de un proceso de alta conversión que oxidó la mezcla con aire para producir ácido adípico.
Sin embargo, a partir del año 2000, toda la fabricación a gran escala de ácido adípico utiliza la oxidación con ácido nítrico de ciclohexanol, ciclohexanona o una mezcla de ambas sustancias conocida como aceite de alcohol cetona (KA).
Las principales diferencias entre estos procesos comerciales radican en el método de producción del aceite KA. Normalmente, los seis átomos de carbono que forman la cadena principal del ácido adípico provienen del benceno, que se hidrogena a ciclohexano, o del fenol, que se hidrogena a ciclohexanol.
Posteriormente, el ciclohexano se oxida con aire para producir el aceite KA. En las últimas dos décadas, ha habido un cambio notable hacia el proceso más rentable basado en ciclohexano.
3.1. Oxidación del ciclohexanol con ácido nítrico
3.1.1. Mecanismo de reacción
El segundo paso del proceso de producción de ácido adípico convencional, desarrollado por DuPont a finales de la década de 1940, implica la oxidación de ciclohexanol, ciclohexanona o una mezcla de ambos utilizando ácido nítrico. El ácido adípico se obtiene con un rendimiento superior al 90%.
Durante este proceso, se forman como subproductos principales dióxido de carbono, óxidos de nitrógeno y algunos ácidos dicarboxílicos de menor masa molecular. Además, también se detectan ciertos subproductos que surgen de las impurezas presentes en el aceite KA de partida.
El mecanismo químico de esta reacción se discutió inicialmente en 1956, incluidas consideraciones de cinética y diseño del reactor. La Figura 1 proporciona un resumen de los hallazgos de estas investigaciones.
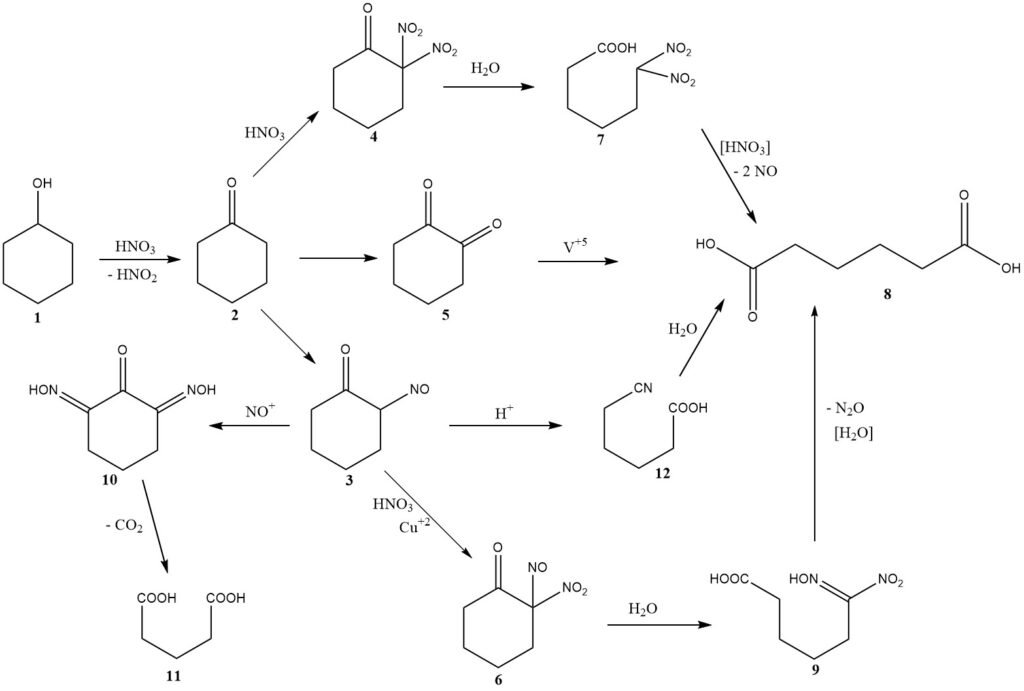
La oxidación del ciclohexanol (1) produce ciclohexanona (2) al mismo tiempo que genera ácido nitroso. Luego, la ciclohexanona sigue una de las tres vías posibles que conducen a la formación de ácido adípico (8).
La vía principal implica la nitrosación para producir 2-nitrosociclohexanona (3), que luego reacciona con ácido nítrico para formar 2-nitro-2-nitrosocetona (6).
La escisión hidrolítica de este intermedio produce ácido 6-nitro-6-hidroximinohexanoico, también conocido como ácido nitrólico (9), que se descompone aún más para dar ácido adípico y óxido nitroso, los principales productos de reducción del ácido nítrico no recuperados.
Normalmente, se convierten 2,0 moles de ácido nítrico en óxido nitroso por cada mol de ácido adípico producido.
A temperaturas más altas, se vuelve significativa una segunda vía, que implica la nitración, y que conduce a la formación de dinitrocetona (4).
Los primeros investigadores propusieron una tercera vía, que implica la formación intermedia de 1,2-dicetona (5) o su dímero, donde se requiere el uso de un catalizador de vanadio para lograr un buen rendimiento de ácido adípico. La presencia de vanadio sugiere su importante contribución al rendimiento general.
La nitrocetona intermedia (3) puede sufrir dos reacciones secundarias importantes. La nitrosación múltiple conduce a un intermedio (10), que pierde dióxido de carbono para producir ácido glutárico (11) o ácido succínico mediante una reacción posterior con ácido nítrico.
Se añade cobre metálico al ácido nítrico para inhibir estas reacciones. En condiciones específicas con una concentración en estado estacionario relativamente alta de la nitrosocetona (3) o la oximinocetona tautomérica, se produce un reordenamiento de tipo Beckmann, que conduce a la formación menor de ácido 5-cianopentanoico (12), que se hidroliza lentamente a ácido adípico. .
3.1.2. Procesos comerciales de oxidación de ácido nítrico
El proceso de oxidación del ácido nítrico para convertir ciclohexanol-ciclohexanona (KA) en ácido adípico sigue siendo similar a la literatura de patentes inicial, pero se han logrado avances en la eliminación de subproductos, la recuperación de catalizadores y ácido nítrico y la reducción de las emisiones de óxido nitroso, un gas de efecto invernadero que tradicionalmente se liberaba a la atmósfera.
Debido a la naturaleza corrosiva del ácido nítrico, las plantas de fabricación se construyen utilizando materiales como acero inoxidable (tipo 304L o mejor) o titanio en áreas de alta exposición.
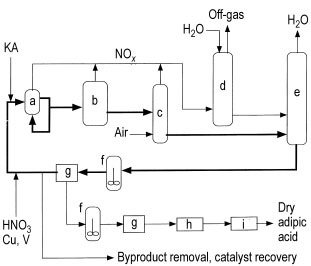
a) Reactor; b) reactor de limpieza; c) blanqueador de NOx; d) absorbente de ácido nítrico; e) Concentradora; f) Cristalizador; g) Filtrar o centrifugar; h) Secadora; i) Enfriador
El proceso normalmente implica un reactor (a), que funciona como un gran intercambiador de calor, que funciona a 60 – 80 °C y 0,1 – 0,4 MPa de presión. El reactor recibe el licor madre de ácido nítrico (NML) reciclado, el material de alimentación KA, el ácido de reposición con 50 – 60 % de ácido nítrico y un catalizador de cobre-vanadio.
El tiempo de residencia en el reactor es inferior a 5 minutos. Algunas instalaciones utilizan un segundo reactor (b) a temperatura elevada (110 – 120 °C) para completar la reacción y reducir las impurezas antes de proceder a la cristalización.
La reacción es altamente exotérmica (6280 kJ/kg) y se han patentado diseños de reactores innovadores para controlar el calor de la reacción y minimizar el uso de energía. Se mantiene un excedente de NML reciclado en la corriente de alimentación de KA (al menos 3:1 hasta 1000:1) para controlar la reacción y mejorar el rendimiento.
La corriente de producto pasa por varios pasos, incluido el paso a través de un blanqueador (c) para eliminar el exceso de óxidos de nitrógeno disueltos, que luego se recuperan como ácido nítrico en el absorbente (d).
El gas de escape del absorbente se puede utilizar para iniciar la oxidación a temperaturas más bajas haciéndolo pasar a través de la corriente de alimentación de KA antes de alimentarlo al oxidante. El agua producida en el proceso se elimina en un destilador de concentración (e) que funciona al vacío.
La corriente de producto concentrado se recicla de regreso al reactor con una porción desviada para la recuperación del producto o se pasa directamente a la recuperación del producto antes de reciclar el filtrado NML. El ácido adípico crudo se extrae del bucle NML mediante cristalización (f) y posteriormente se filtra o centrifuga (g).
Esta corriente efluente, que contiene concentraciones más altas de ácido glutárico, ácido succínico y subproductos, se procesa aún más para recuperar los catalizadores de vanadio y cobre y eliminar los ácidos subproductos. La recuperación de metales normalmente se logra mediante intercambio iónico.
El ácido adípico crudo del primer cristalizador (g) se somete a una o más etapas de recristalización antes de pasar a un secador (h) y un enfriador (i). Alternativamente, si no se requiere ácido adípico seco, los cristales de la centrífuga/filtro (g) se pueden disolver en agua y agregar a una solución de 1,6-hexanodiamina acuosa para producir sal de nailon.
Se han descrito mejoras adicionales al proceso convencional, especialmente en lo que respecta a la separación y recuperación de los subproductos del ácido dibásico.
Dependiendo del uso final, el ácido adípico crudo se puede refinar en diferentes grados, pero la recristalización en agua es un enfoque común. Se ha afirmado que poner a reflujo el ácido adípico crudo en ácido nítrico al 60% con vanadio disuelto produce un producto de alta calidad.
3.2. Rutas basadas en butadieno
A principios de la década de 1970, BASF inició un extenso programa de investigación para producir adipato de dimetilo, un diéster que luego podría hidrolizarse a ácido adípico. El proceso implicó la carbometoxilación de butadieno utilizando monóxido de carbono y metanol, catalizada por cobalto y piridina a alta presión.
Esta reacción produjo 3-pentenoato de metilo, que se separó de los subproductos mediante destilación. Posteriormente, una segunda etapa de carbometoxilación a menor presión, con una proporción reducida de piridina a cobalto, dio como resultado la formación de adipato de dimetilo.
La hidrólisis del diéster a ácido adípico y metanol se logró mediante un proceso catalítico de alto rendimiento. En general, el proceso mostró un rendimiento aproximado de aproximadamente el 70% a partir de butadieno. Aunque se demostró a escala de planta piloto, aún no se ha comercializado.
A mediados de la década de 1980, DuPont también se embarcó en un importante programa que implicaba una ruta basada en butadieno para obtener ácido adípico. En contraste con el enfoque del diéster de BASF, el método de DuPont implicó la dihidrocarboxilación directa de butadieno a ácido adípico (como se muestra en la Figura 3).
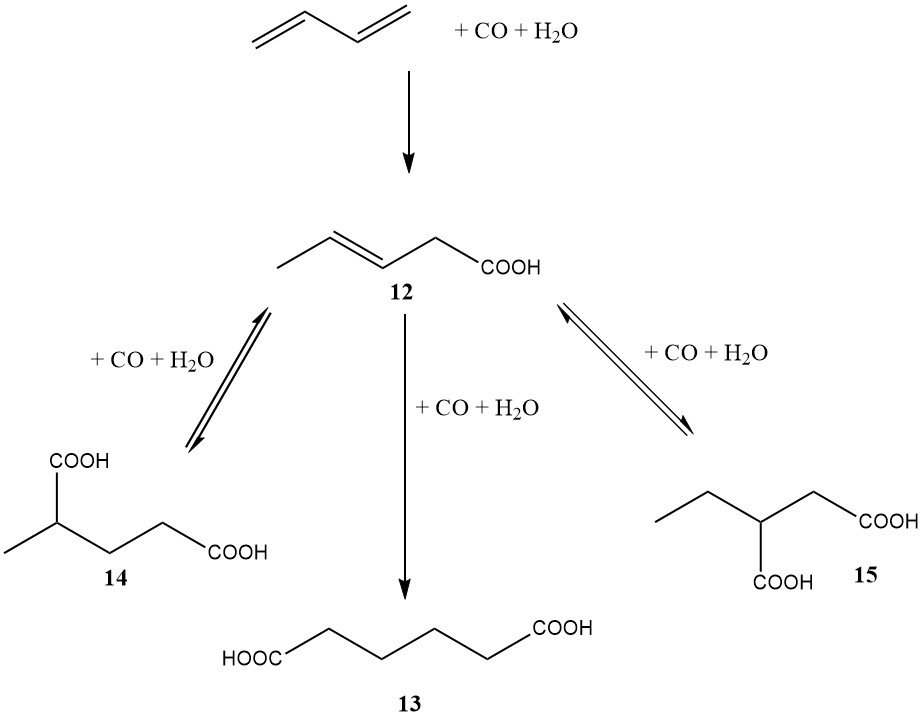
El primer paso, catalizado por paladio, rodio o iridio, condujo principalmente al ácido 3-pentenoico. El segundo paso, catalizado por rodio o iridio, dio como resultado la formación de ácido adípico (13), ácido 2-metilglutárico (14) y ácido 2-etilsuccínico (15).
La ventaja de este proceso fue la capacidad de isomerizar los ácidos 2-metilglutárico y 2-etilsuccínico en ácido adípico utilizando el mismo sistema catalítico. El catalizador requería un promotor de haluro, como el ácido yodhídrico.
El ácido pentanoico, un ácido carboxílico saturado y un subproducto del proceso, normalmente servía como disolvente. Desde finales de la década de 1980, muchas empresas químicas importantes han obtenido numerosas patentes para variaciones de estas rutas basadas en butadieno.
3.3. Otras Rutas
Además de la oxidación convencional de ciclohexano en dos pasos con aire/ácido nítrico y la carboxilación/carbometoxilación de butadieno, se han explorado varios otros procesos para la producción de ácido adípico.
Monsanto llevó a cabo una investigación sobre la dicarbonilación catalizada por haluro de paladio de 2-butenos 1,4-disustituidos. Este proceso implica la producción de ácido adípico a partir de 1,4-dimetoxi-2-buteno, monóxido de carbono y cloruro de paladio a 100 °C, seguido de la hidrogenación e hidrólisis del éster dimetílico insaturado resultante.
También se ha investigado la oxidación en un solo paso del ciclohexano utilizando ácido nítrico, dióxido de nitrógeno o aire. La oxidación de ciclohexano en un solo paso es particularmente atractiva desde el punto de vista económico y ha recibido una amplia atención de investigación.
Los primeros estudios fueron realizados por Gulf Research and Development, Asahi Chemical Industries y otros grupos. Por ejemplo, el ciclohexano se puede oxidar en un solo paso a ácido adípico con un rendimiento del 70 al 75 % en presencia de un catalizador de acetato de cobalto en ácido acético como disolvente.
Recientemente, ha habido un renovado interés en este enfoque, lo que ha dado lugar a varias patentes concedidas a empresas como Redox Corporation y Bayer.
El ácido adípico también se puede producir mediante ozonólisis de ciclohexeno o añadiendo un ácido carboxílico al ciclohexeno y posteriormente oxidando el éster resultante con ácido nítrico.
Además, se ha descrito la formación de derivados del ácido adípico mediante el acoplamiento electrolítico de acrilatos.
Estos procesos alternativos representan esfuerzos de investigación en curso para desarrollar nuevos métodos para la síntesis de ácido adípico.
4. Usos del ácido adípico
Aproximadamente el 80% del consumo mundial de ácido adípico se destina a la producción de fibras y resinas de nailon 66.
Todavía se utiliza de forma cautiva una cantidad menor de ácido adípico para producir adiponitrilo.
Cantidades importantes de ácido adípico se transforman en ésteres para diversas aplicaciones, como plastificantes, lubricantes y una variedad de resinas de poliuretano.
Los ésteres monoméricos son plastificantes esenciales para el poli(cloruro de vinilo) y otras resinas, mientras que los ésteres poliméricos se utilizan cuando se requieren niveles de plastificante excepcionalmente altos.
Las resinas de poliuretano que incorporan ácido adípico se crean a partir de poliisocianatos y poliéster polioles (adipatos) y encuentran uso en diversas aplicaciones.
El ácido adípico también sirve como acidulante en gelatinas y mermeladas y actúa como agente tampón o neutralizante en otros productos alimenticios.
Además, se emplea para modificar las propiedades de poliésteres insaturados para su uso en plásticos reforzados y revestimientos alquídicos.
El ácido adípico se utiliza en resinas de poliamida-epiclorhidrina para mejorar la resistencia en húmedo de los productos de papel.
Otras aplicaciones diversas incluyen su uso en adhesivos, insecticidas, curtidos, teñidos y en las industrias textiles. Además, el ácido adípico y los ácidos dibásicos mixtos (DBA) se emplean como tampones en el tratamiento de desulfuración de gases de combustión en centrales eléctricas.
5. Toxicología y Salud Ocupacional
El ácido adípico presenta una irritación menor y tiene una baja toxicidad oral. Las dosis letales publicadas (LDLo) son 3600 mg/kg (rata, oral), LD50 275 mg/kg (rata o ratón, i.p.) y LD50 1900 mg/kg (ratón, oral).
Algunas pruebas de alimentación crónica mostraron retrasos en el aumento del peso corporal, alteraciones en ciertas enzimas y cambios en los niveles de urea y cloruro en la sangre. Sin embargo, no se observó actividad teratogénica en estudios con ratones preñados.
Los estudios de metabolismo en ratas alimentadas con ácido adípico marcado con 14C revelaron la presencia de ácido adípico inalterado y productos metabólicos normales en la orina.
La exposición al ácido adípico puede causar irritación de las membranas mucosas, como los ojos y el tracto respiratorio, mientras que la exposición prolongada de la piel puede provocar sequedad o irritación.
En casos de derrames o fugas, se debe proteger al personal de la inhalación o del contacto excesivo con la piel. Se debe controlar la formación de polvo y se deben tomar medidas para evitar chispas estáticas. Si se producen derrames, el área se puede enjuagar con agua.
Si bien no existe un TLV (Valor límite umbral) ni MAK (Valor de concentración máxima) establecidos, la exposición al ácido adípico en el aire debe mantenerse por debajo de la de un polvo orgánico molesto: ACGIH (1979) recomienda un TWA (Promedio ponderado en el tiempo) de 8 horas. ) de 10 mg/m3 para polvo total y de 5 mg/m3 para polvo respirable. El TLV de OSHA para el polvo total es de 15 mg/m3.
6. Derivados del ácido adípico
6.1. adiponitril
El principal derivado del ácido adípico es el adiponitrilo, también conocido como 1,6-hexanoditrilo o 1,4-dicianobutano, Mr 108.14, punto de ebullición 298 – 300 ◦C (a 101,3 kPa), 154 ◦C (a 1,3 kPa) y punto de congelación 2,4 ◦C.
El adiponitrilo sirve como intermediario en la producción del componente principal del nailon 66, 1,6-hexanodiamina. Los métodos de producción anteriores implicaban la conversión de ácido adípico en dinitrilo mediante deshidratación en fase líquida o de vapor de la sal de amonio, utilizando ácido fosfórico o un catalizador de boro-fósforo. Sin embargo, estos métodos ya no son utilizados por los principales productores de nailon 66.
Se han utilizado varias rutas para la producción de adiponitrilo, incluidos los procesos de Celanese, que produjeron 1,6-hexanodiamina a partir de la amonólisis del 1,6-hexanodiol, obtenido por hidrogenación del ácido adípico.
6.2. Sales de ácido adípico
El ácido adípico forma sales de metales alcalinos y de amonio solubles en agua, así como sales alcalinotérreas que son moderadamente solubles.
Sus solubilidades en 100 g de agua son las siguientes: sal de diamonio 40 g (14 ◦C), sal disódica 59 g de hemihidrato (14 ◦C), sal dipotásica 65 g (15 ◦C), sal de calcio 4 g de monohidrato ( 13 ◦C), y 1 g de sal anhidra (100 ◦C).
La sal más común es el poli (hexanodioato de 1,6-hexanodiamonio), producido al hacer reaccionar ácido adípico con 1,6-hexanodiamina. Esta sal soluble en agua, precursora del nailon 66, puede enviarse o almacenarse cómodamente antes de la poliamidación final, durante la cual se elimina el agua.
6.3. Ésteres y poliésteres del ácido adípico
Los ésteres y poliésteres del ácido adípico constituyen el mayor mercado de ácido adípico no poliamida. Los ésteres derivados de alcoholes de cadena larga se utilizan como plastificantes y lubricantes, mientras que los de alcoholes de cadena corta sirven principalmente como disolventes.
El ácido adípico a reflujo con metanol en presencia de un catalizador ácido produce adipato de monometilo, junto con el diéster. La electrólisis de la sal del monoéster (síntesis de Kolbe) genera sebacato de dimetilo, otro precursor de la poliamida.
Los ésteres se disuelven fácilmente en la mayoría de los disolventes orgánicos, siendo el adipato de dimetilo el disolvente más utilizado y el adipato de di-2-etilhexilo el plastificante más utilizado. Otros plastificantes de adipato simples incluyen ésteres de n-octilo, n-decilo, isodecilo e isooctilo.
Los plastificantes poliméricos más complejos, preparados a partir de glicoles, representan un poco menos de la mitad de los plastificantes a base de ácido adípico. Los poliésterpolioles de bajo peso molecular con grupos terminales hidroxilo se utilizan con poliisocianatos para producir resinas de poliuretano.
6.4. Anhídridos de ácido adípico
El anhídrido del ácido adípico generalmente se obtiene deshidratando el ácido adípico, lo que da como resultado la formación de una forma polimérica lineal. La destilación del anhídrido polimérico puede producir la forma cíclica monomérica, que es muy inestable y fácilmente revierte al anhídrido polimérico lineal.
6.5. Amida del ácido adípico
La diamida del ácido adípico tiene un punto de fusión de 228 ◦C y es prácticamente insoluble en agua fría. Tradicionalmente, se ha preparado tratando el éster dimetílico con hidróxido de amonio concentrado o calentando la sal diamónica del ácido adípico en una corriente de amoníaco. Se pueden sintetizar varias amidas sustituidas a partir de aminas utilizando métodos sintéticos estándar.
Referencia
- Adipic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_269
Preguntas más frecuentes
El ácido adípico es un compuesto orgánico cristalino de color blanco con la fórmula química C6H10O4. Pertenece a la clase de los ácidos dicarboxílicos alifáticos y a menudo se le denomina ácido hexanodioico. El ácido adípico tiene importancia comercial y se utiliza ampliamente en diversas industrias debido a sus propiedades versátiles.
El ácido adípico tiene diversas aplicaciones en todas las industrias. Su uso principal y más destacado es en la producción de poliamida nailon 66, un material crucial para la fabricación de fibras y resinas. Además, el ácido adípico se utiliza en la producción de ésteres, resinas de poliuretano, plastificantes, lubricantes y como acidulante o agente tampón en la industria alimentaria. También se emplea en la síntesis de diversos derivados químicos.
El ácido adípico se puede producir mediante varios métodos. Los procesos comerciales más comunes implican la oxidación de ciclohexano en dos pasos con aire y ácido nítrico o la hidrocianación directa de butadieno. El primer método comienza con la oxidación del ciclohexano para producir ciclohexanol y ciclohexanona, seguida de su oxidación con ácido nítrico para obtener ácido adípico. El último método implica la hidrocianación de butadieno para producir adiponitrilo, que posteriormente se hidrogena e hidroliza para producir ácido adípico.
El ácido adípico exhibe solubilidad en varios solventes. Es soluble en metanol, etanol, agua y acetona. Sin embargo, su solubilidad es relativamente menor en ciclohexano y benceno.
El ácido adípico generalmente se considera seguro cuando se usa de acuerdo con las pautas y concentraciones recomendadas. Es un irritante menor y tiene baja toxicidad oral. La dosis letal para ratas (LDLo) es relativamente alta (3600 mg/kg), pero se debe tener precaución para evitar la inhalación excesiva o el contacto con la piel. No se sabe que el ácido adípico sea teratogénico y sus productos metabólicos se excretan en la orina.
La fórmula química del ácido adípico es C6H10O4.
El ácido adípico también se conoce con el nombre de «ácido hexanodioico».
