Producción industrial de caprolactama
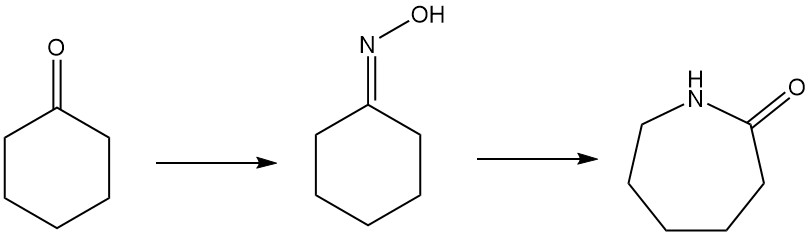
La caprolactama, el ingrediente clave del Nylon-6, se puede producir mediante varias rutas. El método más común es la conversión de ciclohexanona en ciclohexanona oxima mediante procesos de amoximación o peróxido de hidrógeno. Esta oxima luego sufre un reordenamiento de Beckmann para formar caprolactama.
Otros procesos incluyen la producción por fotooximación y ruta a base de tolueno o se recupera a partir de residuos de Nylon-6. Están surgiendo procesos innovadores, incluida la ruta ALTAM que utiliza métodos basados en butadieno o adiponitrilo derivados de recursos renovables como furfural o biomasa.
Las modernas plantas de caprolactama son operaciones complejas de varias etapas, con capacidades actuales de una sola línea que alcanzan la impresionante cifra de 200.000 toneladas por año para la tecnología Fibrant HPO, ampliamente autorizada.
Aunque como material de partida predomina la ciclohexanona (>98%), también se pueden utilizar ciclohexano y tolueno. En particular, se emplean la hidrogenación de fenol y diversas vías de oxidación del ciclohexano para obtener el intermedio clave. La eficiencia combinada de convertir ciclohexanona en caprolactama es aproximadamente del 98%.
Tabla de contenido
1. Producción de caprolactama mediante el proceso de ciclohexanona
La producción moderna de caprolactama se basa en el benceno extraído de flujos de BTX como materia prima principal. Todos los procesos comerciales excepto uno utilizan ciclohexanona oxima como intermediario. Esta oxima se forma mediante la reacción de la ciclohexanona con hidroxilamina, generada mediante varios métodos como:
- Proceso de Raschig
- NO hidrogenación en el proceso de ácido sulfúrico
- Proceso Fibrant HPO
- Proceso de amoximación
1.1. Oxima de ciclohexanona por proceso de Raschig
En este proceso, la ciclohexanona oxima se produce mediante la reacción de ciclohexanona y sulfato de hidroxilamina, y se utiliza amoníaco para neutralizar la sal de oxima. Como subproducto de esta reacción se produce sulfato de amonio.
Se implementaron varias mejoras, conocidas como procesos Raschig, para mejorar el rendimiento de ciclohexanona oxima y minimizar la producción de sales de sulfato. Los procesos Raschig modificados, los únicos que aún están en funcionamiento, generan exclusivamente sulfato de amonio como subproducto.
En el proceso Raschig modificado, primero las materias primas (amoníaco, CO2, SO2, agua y aire) reaccionan para formar sulfato de hidroxilamina mediante la ecuación (1). Luego, el sulfato de hidroxilamina reacciona con la ciclohexanona para producir ciclohexanona oxima (Ecuación (2)).
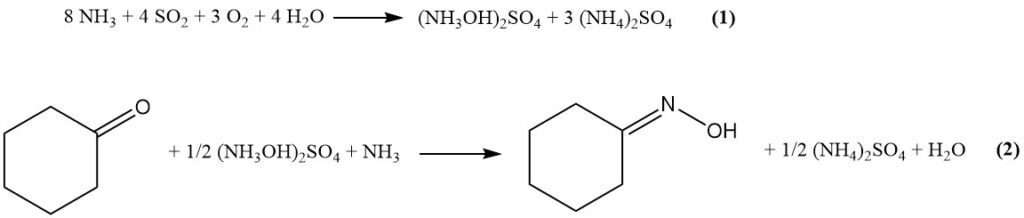
Los principales pasos del proceso involucrados se enumeran a continuación:
El amoníaco absorbe CO2 en el agua para formar una solución de carbonato/bicarbonato de amonio.
El amoníaco se quema con aire (catalizadores Pt/Rh) a ~850 °C para generar NOx y agua. Los gases calientes se enfrían, recuperando el calor de oxidación exotérmica y condensando el ácido nítrico diluido como subproducto.
La mezcla de gas nitroso y la solución de carbonato/bicarbonato de amonio reaccionan a <10°C y pH 15 para formar nitrito de amonio.
La quema de azufre produce SO2 (10–20 vol%), con recuperación de calor para la generación de vapor.
- El SO2 reacciona con una mezcla acuosa de nitrito de amonio e hidróxido de amonio para formar ácido hidroxiimidodisulfúrico. La temperatura y la relación NH4OH/NH4NO2 son parámetros importantes para minimizar los subproductos.
El ácido hidroxiimidodisulfúrico se somete a hidrólisis y neutralización para formar sulfato de hidroxilamina mediante N-hidroxisulfamato de amonio.
La oximación de ciclohexanona con sulfato de hidroxilamina a pH 4,5 y entre 50 y 100 °C produce ciclohexanona oxima.
El amoníaco acuoso neutraliza el ácido sulfúrico liberado y el sulfato de amonio coproducido se recupera mediante cristalización por evaporación.
Otros subproductos del proceso Raschig son los gases nitrosos en los gases residuales de la formación de nitrito, el gas nitrógeno de la descomposición del nitrito de amonio y el gas N2O de diversas reacciones de descomposición.
1.2. NO hidrogenación en el proceso de ácido sulfúrico
Para minimizar la coproducción de sulfato de amonio, BASF, Cyclopol e Inventa desarrolló procesos que implican la reducción catalítica de NO con hidrógeno a sulfato de hidroxilamina en ácido sulfúrico diluido. El NO mismo se genera mediante oxidación catalítica de amoníaco con oxígeno puro y vapor.
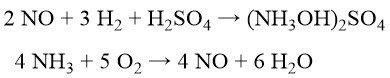
La producción posterior de oxima es similar al proceso de Raschig (Ecuación (2)). Esta ruta, con la neutralización del exceso de H2SO4, todavía genera ~0,7 kg de sulfato de amonio por kg de ciclohexanona oxima.
Los riesgos de explosión se mitigan mediante la composición controlada del gas durante la síntesis del sulfato de hidroxilamina. Se requiere una extensa purificación de la materia prima y complejos análisis de catalizadores.
Una mezcla de ~14% de amoníaco, ~1,34 de O2/NH3 y vapor pasan sobre un catalizador de Pt/Rh a ~850°C para formar principalmente NO y otros óxidos de nitrógeno. El gas caliente se enfría en una caldera de calor residual (generando vapor) y luego se enfría aún más para condensar agua y diluir el ácido nítrico.
El NO2 restante se elimina en torres consecutivas con soluciones diluidas de ácido nítrico y sosa cáustica, logrando una pureza de ~95 %.
La síntesis de hidroxilamina comprende múltiples líneas de 5-7 reactores bien agitados de 20 m3 que funcionan de forma continua. Cada reactor recibe una solución de ácido sulfúrico purificado al 20 % en peso con ~35 g/L de catalizador de grafito de Pt finamente disperso (~0,5 % en peso). Todos los reactores reciben NO purificado y exceso de hidrógeno. La temperatura de reacción es ~45°C.
Si bien se utiliza presión atmosférica, una presión elevada puede resultar ventajosa. Una solución de ~25% en peso de sulfato de hidroxilamina que contiene el catalizador sale del último reactor y se somete a filtración. La suspensión de catalizador concentrada se recicla al primer reactor.
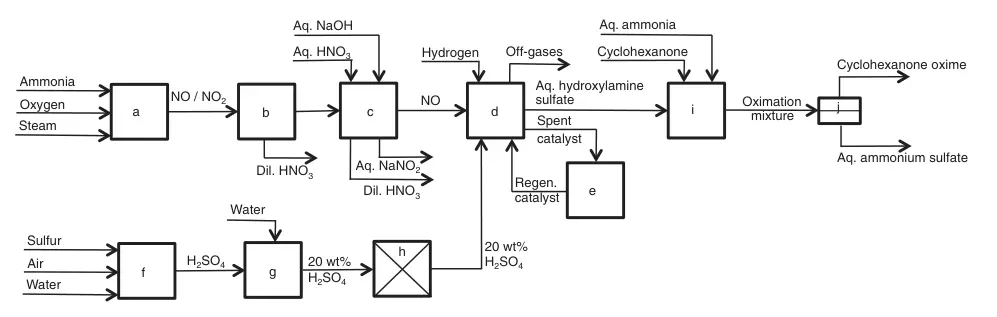
a) Combustión de amoníaco; b) Condensación; c) NO lavar; d) NO reducción; e) regeneración del catalizador; f) Combustión de azufre; g) Dilución; h) Purificación; i) oximación de ciclohexanona; j) Separación de ciclohexanona oxima/sulfato de amonio acuoso
Las mezclas de reacción extremadamente corrosivas y la sensibilidad del catalizador requieren una cuidadosa selección del material. Inventa propuso revestimientos de caucho/resina sintética y BASF sugirió tipos especiales de acero sin cobre.
La solución de sulfato de hidroxilamina producida reacciona con ciclohexanona a una temperatura (85–90 °C) que excede el punto de fusión acuoso de la ciclohexanona oxima. La fase acuosa de sulfato de amonio resultante se separa de la fase orgánica que contiene agua, aproximadamente un 7 % en peso, y ambas se procesan por separado.
La ciclohexanona oxima se extrae de la fase de sulfato de amonio con ciclohexanona y luego se recupera mediante destilación. La cristalización por evaporación de la solución restante produce ~0,7 kg de sulfato de amonio cristalino por kg de ciclohexanona oxima. Después del secado parcial, la oxima que contiene agua está lista para la transposición de Beckmann para producir caprolactama.
1.3. Proceso Fibrant HPO®
Desarrollado por Fibrant en la década de 1960, el proceso HPO (hidroxilamina fosfato oxima) ofrece un enfoque único para la producción de ciclohexanona oxima basado en nitrato selectivo. Hidrogenación de iones/óxido de nitrógeno.
Esta ruta de síntesis combinada de hidroxilamina y oxima elimina el subproducto sulfato de amonio. El proceso HPO permite un circuito cerrado entre la síntesis de hidroxilamina y oxima evitando la liberación de ácido sulfúrico durante la formación de oxima.
Gira en torno al reciclaje de dos corrientes: un tampón acuoso de ácido fosfórico y una fase de proceso orgánico. Varias reacciones y operaciones clave ocurren dentro de este sistema.
La hidrogenación catalítica selectiva de iones nitrato con gas hidrógeno en la solución tampón de ácido fosfórico genera hidroxilamina. A un pH de la reacción ~2, la hidroxilamina resultante se protona, formando fosfato de hidroxilamonio. Como catalizador se utiliza Pd/Pt soportado sobre carbono o alúmina.
Un exclusivo sistema de reactor de columna de burbujas trifásico combina un contacto óptimo gas-líquido-sólido con una eliminación eficiente del calor. El hidrógeno que no ha reaccionado se recicla después de la separación de la suspensión del catalizador. La solución tampón de ácido fosfórico de hidroxilamonio pasa a la sección de oximación.
El tampón acuoso de hidroxilamina-ácido fosfórico se hace reaccionar con una fase orgánica de tolueno-ciclohexanona, convierte la ciclohexanona en ciclohexanona oxima y libera ácido fosfórico. Este paso de oximación opera a pH ~2, logrando conversiones casi cuantitativas tanto de hidroxilamina como de ciclohexanona.
La fase orgánica formada (ciclohexanona oximetolueno) se separa del tampón acuoso, se lava con agua y luego se destila el tolueno. La oxima seca se traslada a la sección de reordenamiento de Beckmann, mientras que el tolueno destilado se recicla de nuevo al reactor de oximación.
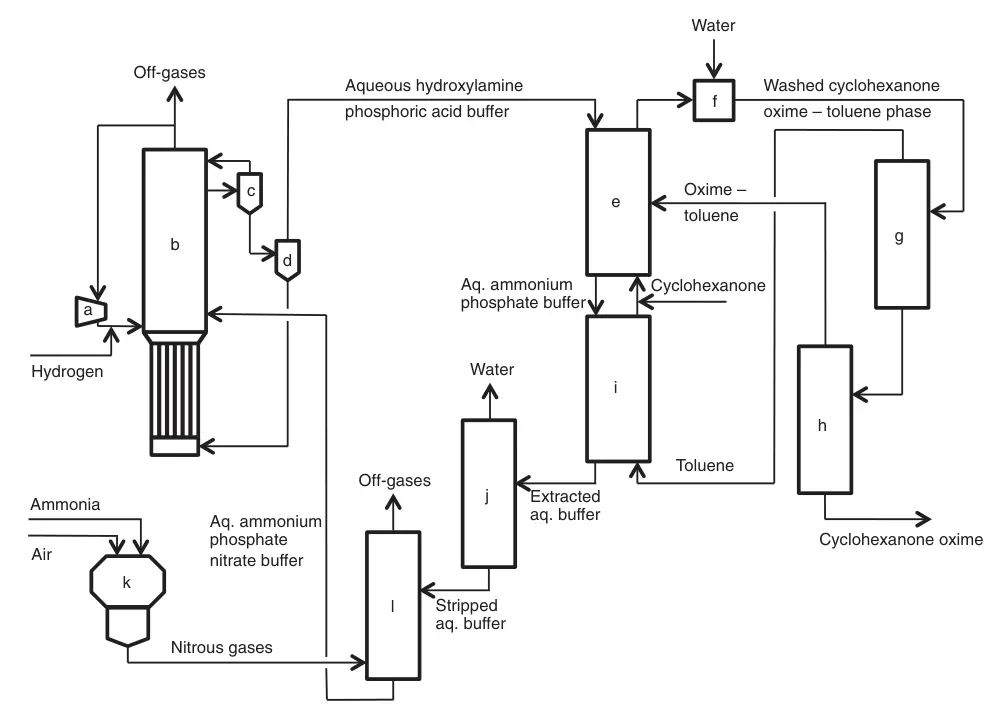
a) Compresor; b) reactor de hidrogenación de nitratos; c) Separador gas-líquido; d) Filtración del catalizador; e) Oximación; f) Lavado; g) destilación de tolueno; h) purificación de ciclohexanona oxima; i) Extracción; j) Decapado con vapor; k) combustión de amoniaco; l) Descomposición del amoniaco y absorción de gases nitrosos.
El desarrollo continuo del proceso HPO condujo a la intensificación del proceso HPOplus, que presenta flujos de proceso concentrados, un consumo reducido de materia prima/energía y una capacidad de oxima de línea única significativamente mayor (>200.000 t/a).
1.4. Proceso de amoximación
La reacción de ciclohexanona con amoníaco y peróxido de hidrógeno ofrece una ruta alternativa a la síntesis de ciclohexanona oxima en fase líquida sin generar un subproducto de sulfato de amonio.
El éxito inicial de este enfoque se produjo en 1960 con el uso de catalizadores de tungsteno y estaño en amoníaco acuoso a 10-30 °C, logrando altos rendimientos de oxima (>90%). Sin embargo, los desafíos de extracción y recuperación de catalizadores obstaculizaron la comercialización.
A finales de la década de 1970, se desarrolló un material sintético poroso (silicalita de titanio (TS-1)), que dio lugar a nuevos procesos de oxidación catalítica. En 1987, Montedipe implementó TS-1 para la amoximación de ciclohexanona, seguido de procesos similares de Sinopec.
El amoníaco reacciona con peróxido de hidrógeno en los centros de titanio del catalizador, formando la hidroxilamina intermedia, que posteriormente reacciona con ciclohexanona para dar la oxima deseada.
La proporción de alimentación molar de H2O2/ciclohexanona es 1,0-1,1 y un alcohol terciario estable (p. ej., alcohol terc-butílico) de 2 a 4 veces el peso de la ciclohexanona se utiliza como disolvente.
La reacción se opera a una temperatura de ~85 °C y una presión de >0,25 MPa durante aproximadamente 1,5 h para lograr una conversión de ciclohexanona a oxima de hasta el 98 %.
La primera planta comercial basada en esta tecnología fue construida por Sumitomo Chemical en 2003. Varias plantas chinas de caprolactama utilizan esta tecnología, algunas con variantes TS-1.
En la Figura 3 se muestra una descripción simplificada del proceso:
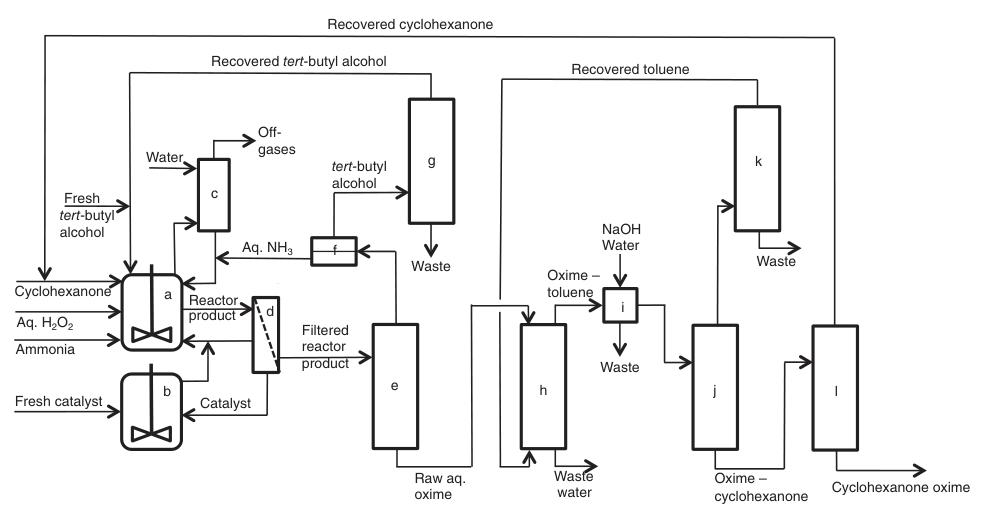
a) Reactores de amoximación; b) preparación/purificación del catalizador; c) Depuración de gases residuales; d) Filtración; e) recuperación de amoníaco/alcohol terc-butílico; f) separación L/L; g) destilación de alcohol terc-butílico; h) Extracción; yo lavando; j) Recuperación de solventes; k) Destilación de solventes; l) Recuperación de ciclohexanona
El proceso comienza con una corriente continua de materia prima que contiene peróxido de hidrógeno diluido, ciclohexanona, amoníaco, alcohol terc-butílico (tanto fresco como reciclado) y catalizador (fresco o reciclado) que ingresa a reactores de amoximación agitados.
Los gases residuales generados durante este paso, que contienen amoníaco sin reaccionar, se lavan con agua para recuperar y reciclar el amoníaco.
La mezcla de productos resultante luego se filtra y se envía a una columna de recuperación para su separación y purificación. En esta etapa, se pueden emplear dos vías alternativas:
1. Extracción con tolueno:
El amoníaco que no ha reaccionado y el alcohol terc-butílico que contiene agua se recuperan y purifican para su reutilización. La ciclohexanona oxima y la ciclohexanona sin reaccionar se extraen usando tolueno, seguido de lavado con agua y posterior separación por destilación.
2. Reextracción a contracorriente:
Una etapa de reextracción continua en contracorriente utiliza agua desmineralizada para formar fases acuosas separadas de oxima y ciclohexanona. A continuación, estas fases se someten a una purificación adicional mediante destilación.
1.5. Reordenamiento de Beckmann de ciclohexanona oxima a caprolactama
La caprolactama, un precursor clave del nailon-6, se produce principalmente a partir de ciclohexanona oxima mediante el reordenamiento de Beckmann. Esta reacción altamente exotérmica ocurre tanto en fase líquida como gaseosa.
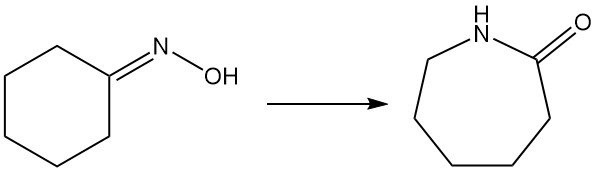
La conversión de oxima en caprolactama implica el tradicional reordenamiento de Beckmann en fase líquida con ácido sulfúrico fumante, generando sulfato de amonio como coproducto. Sumitomo Chemical, sin embargo, utiliza un proceso exclusivo de reordenamiento de Beckmann en fase de vapor.
Un precio deprimido del sulfato de amonio hace indeseable su coproducción, motivando el desarrollo de procesos que lo minimicen o eliminen. Sin embargo, el sulfato de amonio también puede beneficiar la producción de caprolactama cuando se usa como fertilizante en condiciones específicas del suelo, proporcionando ajuste de nitrógeno, azufre y pH.
1.5.1. Reordenamiento de Beckmann en fase líquida
El método industrial dominante utiliza ácido sulfúrico fumante u oleum como catalizador y disolvente. Consigue una alta conversión de oxima y el rendimiento de caprolactama es casi del 100%, pero genera sulfato de amonio como subproducto.
Los parámetros de reacción, como la temperatura, la concentración de ácido y la mezcla, afectan significativamente la pureza y el color del producto. La reorganización en varias etapas con alimentación distribuida de óleum reduce la producción de sulfato de amonio.
La purificación final de caprolactama implica extracción con disolventes, destilación y lavado.
1.5.2. Reordenamiento de fase gaseosa (reordenamiento catalítico heterogéneo)
La reordenación de la fase gaseosa se desarrolló para evitar la generación de sulfato de amonio asociada con los métodos de fase líquida. Los primeros intentos de utilizar catalizadores de eliminación de agua tuvieron problemas con la baja selectividad y la desactivación del catalizador.
Sumitomo Chemical logró el éxito industrial con zeolitas con alto contenido de sílice en presencia de agua y metanol.
Este proceso implica la evaporación de una mezcla húmeda de oxima/metanol. Luego la oxima se convierte en caprolactama sobre un catalizador de zeolita MFI a 350-380°C. El catalizador se regenera continuamente con aire a 500°C en un sistema de lecho fluidizado.
Las impurezas de la caprolactama resultante se eliminan mediante destilación. La purificación adicional de caprolactama mediante cristalización en un disolvente mixto y mediante hidrogenación y destilación en múltiples etapas da un producto de alta pureza.
Sumitomo Chemical es el único productor comercial que utiliza la reordenación de fases gaseosas sin generar sulfato de amonio.
2. Producción de Caprolactama por Fotooximación
En la década de 1950, Toray desarrolló un proceso fotoquímico único para producir caprolactama. Esta metodología, llamada fotonitrosación (PNC), evita la síntesis de oxima convencional mediante la conversión directa de ciclohexano en diclorhidrato de ciclohexanona oxima, seguida de la posterior transposición de Beckmann a caprolactama.
El ciclohexano se hace reaccionar con cloruro de nitrosilo para dar clorhidrato de ciclohexanona oxima, siguiendo las reacciones siguientes:
1. Formación de ácido nitrosilsulfúrico: los gases nitrosos obtenidos de la combustión de amoníaco se hacen reaccionar con ácido sulfúrico para producir ácido nitrosilsulfúrico (NOHSO4).
2 H2SO4 + NO + NO2 → 2 NOHSO4 + H2O
2. Producción de NOCl: NOHSO4 reacciona con cloruro de hidrógeno (HCl) para producir NOCl, con regeneración simultánea de ácido sulfúrico.
NOHSO4 + HCl → NOCl + H2SO4
3. Conversión fotoquímica:
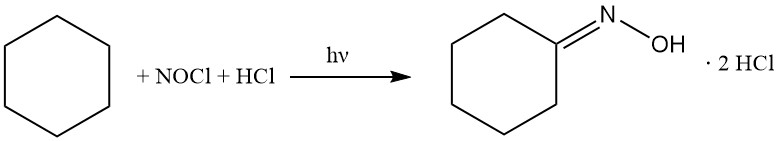
El proceso PNC se basa en la reacción fotoquímica del ciclohexano con NOCl en presencia de un exceso de HCl. Esta transformación se ve facilitada por lámparas LED de alto rendimiento que emiten luz actínica y conduce a la formación selectiva de diclorhidrato de ciclohexanona oxima como una capa inferior aceitosa.
En particular, las lámparas LED ofrecen una eficiencia energética superior (0,4 kg de oxima por kWh) y una selectividad molar (86%) en comparación con las alternativas anteriores de lámparas de mercurio.
El diclorhidrato de oxima recuperado se somete a una transposición de Beckmann utilizando óleum, produciendo caprolactama. El ciclohexano que no ha reaccionado se recicla, mientras que el cloruro de hidrógeno desprendido se recaptura mediante un proceso de absorción y concentración acuosa.
La solución de caprolactama cruda se neutraliza con amoníaco y se somete a una purificación adicional mediante tratamiento químico, secado y destilación. Este proceso genera 1,55 toneladas de sulfato de amonio por tonelada de caprolactama.
3. Recuperación de caprolactama a partir de residuos de nailon-6
Los residuos de nailon-6, generados a lo largo de su ciclo de vida, desde la producción hasta la eliminación del producto final, presentan una oportunidad para la recuperación de recursos. Los procesos de despolimerización recuperan la valiosa caprolactama de estos flujos de desechos, ofreciendo beneficios tanto ambientales como económicos.
Los residuos sólidos de nailon-6 se despolimerizan a caprolactama en un reactor de caldera de alta presión utilizando vapor sobrecalentado con un catalizador de craqueo (normalmente ácido fosfórico). Esta conversión también puede ocurrir sin catalizador bajo presión de vapor elevada.
La mezcla de vapor y caprolactama resultante sufre una condensación y concentración parciales. Luego, un agente oxidante purifica el concentrado, seguido de la purificación final de la caprolactama por destilación.
El agua de lavado de la producción de chips de nailon 6 contiene oligómeros de caprolactama junto con el monómero. La preconcentración mediante evaporación en película fina precede a la despolimerización utilizando la misma metodología que los residuos sólidos.
La solución acuosa de caprolactama resultante se somete a purificación química y destilación para producir agua, fracciones de bajo punto de ebullición y el producto de caprolactama deseado.
Los métodos alternativos también abordan la despolimerización de oligómeros. Un enfoque implica concentrar el agua de lavado para mantener la solubilidad del oligómero y alimentar la solución de caprolactama-oligómero a un reactor de lecho fijo o de lecho fluidizado.
Un catalizador de óxido de aluminio especializado rompe los oligómeros a 275-350 °C, logrando un rendimiento del 95 % en relación con la alimentación. Los métodos de purificación convencionales recuperan posteriormente la caprolactama.
Varias tecnologías establecidas se ocupan de los desechos de nailon-6 posconsumo, en particular las alfombras desechadas. Estos procesos requieren recolección, clasificación y trituración mecánica antes de la despolimerización a caprolactama de grado virgen.
Ejemplos notables incluyen el programa «6ix Again» de BASF, que utiliza un reactor semicontinuo con ácido fosfórico y vapor sobrecalentado para la despolimerización a alta temperatura (250-300°C). La purificación posterior con un agente oxidante y la destilación al vacío recuperan la caprolactama del destilado.
Otro proceso es Evergreen Nylon Recycling, que es un método de despolimerización no catalizada de dos etapas que emplea un sistema de reactor de alta presión y vapor sobrecalentado para hidrolizar el material triturado. Recupera el 90-95% del nailon-6 inicial en forma de caprolactama, apto para la producción de alfombras.
4. Proceso basado en tolueno
Desarrollado por Snia Viscosa en 1960 y utilizado en Italia hasta principios de los años 1990, este proceso basado en tolueno ofrece una ruta alternativa a la producción de caprolactama. El proceso abarca tres pasos clave:
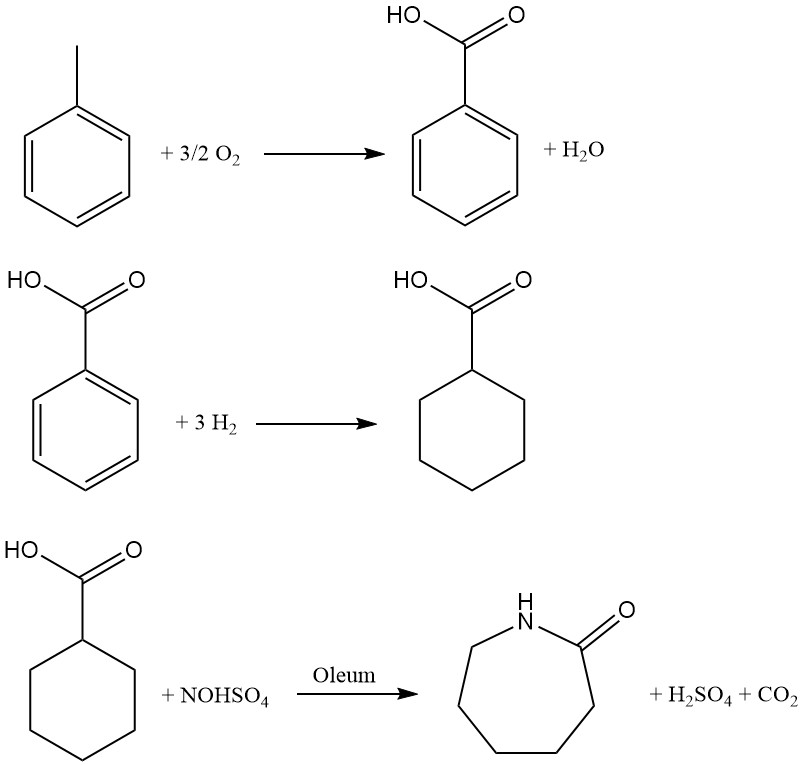
1. Oxidación catalítica: el tolueno se oxida con aire en fase líquida utilizando un catalizador de cobalto a 160-170 °C y 0,8-1 MPa de presión. La recuperación del tolueno que no ha reaccionado mediante enfriamiento garantiza un rendimiento óptimo.
El producto líquido resultante, que contiene aproximadamente un 30 % de ácido benzoico junto con intermediarios y subproductos, requiere una destilación de varias etapas para su purificación.
2. Hidrogenación: el ácido benzoico se convierte en ácido ciclohexanocarboxílico mediante hidrogenación en fase líquida utilizando un catalizador de Pd/C. Una serie de reactores agitados que funcionan a aproximadamente 170 °C y una presión de 1 a 1,7 MPa facilitan una transformación eficiente. La destilación posterior a presión reducida purifica el ácido resultante.
3. Nitrosodecarboxilación y reordenamiento: este paso crucial combina la nitrosación del ácido ciclohexanocarboxílico con el reordenamiento de Beckmann para generar directamente caprolactama. En la reacción dentro de un reactor de múltiples etapas se utiliza una solución de ácido nitrosilsulfúrico al 73% en ácido sulfúrico, preparada mediante absorción convencional de NO en óleum.
Mantener la tasa de conversión alrededor del 50% requiere que el proceso se realice en ciclohexano hirviendo a presión atmosférica. Los ácidos sulfónicos se forman como subproductos inevitables.
Después de la nitrosación-reordenamiento combinado, la corriente de producto se somete a hidrólisis con agua a bajas temperaturas. La extracción del ácido ciclohexanocarboxílico que no ha reaccionado permite su reciclaje nuevamente en el proceso.
La solución ácida de caprolactama, que contiene un exceso de ácido sulfúrico, pasa luego a la etapa de neutralización. La cristalización a presión reducida con amoníaco produce dos capas líquidas distintas: una solución de sulfato de amonio y una solución acuosa de caprolactama. Una mayor purificación implica:
- La extracción con tolueno separa la caprolactama de los subproductos solubles en agua.
- La extracción a contracorriente con agua recupera la caprolactama de la solución de tolueno.
- La destilación produce caprolactama pura a partir de la solución acuosa concentrada.
5. Procesos alternativos
Más allá del proceso convencional de amoximación con ciclohexanona, han surgido varias rutas alternativas a la caprolactama:
5.1. Procesos de peróxido de hidrógeno
- Proceso de invención: La oxidación de ciclohexilamina con peróxido de hidrógeno genera ciclohexanona oxima.
- Proceso de 1,1´-peroxidiciclohexilamina: la ciclohexanona y el peróxido de hidrógeno reaccionan para formar un peróxido, que luego se convierte en caprolactama y regenera la ciclohexanona.
5.2. Oxidación de Ciclohexilamina con Oxígeno Elemental:
La oxidación directa de la ciclohexilamina con oxígeno produce ciclohexanona oxima.
5.3. Oximación directa de ciclohexanona:
El amoníaco, el aire y la ciclohexanona reaccionan directamente sobre varios catalizadores para formar ciclohexanona oxima.
5.4. Proceso de bis(nitrosociclohexano):
La descarga eléctrica desencadena la reacción del ciclohexano con óxido nítrico o compuestos relacionados, formando bis (nitrosociclohexano), que se reorganiza en ciclohexanona oxima.
5.5. Proceso de ácido ε-hidroxicaproico/ε-caprolactona:
La oxidación de la ciclohexanona con aire genera ácido ε-hidroxicaproico y ácido adípico (subproducto). Ambos se pueden convertir en caprolactama por diferentes rutas.
5.6. Proceso de 2-Nitrociclohexanona:
Una secuencia única de reacciones que involucran acetilación, nitración, escisión del anillo, hidrogenación y ciclación convierte la ciclohexanona en caprolactama sin subproductos. .
5.7. Proceso de 3,3-Pentametilenoxaziridina:
El hipoclorito reacciona con la ciclohexanona en amoníaco acuoso para formar ciclohexanona isoxima, que luego se reorganiza en caprolactama bajo calor.
5.8. Desacetilación Catalítica de N-Acetilcaprolactama:
La O-acetilciclohexanona oxima se desacetila sobre catalizadores para producir caprolactama.
5.9. Procesos basados en butadieno:
- Proceso ALTAM: desarrollado por DSM y otros, este proceso de varios pasos utiliza butadieno para producir caprolactama con alta selectividad.
- Procesos basados en adiponitrilo: BASF y Rhone-Poulenc desarrollaron procesos independientes para la producción de caprolactama a partir de adiponitrilo, obtenido de varias rutas, incluido el butadieno.
5.10. Rutas Biorrenovables:
Dada la creciente preocupación por la sostenibilidad, los recursos de origen biológico están ganando terreno como materia prima para la producción de caprolactama. Se están desarrollando varias rutas prometedoras, centrándose en:
- Productos químicos de uso directo: benceno bioderivado, fenol, acrilonitrilo o HMF se pueden integrar fácilmente en los procesos de caprolactama existentes.
- Rutas químicas: Ácido levulínico o furfural, obtenida de biomasa, se puede convertir en intermediarios que conducen a caprolactama.
- Rutas (parcialmente) fermentativas: Síntesis microbiana de lisina o fermentación de carbohidratos ofrece rutas potenciales hacia los precursores de caprolactama.
Aunque actualmente no son económicamente competitivos con los métodos tradicionales, los procesos biorrenovables son prometedores para la futura producción sostenible de caprolactama.
Referencia
- Caprolactama; Enciclopedia de química industrial de Ullmann. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a05_031.pub3
