o-Cresol: Propiedades, Reacciones, Producción y Usos

¿Qué es el o-cresol?
El o-cresol, también conocido como 2-metilfenol, es un compuesto orgánico con la fórmula química C7H8O. Es un sólido cristalino incoloro a temperatura ambiente con olor fenólico y es altamente soluble en la mayoría de los disolventes orgánicos.
Tabla de contenido
1. Propiedades físicas del o-cresol
El o-cresol puro es un sólido cristalino incoloro a temperatura ambiente; sin embargo, se vuelve amarillo o marrón tras un periodo de almacenamiento prolongado. El o-cresol tiene olor fenólico y absorbe la humedad del aire.
El o-cresol es altamente soluble en fenol y en muchos disolventes orgánicos, como alcoholes alifáticos, éteres, cloroformo y glicerol, y es menos soluble en agua que el fenol.
El o-cresol se puede destilar con vapor de agua y forma azeótropos con diversos compuestos, como decano, 1-deceno, 1-undeceno, dodecano, 1,2,4,5-tetrametilbenceno, divinilbenceno, etilenglicol, metildietilenglicol y éter etílico.
Las propiedades físicas importantes del o-cresol se resumen en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Número CAS | [95-48-7] |
| Fórmula química | C7H8O |
| Peso molecular | 108,14 g/mol |
| Punto de fusión a 101,3 kPa | 30,99 °C |
| Punto de ebullición a 101,3 kPa | 191,00 °C |
| Densidad a 25 °C | 1,135 g/cm³ |
| Densidad a 50 °C | 1,0222 g/cm³ |
| Viscosidad a 50 °C | 3,06 mPa·s |
| Índice de refracción a 50 °C | 1,5310 |
| Constante dieléctrica a 50 °C | 6,00 |
| Conductancia específica a 50 °C | 0,43 × 10-10 S/cm |
| Tensión superficial a 50 °C | 34,4 × 10-6 N/m |
| Constante de disociación a 25 °C | 4,8 × 10-11 |
| Temperatura crítica | 424,4 °C |
| Presión crítica | 5,01 MPa |
| Densidad crítica | 384 kg/m3 |
| Capacidad calorífica cp a 25 °C (gas) | 127,3 J mol-1 K-1 |
| Capacidad calorífica cp a 25 °C (sólido) | 154,7 J mol-1 K-1 |
| Capacidad calorífica cp a 50 °C (líquido) | 237,9 J mol-1 K-1 |
| Entalpía de fusión ΔHm en el punto de fusión, 101,3 kPa | 15,830 kJ/mol |
| Entalpía de sublimación ΔHsub a 25 °C, 101,3 kPa | 76,07 kJ/mol |
| Entalpía de vaporización ΔHv en el punto de ebullición, 101,3 kPa | 45,222 kJ/mol |
| Entalpía de combustión ΔH°c a 25 °C, 101,3 kPa | - 3696 kJ/mol |
| Entalpía de formación ΔH°f a 25 °C, 101,3 kPa | - 204,8 kJ/mol |
| ΔH°f a 25 °C (gas), 101,3 kPa | - 128,7 kJ/mol |
| Energía libre de formación ΔG°f a 25 °C, 101,3 kPa | - 55,7 kJ/mol |
| ΔG°f a 25 °C (gas) y 101,3 kPa | - 33,0 kJ/mol |
| Entropía S a 25 °C y 101,3 kPa | 165,5 J mol-1 K-1 |
| Entropía S° a 25 °C (gas) y 101,3 kPa | 352,8 J mol-1 K-1 |
| Solubilidad en agua a 25 °C | 2,6 % en peso |
| Solubilidad en agua a 100 °C | 4,8 % en peso |
| Coeficiente de distribución log P octanol/agua a 25 °C | 1,95 |
| Densidad de vapor (aire = 1) | 3,72 |
| Punto de inflamación (vaso cerrado) | 81 °C |
| Temperatura de ignición | 555 °C |
| Límite inferior de inflamabilidad en el aire a 20 °C, 101,3 kPa | 1,3 % vol |
2. Reacciones químicas del o-cresol
El o-cresol es químicamente similar al fenol. Es un ácido débil y se disuelve en álcalis acuosos para formar sales estables en agua, conocidas como o-cresolatos. Por lo tanto, pueden extraerse en una solución de hidróxido de sodio a partir de disolventes inmiscibles con agua.
El grupo hidroxilo del o-cresol puede eterificarse con haluros de alquilo, sulfatos de dialquilo, carbonatos de dialquilo y ésteres de ácido toluenosulfónico, y reaccionar con anhídridos de acilo o cloruros de acilo para formar los ésteres de tolilo correspondientes, comúnmente denominados ésteres de o-cresilo.
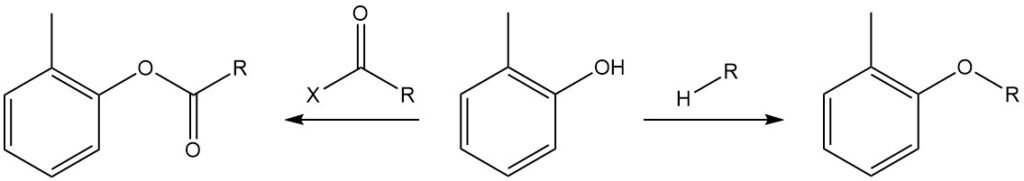
El grupo OH del o-cresol reacciona con isocianatos para formar uretanos.
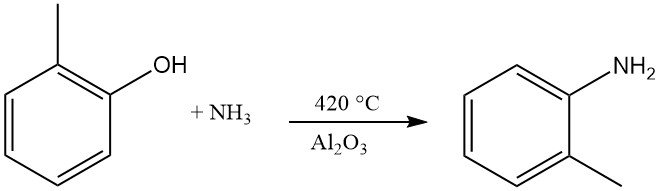
La o-toluidina se forma mediante la reacción del o-cresol con amoníaco a una temperatura de 420 °C y en presencia de Al2O3.
Se pueden obtener diferentes 2-halogenotoluenos sustituyendo el grupo hidroxilo del o-cresol. Por ejemplo, la reacción con oxitetrafluoruro de azufre a 150 °C, con tricloruro de difenilfosfina a 220 °C o con tribromuro de fósforo a 280 °C produce los correspondientes 2-fluoro-, 2-cloro- o 2-bromotolueno, respectivamente.
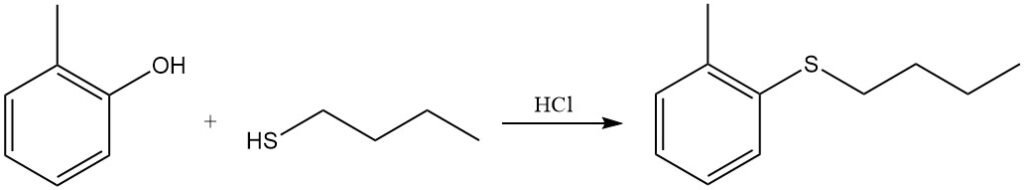
El grupo OH fenólico del o-cresol puede sustituirse por un grupo tiobutil mediante la reacción con butanotiol en ácido clorhídrico.
El tolueno se produce mediante la destilación de cresol con polvo de zinc y también puede formarse mediante hidrogenación en fase de vapor a 300-400 °C bajo presión (hasta 8 MPa) en presencia de catalizadores (metales de transición y óxido de aluminio).
La hidrodesalquilación de o-cresol a fenol puede lograrse utilizando catalizadores a 400-500 °C o de forma puramente térmica a 500-700 °C.
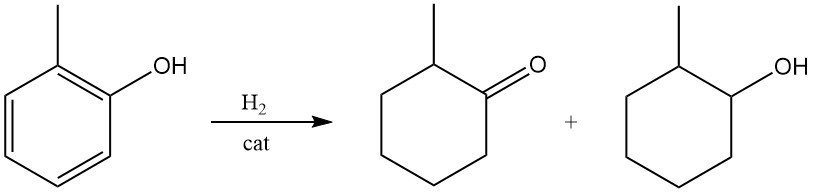
La 2-metilciclohexanona o el 2-metilciclohexanol pueden formarse en condiciones suaves mediante la hidrogenación de o-cresol sobre catalizadores de níquel Raney o metales nobles.
El o-cresol es sensible a la oxidación y, dependiendo del agente oxidante y las condiciones de reacción, produce una gran cantidad de compuestos como hidroquinonas, quinoles, quinonas, cetonas cíclicas, furanos, cresoles diméricos y triméricos, y éteres tolílicos.
Si el grupo hidroxilo del o-cresol se protege mediante esterificación o eterificación, el grupo metilo puede monoclorarse, diclorarse o triclorarse selectivamente, o bien oxidarse selectivamente a un grupo formilo (p. ej., con dióxido de manganeso u oxígeno) o a un grupo carboxilo (ácido salicílico) con una solución de permanganato ácido.
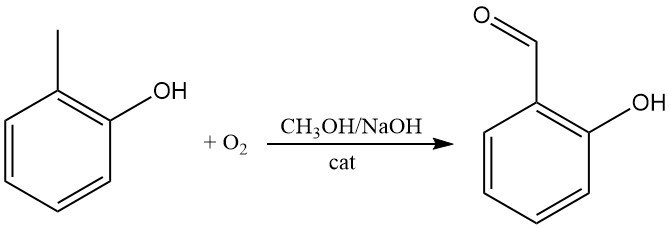
El o-cresol puede oxidarse directamente con oxígeno para producir 2-hidroxibenzaldehído, p. ej., en hidróxido de sodio metanólico en presencia de cantidades catalíticas de tetraarilporfinas de hierro.
La fusión alcalina del o-cresol en presencia de óxido de plomo o dióxido de manganeso produce directamente ácido 2-hidroxibenzoico.
Al igual que el fenol, el o-cresol experimenta fácilmente sustitución electrofílica, principalmente en las posiciones o y p con respecto al grupo hidroxilo. Por lo tanto, puede nitrarse incluso con ácido nítrico diluido.
La nitrosación, halogenación, sulfonación, alquilación y acilación ocurren con facilidad. Cuando el o-cresol se calienta con catalizadores de Friedel-Crafts, como el AlCl3, se isomeriza a m-cresol, el isómero termodinámicamente más estable.
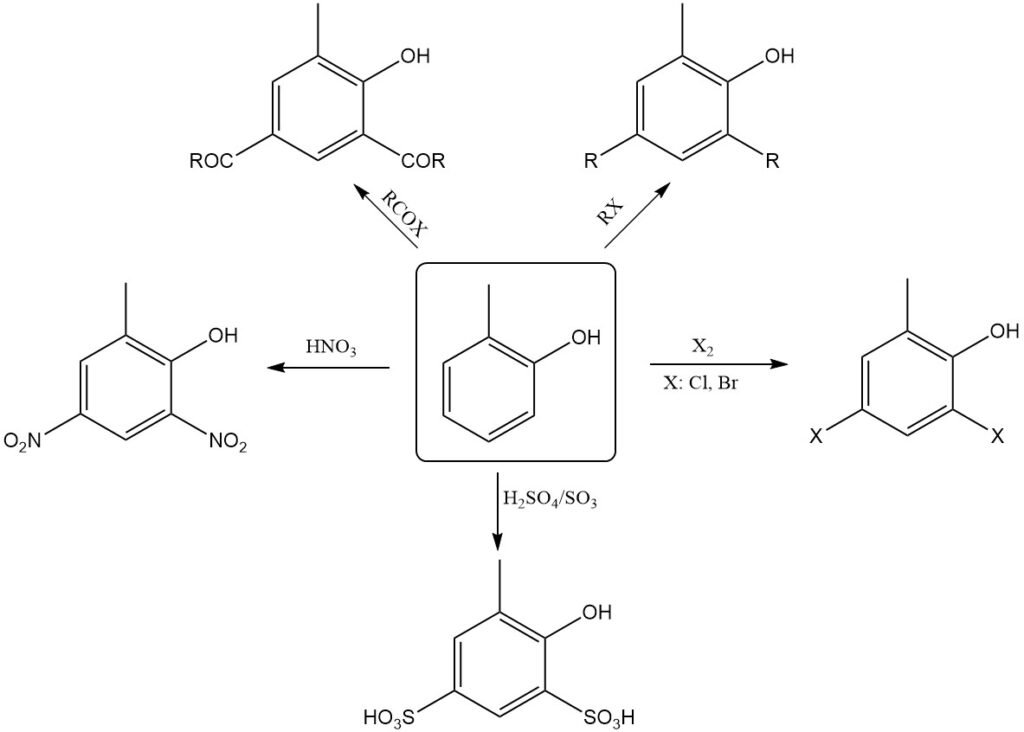
El calentamiento de o-cresolatos de metales alcalinos secos con CO2 bajo presión produce ácidos hidroxi(metil)benzoicos (reacción de Kolbe-Schmitt).
La reacción del formaldehído con o-cresol en presencia de álcali a temperatura ambiente produce alcoholes hidroxi(metil)bencílicos, que en condiciones ácidas o a temperaturas elevadas se condensan para formar resinas de alto peso molecular.
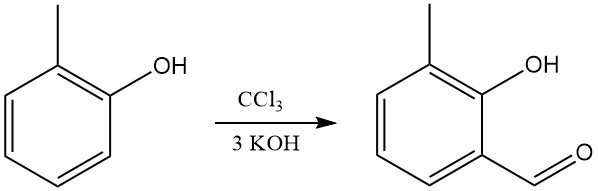
El o-cresol reacciona con cloroformo y álcali para formar principalmente o-hidroxi(metil)benzaldehídos (síntesis de Reimer-Tiemann).
El o-cresol muestra propiedades corrosivas agresivas frente a diversos metales, especialmente a temperaturas elevadas. El grado de corrosión se ve afectado por la presencia de agua en la solución de cresol.
Los aceros inoxidables al cromo-níquel y los aceros al cromo ofrecen una resistencia limitada a la corrosión por o-cresol. El níquel presenta una resistencia superior a la corrosión, mientras que el tántalo se considera totalmente resistente.
El aluminio y sus aleaciones son susceptibles a la corrosión severa, especialmente con bajo contenido de agua, y las aleaciones de cobre y latón deben evitarse debido a su susceptibilidad a la corrosión.
3. Formación y aislamiento del cresol
Los cresoles (una mezcla de isómeros orto, meta y para) se obtenían históricamente exclusivamente del alquitrán de hulla. Tras la Segunda Guerra Mundial, surgieron las cáusticas usadas de las refinerías como una fuente adicional. Desde mediados de la década de 1960, la producción sintética de cresoles ha experimentado un crecimiento significativo.
Actualmente, el «cresol sintético» representa aproximadamente el 60% de la demanda en Estados Unidos, Europa y Japón, mientras que el «cresol natural», derivado del alquitrán de hulla y de los cáusticos usados de refinería, representa tan solo alrededor del 40%.
Una mezcla de cresoles, xilenoles y diversos compuestos fenólicos se encuentra en las aguas residuales generadas por los procesos de craqueo, alquitranes y productos similares al alquitrán derivados del craqueo térmico, el craqueo térmico oxidante y el craqueo térmico hidrogenante de materiales naturales como el carbón bituminoso, el lignito, la pizarra bituminosa, la turba, la madera, la lignina y otros biomateriales.
Los rendimientos y las cantidades relativas de cresoles, xilenoles y otros fenoles producidos dependen no solo del material de partida, sino también de las condiciones del proceso, como la temperatura, el tiempo de residencia, el tipo de reactor y el modo de operación.
En el caso del carbón bituminoso, la hidrogenación produce las mayores cantidades, seguida de la carbonización a baja temperatura, mientras que la coquización a alta temperatura produce los rendimientos más bajos. La gasificación del lignito produce significativamente más fenoles, cresoles y xilenoles que el carbón bituminoso.
También se forman pequeñas cantidades de cresoles, xilenoles y otros derivados fenólicos durante el craqueo catalítico y térmico de fracciones de petróleo, en particular el craqueo térmico de coquización.
Actualmente, los cresoles y xilenoles se aíslan principalmente de los alquitranes de hulla obtenidos mediante coquización a alta temperatura, carbonización a baja temperatura, gasificación de carbón a presión Lurgi y cáusticos usados de refinería.
3.1. Aislamiento de cresol a partir de alquitranes de hulla

Históricamente, el alquitrán de hulla ha sido una fuente importante de cresoles y xilenoles. Sin embargo, su producción ha disminuido constantemente durante las últimas cuatro décadas, con una producción anual estimada de 30.000 a 40.000 toneladas.
El alquitrán de coquería de alta temperatura, un subproducto de la producción de coque metalúrgico, contiene aproximadamente entre un 0,4 % y un 0,6 % de fenol, entre un 0,8 % y un 1 % de cresoles y entre un 0,2 % y un 0,5 % de xilenoles.
En el Reino Unido, también se producían cresoles a partir de alquitranes de hulla de baja temperatura obtenidos en la producción de combustibles sin humo. Sin embargo, la disponibilidad de estos alquitranes disminuyó significativamente en la década de 1990.
Actualmente, la mayor fuente de cresoles «naturales» son los subproductos líquidos obtenidos de la gasificación del carbón bituminoso mediante el proceso Lurgi. Este proceso se utiliza principalmente en Sudáfrica para la producción de gas de síntesis para las plantas Fischer-Tropsch.
Los subproductos líquidos de este proceso, de composición similar a la de los alquitranes de baja temperatura, producen un estimado de 35.000 a 55.000 toneladas de cresoles y xilenoles al año.
En Estados Unidos, los coproductos líquidos de los gasificadores Lurgi de Dakota Gasification Company, que gasifica lignito para producir gas natural sintético, constituyen una fuente importante de cresoles «naturales». La producción anual estimada de esta fuente es de aproximadamente 5.000 toneladas de o-cresol y 11.000 toneladas de m/p-cresol.
Para aislar los cresoles y xilenoles del alquitrán de hulla, se emplea comúnmente la extracción con solución de hidróxido de sodio. En el proceso de fenorafina de Lurgi, se extraen el aceite carbólico, que hierve a 180-210 °C, y el filtrado de aceite de naftaleno para obtener los fenoles.
Los hidrocarburos y las bases piridínicas presentes en el fenolato cáustico crudo se eliminan mediante destilación al vapor, seguida de la liberación del fenol crudo con dióxido de carbono.
El fenolato cáustico procedente de los efluentes de las plantas de coquización, que contiene principalmente fenol y cresol con cantidades mínimas de xilenoles, se incorpora a menudo al proceso de extracción. Esto puede dar lugar a una amplia variación en la composición del fenol crudo resultante.
Por ejemplo, el fenol crudo obtenido del alquitrán de hulla de hornos de coque de alta temperatura alemanes puede contener un 15 % de agua, un 30 % de fenol, un 12 % de o-cresol, un 18 % de m-cresol, un 12 % de p-cresol, un 8 % de xilenoles y un 5 % de trimetilfenoles, junto con fenoles de mayor punto de ebullición. Para purificar aún más las fracciones de ácido cresílico de aceites neutros, bases de alquitrán, compuestos de azufre y sustancias fenólicas indeseables, Dakota Gasification Co. ha desarrollado una destilación extractiva con dietilenglicol.
Empresas como Sasol Phenolics, Merichem Co., Coalite Chemicals, Rütgers-VfT AG, DEZA Corporation y varias empresas japonesas utilizan este proceso para aislar cresoles y xilenoles del alquitrán de hulla.
3.2. Recuperación de cresol a partir de cáusticos usados de refinería
En Estados Unidos, los cresoles y xilenoles se obtienen a partir de fracciones de nafta producidas durante el craqueo catalítico y térmico en la industria petrolera. Estas fracciones contienen aproximadamente un 0,1 % de fenoles C6-C8. Durante el proceso de depuración para eliminar los compuestos de azufre de estas fracciones, también se extraen cresoles y xilenoles mediante soluciones alcalinas concentradas.
La composición de los cáusticos de cresilato usados obtenidos en este proceso varía considerablemente, y suelen contener entre un 20 % y un 25 % de fenoles C6-C8 y entre un 10 % y un 15 % de compuestos de azufre.
Hasta principios de la década de 1990, estos cáusticos eran recolectados y reprocesados por empresas especializadas. Sin embargo, debido a la creciente competencia de los productores de o-cresol sintético, las regulaciones ambientales más estrictas y la escasez de materias primas, muchas de estas empresas han cerrado sus operaciones.
Merichem es actualmente el único procesador importante de cáusticos de refinería usados en Estados Unidos.
En Northwest Petrochemical, una antigua procesadora, los tioles de la solución alcalina se oxidaban con aire para producir disulfuros, que posteriormente se decantaban. Los fenoles restantes se precipitaban con dióxido de carbono y se decantaban. Los fenoles restantes se extraían con un disolvente orgánico y se reextraían con una fase alcalina acuosa.
Este proceso produjo una mezcla de fenoles con aproximadamente un 20 % de fenol, un 18 % de o-cresol, un 22 % de m-cresol, un 9 % de p-cresol, un 28 % de xilenol y un 3 % de fenoles superiores. Esta mezcla se separaba posteriormente por destilación.
Merichem Company utiliza sulfuro de hidrógeno, un residuo de las refinerías, para precipitar fenoles en lugar de dióxido de carbono. La solución de sulfuro obtenida se concentra para producir sulfuro de sodio, que se utiliza en la industria papelera y el procesamiento de minerales.
El condensado de vapor de agua formado durante este proceso se despoja con gas natural para eliminar los compuestos olorosos y luego se pasa a través de una torre de enfriamiento. El gas natural se utiliza como combustible en el incinerador de aire del proceso final.
El agua de la planta se recicla en un sistema integrado, y la mayor parte del agua se libera al medio ambiente en forma de vapor de agua desde las torres de enfriamiento.
La Pittsburgh Consolidated Chemical Company utilizaba anteriormente un proceso que implicaba el tratamiento directo de los cáusticos usados de la refinería con gases de combustión que contenían dióxido de carbono. El fenol crudo precipitado se destilaba y se extraía con nafta ligera acuosa de metanol.
Tras eliminar los residuos de tiol y base con una resina de intercambio iónico, los ácidos cresílicos se recuperaban mediante destilación fraccionada.
La capacidad de Merichem para la producción de cresílicos era de aproximadamente 55.000 toneladas anuales en 1996. Sin embargo, esta cifra incluye fenol, xilenoles y otros alquilfenoles. Merichem ha ampliado sus operaciones para incluir el procesamiento de cresílicos de diversas fuentes, incluyendo plantas de gasificación de carbón.
La recuperación de cresoles y xilenoles a partir de cáusticos usados de refinería se ha limitado principalmente a Estados Unidos. En Alemania, las diferentes técnicas de refinería y la producción de cáusticos usados con cresol podrían no ser adecuadas para un reprocesamiento económico. Además, la transición hacia el hidrotratamiento y el proceso Merox en las refinerías ha reducido la producción de cáusticos usados y la recuperación de cresoles.
4. Producción industrial de o-Cresol
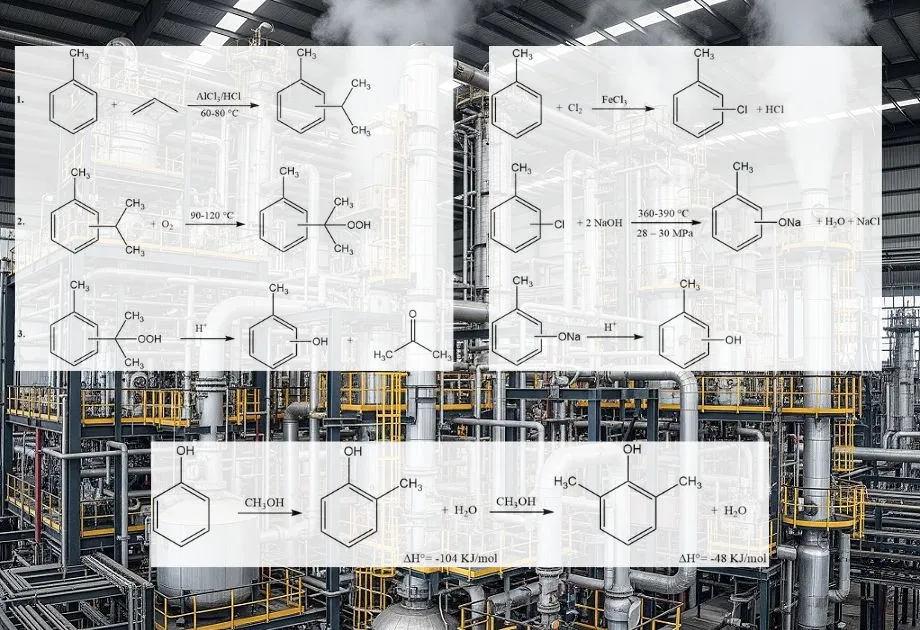
El ortocresol (o-cresol) se produce principalmente mediante métodos sintéticos, ya que la recuperación tradicional del alquitrán de hulla y las cáusticas de refinería es insuficiente para satisfacer la demanda mundial. Estos procesos producen una mezcla de isómeros de cresol. De estas mezclas, solo el o-cresol puede separarse como producto puro mediante destilación.
Se emplean varios procesos industriales, que a menudo parten de tolueno o fenol:
- Metilación del fenol en fase vapor: Este es un método industrial ampliamente utilizado. El fenol reacciona con metanol en fase gaseosa sobre un catalizador ácido sólido, como alúmina, óxido de magnesio u óxido de galio. La reacción suele ocurrir a temperaturas elevadas (p. ej., 200-400 °C). Este proceso produce selectivamente o-cresol y 2,6-xilenol.
- Hidrolisis alcalina de clorotolueno: Este método implica la hidrólisis del 2-clorotolueno en un medio alcalino. El átomo de cloro se reemplaza por un grupo hidroxilo, lo que da lugar a la formación de o-cresol. Este proceso puede producir una mezcla de isómeros de cresol, con proporciones variables según las condiciones específicas y los catalizadores utilizados.
- Fusión alcalina de toluenosulfonatos: Este proceso utiliza tolueno como materia prima, que primero se sulfona para formar ácido toluenosulfónico. La sal sódica del ácido toluenosulfónico se somete a fusión alcalina (reacción con hidróxido de sodio fundido) para producir cresóxido de sodio, que posteriormente se acidifica para producir cresol.
- Descomposición del hidroperóxido de cimeno: Este proceso, que también parte del tolueno, implica la formación de cimeno (isopropiltolueno), que posteriormente se oxida a hidroperóxido de cimeno. La posterior descomposición (descomposición) catalizada por ácido del hidroperóxido de cimeno produce cresol y acetona.
Para un artículo completo y detallado sobre la producción de cresol, consulte el siguiente artículo.
5. Usos del o-Cresol
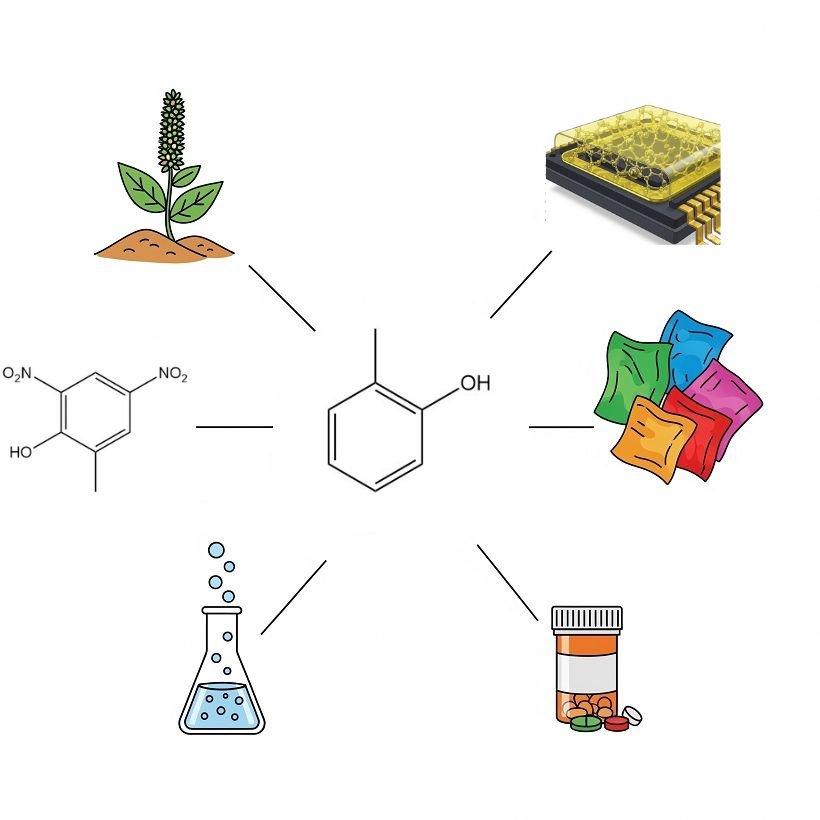
El o-cresol sirve como un intermedio químico versátil y disolvente en diversas industrias.
Una de sus principales aplicaciones en Europa es su cloración a 4-cloro-o-cresol, que se utiliza como precursor de ácidos clorofenoxialcanoicos, como el ácido 4-cloro-2-metilfenoxiacético, el ácido 2-(4-cloro-2-metilfenoxi)-propiónico y el ácido γ-(4-cloro-2-metilfenoxi)butírico, todos conocidos como herbicidas selectivos.
Una cantidad menor de o-cresol se somete a nitración para producir 4,6-dinitro-o-cresol. Este derivado presenta propiedades herbicidas e insecticidas. También se utiliza como inhibidor de la polimerización durante la producción y destilación de estireno.
El o-cresol de alta pureza se utiliza cada vez más, especialmente en Japón, en la fabricación de resinas novolaca de epoxi-o-cresol (resinas ECN). Estas resinas se emplean como materiales de sellado para circuitos integrados. El o-cresol de calidad estándar se utiliza en la modificación de resinas convencionales de fenol-formaldehído.
El o-cresol también es un precursor importante para diversos intermedios de colorantes. Cuantitativamente, el ácido o-cresotínico (ácido o-hidroximetilbenzoico), sintetizado mediante la reacción de Kolbe, es el más significativo. Este ácido se utiliza posteriormente en la producción farmacéutica, mientras que sus ésteres metílicos se emplean como auxiliares de coloración.
Una cantidad considerable de o-cresol se utiliza como disolvente, ya sea directamente o tras la hidrogenación a 2-metilciclohexanol o 2-metilciclohexanona. Su forma de éster carbonato sirve como materia prima en la síntesis de cumarina.
La alquilación del o-cresol con propeno produce carvacrol (3-isopropil-6-metilfenol), que se emplea como antiséptico y en fragancias.
Pequeñas cantidades de o-cresol se alquilan con isobuteno, lo que sirve como materia prima para diversos antioxidantes, componentes para materiales de registro térmico y productos farmacéuticos, como el relajante muscular mefenesina.
Referencias
- Cresols and Xylenols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a08_025
- Cresols; Encyclopedia of Toxicology, Volume 1. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543002967
