Métodos de producción de aminas alifáticas
La producción de aminas implica diferentes métodos, cada uno adecuado para materias primas específicas y productos deseados. Las aminas alifáticas se producen a partir de alcoholes, compuestos carbonílicos, nitrilos, haluros de alquilo, compuestos nitro y olefinas.
Tabla de contenido
1. Producción de aminas a partir de alcoholes
La técnica más frecuente para sintetizar alquilaminas inferiores implica la reacción entre un alcohol adecuado y amoníaco utilizando un catalizador apropiado. Esta reacción produce una mezcla de aminas primarias, secundarias y terciarias debido a la capacidad de la amina primaria formada inicialmente para reaccionar más con una o dos moléculas de alcohol.
Mientras que la conversión de alcohol en amina primaria presenta características termoneutrales, la formación de aminas secundarias y terciarias es exotérmica, lo que favorece la termodinámica. Además, la amina primaria exhibe una mayor reactividad que el amoníaco debido a su mayor naturaleza nucleofílica.
La distribución de productos se puede controlar parcialmente ajustando las condiciones de reacción como la temperatura, el exceso de amoníaco y el tiempo de residencia. Como la mezcla de aminas obtenida a menudo no cumple con los requisitos del mercado, las aminas no comercializables pueden reciclarse, aumentando así el rendimiento de la amina deseada a más del 90%.
RCH2OH + NH3 ↔ RCH2NH2 + H2O
RCH2NH2 + RCH2OH ↔ (RCH2)2NH + H2O
(RCH2)2NH + RCH2OH ↔ (RCH2)3N + H2O
Anteriormente, esta reacción se llevaba a cabo utilizando catalizadores de deshidratación puros como alúmina, sílice, titania, óxido de torio, óxido de tungsteno, óxidos de cromo, fosfatos u diversos óxidos mixtos (por ejemplo, sílice-alúmina, arcillas, zeolitas) a temperaturas de hasta 500 °C. . Sin embargo, el uso de estos catalizadores ahora se limita a la producción de metilamina.
Para la conversión de alcoholes que contienen dos o más átomos de carbono han cobrado importancia los catalizadores con propiedades hidrogenantes y deshidrogenantes. Se emplean principalmente catalizadores a base de níquel, cobalto, cobre, hierro, platino o paladio, mostrando los catalizadores de metales nobles una tendencia a provocar la escisión de los enlaces C-C o C-N, lo que conduce a selectividades más bajas. Se añaden promotores como Ag, Zn, In, Mn, Mo y metales alcalinos para mejorar el rendimiento del catalizador.
Normalmente, los componentes activos están soportados sobre soportes como Al2O3, SiO2 o ZrO2. Se han propuesto zeolitas como vehículos para mejorar la selectividad hacia aminas primarias. En este proceso continuo se hacen pasar el alcohol, el amoníaco y el hidrógeno a través del catalizador en un reactor de lecho fijo.
La reacción se produce a presiones de aproximadamente 0,5 a 25 MPa y temperaturas de aproximadamente 100 a 250 °C, dependiendo del catalizador y de la elección entre procesos en fase líquida y gaseosa.
El paso inicial y determinante de la velocidad es la deshidrogenación del alcohol para formar el compuesto carbonílico. La adición posterior de amoníaco provoca la pérdida de agua y la formación de una imina o una enamina, que luego se hidrogena para producir la amina final.
Las reacciones secundarias incluyen la desproporción de aminas, particularmente a temperaturas de reacción más altas, y en menor medida, la condensación aldólica de aldehídos intermedios, la formación de una base de Schiff entre estos aldehídos y el producto de amina y la formación de nitrilo a altas temperaturas y bajas presiones de hidrógeno.
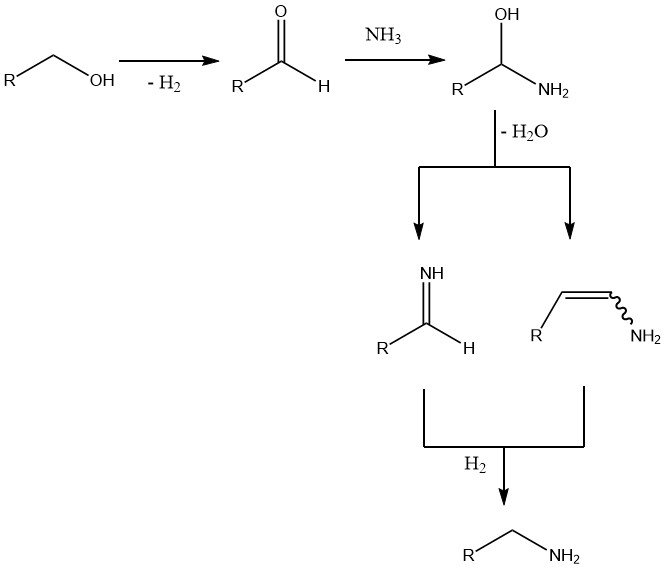
Se utiliza un exceso de dos a ocho veces la cantidad de amoníaco para desplazar el equilibrio hacia las aminas primarias. Si bien el hidrógeno no participa directamente en la reacción, su ausencia da como resultado la formación de iminas, enaminas e incluso nitrilos.
Además, el hidrógeno ayuda a mantener la actividad del catalizador eliminando depósitos carbonosos y carburos o nitruros metálicos, además de prevenir la desproporción de los productos de amina.
La aminación de dioles y polioles sigue principios similares a los de los monoalcoholes, aunque la aparición de reacciones secundarias como las ciclaciones complica el proceso.
Se puede emplear la misma metodología para alquilar aminas primarias o secundarias en lugar de amoníaco. Cuando reaccionan una amina y un alcohol con diferentes sustituyentes alifáticos, se produce una amina alifática mixta. Por ejemplo, la N,N-dimetiletilamina se puede sintetizar a partir de dimetilamina y etanol.
Para evitar la transalquilación en el átomo de nitrógeno durante tales reacciones, se recomiendan catalizadores de cobre. El cromito de cobre, en particular, es un catalizador eficaz para aminas terciarias de cadena larga como la dimetildodecilamina.
2. Producción de aminas a partir de compuestos carbonílicos
Si es más rentable, se prefieren los aldehídos y las cetonas a los alcoholes para la síntesis de aminas. Sin embargo, esto generalmente se limita a los aldehídos inferiores obtenidos de la oxosíntesis y la acetona producida como subproducto en la producción de fenol (síntesis de Hock).
La reacción entre un compuesto carbonílico y amoníaco o una amina se produce en dos pasos. Inicialmente se forma una imina o base de Schiff, que luego se hidrogena con hidrógeno en un segundo paso para producir la amina. El procedimiento típico es similar a la conversión de alcohol, donde la mezcla de reacción que contiene el compuesto carbonílico, amoníaco e hidrógeno se pasa sobre un catalizador de lecho fijo.
En algunos casos, puede resultar beneficioso realizar la reacción en dos etapas. Primero reaccionan el compuesto carbonílico y el amoníaco o la amina, se elimina el agua resultante y luego se realiza la etapa de hidrogenación.
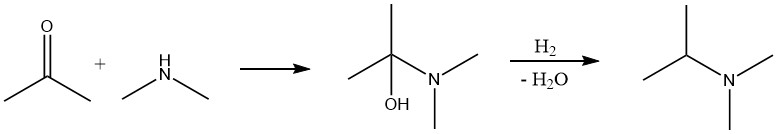
La diferencia clave entre aminar un aldehído o cetona y un alcohol es que el hidrógeno actúa como reactivo y se consume en una cantidad estequiométrica en el primer caso.
Debido al calor de reacción considerablemente mayor en este proceso (por ejemplo, 60,4 kJ/mol para acetona en comparación con 7,1 kJ/mol para alcohol isopropílico), se requiere un diseño de reactor diferente.
Normalmente, el proceso se lleva a cabo en fase de vapor a temperaturas de 100 a 160 °C y presión atmosférica o ligeramente superior a la atmosférica. También se pueden emplear procesos de alta presión si el calor de reacción se elimina de manera efectiva, como mediante una alta tasa de reciclaje o usando un reactor multitubular. Las temperaturas de reacción más bajas en comparación con las reacciones con alcohol permiten en principio selectividades más altas.
En general, se pueden utilizar los mismos catalizadores utilizados para la aminación hidrogenativa de alcoholes. El control de la distribución del producto ajustando el exceso de amoníaco y el tratamiento basado en destilación también son similares. Se encuentran disponibles revisiones detalladas que analizan las posibilidades industriales y preparativas para sintetizar aminas a partir de compuestos carbonílicos.
Si bien se pueden usar agentes reductores alternativos en lugar de hidrógeno, su importancia industrial es limitada debido a los desafíos en el manejo y su costo (por ejemplo, selenofenol o NaBH4).
La reacción de Leuckart-Wallach, que emplea formiato de amonio para aminar el compuesto carbonílico con la generación de CO2 como subproducto, ha encontrado alguna aplicación.
3. Producción de aminas a partir de nitrilos
En muchos casos, los nitrilos son más rentables de obtener que sus correspondientes alcoholes o compuestos carbonílicos. Existen varios métodos para sintetizar nitrilos, incluida la amoxidación, la adición de una amina o alcohol al acrilonitrilo o la conversión del ácido carboxílico correspondiente.
Para convertir los nitrilos en las aminas correspondientes se prefiere la hidrogenación catalítica. Generalmente se emplean catalizadores de metales nobles como paladio, platino y rodio, así como catalizadores de níquel, cobalto y, cada vez más, de hierro.
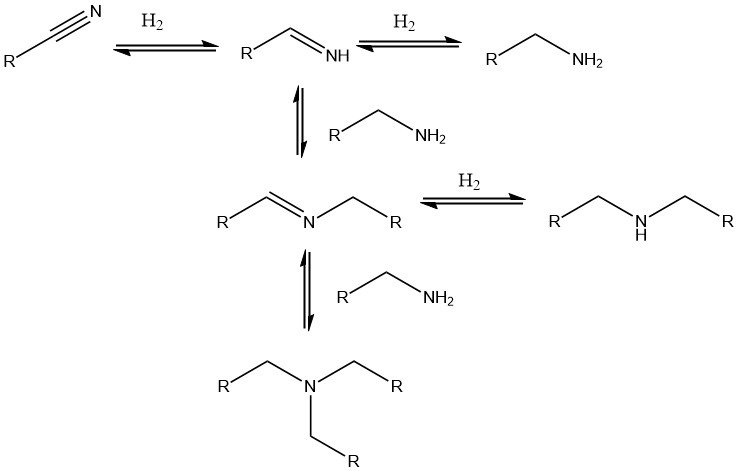
Los catalizadores de metales nobles soportados permiten condiciones de reacción más suaves (20-100 °C, 0,1-0,5 MPa), mientras que los catalizadores de níquel o cobalto requieren presiones más altas de hasta 25 MPa y temperaturas de hasta 180 °C. Cuando los di o polinitrilos se hidrogenan a di o poliaminas, a menudo se añade una base como NaOH al catalizador.
Existen diferentes variaciones del proceso, pero las más utilizadas son el proceso discontinuo con catalizador suspendido y el proceso continuo con catalizador de lecho fijo.
Las reacciones secundarias que conducen a la formación de aminas secundarias son inevitables, pero pueden suprimirse añadiendo amoníaco, una solución de hidróxido de sodio o un ácido.
Alternativamente, las condiciones del proceso se pueden ajustar para priorizar la formación de aminas secundarias o terciarias. Este enfoque es útil, por ejemplo, en la síntesis de di y trietilamina a partir de acetonitrilo o dibutilamina a partir de butironitrilo.
La hidrogenación del acrilonitrilo es un caso especial. Si bien las aminas saturadas suelen ser los únicos productos de esta reacción, el uso de cromito de cobre como catalizador en lugar de metales nobles, níquel o cobalto conduce a la formación de alilamina y dialilamina.
Muchas hidrogenaciones importantes de nitrilo para producir las aminas correspondientes se basan en reacciones de adición previas que involucran acrilonitrilo. Los alcoholes se pueden agregar al acrilonitrilo solo en presencia de un catalizador básico como NaOH, KOH o hidróxidos de amonio cuaternario.
Puesto que las aminas mismas son suficientemente básicas, la adición se produce fácilmente. En algunos casos, pueden ser necesarias temperaturas más altas para la cianoetilación y se han descrito estabilizadores para prevenir la polimerización del acrilonitrilo.
4. Síntesis de aminas a partir de haluros de alquilo
Cuando un haluro de alquilo reacciona con amoníaco o una amina, se forma un haluro de alquilamonio, que puede convertirse en amina mediante tratamiento con una solución alcalina fuerte.
Aunque este método se usa comúnmente en química preparativa, tiene una importancia industrial limitada, y se emplea principalmente para la producción de etilendiamina, poliaminas y algunas aminas especializadas como alilamina y ciertos productos farmacéuticos con bajos volúmenes de producción.
Las razones de su uso limitado a escala industrial son el alto costo de los materiales de partida, los desafíos relacionados con la corrosión y la calidad del producto durante el procesamiento de haluro, y la necesidad de eliminar el subproducto salino resultante.
5. Síntesis de aminas a partir de compuestos nitro
Si bien la reducción de compuestos nitro es un método vital para sintetizar aminas aromáticas, no ha ganado importancia significativa en la producción de aminas alifáticas. Debido a la disponibilidad limitada de nitroalcanos adecuados, este método sólo se emplea en casos específicos, como la producción de 2-amino-2-metil-1-propanol utilizado en la formulación de soluciones tampón, recubrimientos de látex, fluidos para trabajar metales y cosméticos.
El proceso de reducción implica la formación de un intermedio nitroso o hidroxilamina y, en algunos casos, puede ocurrir a temperatura ambiente, produciendo productos de amina con rendimientos del 90% o más. Se utilizan catalizadores de hidrogenación como platino, paladio, rodio, níquel o cobre.
La reacción es altamente exotérmica (aproximadamente 500 kJ/mol por grupo nitro), lo que requiere una eliminación eficiente del calor para el control del proceso. Las nitroparafinas plantean mayores desafíos para la hidrogenación en comparación con sus contrapartes aromáticas.
Se ha informado de la funcionalización de alquenos utilizando NO o NO2, que se produce a través de un mecanismo radicalario y da como resultado una mezcla de productos que incluyen nitroalquenos. Sin embargo, la reducción de nitroalquenos a aminas no ha encontrado hasta ahora aplicación industrial.
De manera similar, se han obtenido aminas primarias a partir de parafinas mediante nitración con HNO3 o NO2 líquido, seguida de hidrogenación de la mezcla resultante de nitroparafinas y cetonas en presencia de amoníaco.
6. Producción de aminas a partir de olefinas
Las aminas que tienen un grupo alquilo terciario junto al átomo de nitrógeno, como la terc-butilamina, son difíciles de sintetizar utilizando métodos convencionales. Sin embargo, estos compuestos se pueden preparar fácilmente añadiendo cianuro de hidrógeno a un alqueno, como el 2-metilpropeno, en un medio ácido.
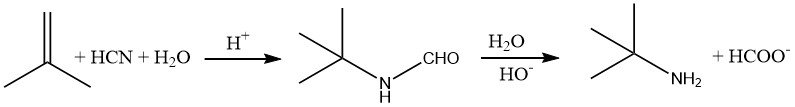
Esta reacción, conocida como reacción de Ritter, normalmente se lleva a cabo a temperaturas de 30 a 60 °C. A continuación, el intermedio de formamida resultante se hidroliza calentando la mezcla de reacción a aproximadamente 100 °C.
Para aislar la amina, se neutraliza la mezcla ácida, lo que da como resultado la formación de formiato de sodio y la sal del ácido original (p. ej., sulfato de sodio).
Debido a las dificultades asociadas con la manipulación del ácido cianhídrico, que es corrosivo y plantea problemas de seguridad, un átomo de carbono se pierde como formiato durante la reacción y una cantidad significativa de sal (aproximadamente 3,3 kg/kg de terc-butilamina) debe eliminarse en pozos profundos. Como resultado, este proceso se limita a la síntesis de aminas que no se pueden obtener por otros métodos.
Aunque la adición directa de amoníaco o una amina a un doble enlace olefínico es termodinámicamente favorable, se limita a unos pocos casos específicos que involucran aminas activadas o compuestos con dobles enlaces activados. Un ejemplo es la adición de una amina al acrilonitrilo.
Sin embargo, es posible añadir amoníaco a alquenos no activados bajo presión utilizando catalizadores. Las zeolitas ácidas son catalizadores particularmente eficaces para esta reacción. La primera demostración exitosa fue la formación de etilamina a partir de etileno y amoníaco utilizando H-mordenita.
Aunque la conversión en la aminación directa de alquenos suele ser baja debido a limitaciones cinéticas y termodinámicas, la selectividad por monoalquilaminas puede ser excelente con la elección adecuada de zeolita y alqueno. Las zeolitas de poro pequeño son muy adecuadas para la producción de etilaminas, mientras que las zeolitas de poro medio se pueden utilizar para la síntesis de terc-butilamina. Ciertas zeolitas de poro grande han mostrado mejoras con respecto a las zeolitas de poro mediano.
Se han logrado altas selectividades (>95%) con conversiones aceptables (10-15%) en la aminación de isobuteno sobre zeolitas RE-Y y zeolitas tipo pentasilo sustituidas con Al, Fe o B a temperaturas de 250- 300 °C y presiones alrededor de 30 MPa. Estas zeolitas exhiben una excelente estabilidad a largo plazo en comparación con las zeolitas X e Y.
La aminación de alquenos catalizada homogéneamente se limita a casos específicos. Aunque no es muy selectiva, la hidroformilación de alquenos en presencia de amoníaco o aminas muestra potencial para futuras aplicaciones. Sin embargo, este método actualmente enfrenta desafíos, ya que, además de las aminas deseadas derivadas de n-aldehído e isoaldehído, se forman cantidades significativas de alcoholes y productos de dimerización.
7. Otros procesos
La hidrogenación de aminas aromáticas para dar cicloalquilaminas se limita principalmente a la producción de ciclohexilamina a escala industrial. Otras cicloalquilaminas no se sintetizan habitualmente mediante este método a nivel industrial.
Se ha descrito un proceso para sintetizar aminas a partir de monóxido de carbono, hidrógeno y amoníaco o aminas utilizando un catalizador de hierro activado basado en la reacción de tipo Fischer-Tropsch. Sin embargo, este método no se emplea ampliamente a escala industrial.
La reducción de amidas y otras rutas sintéticas mencionadas en la literatura, si bien existen, son principalmente métodos de laboratorio adecuados para preparaciones a pequeña escala. Estos métodos rara vez se utilizan a nivel industrial, existiendo sólo casos aislados en los que se implementan.
Referencia
- Amines, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
