Cloruro de acetilo: propiedades, reacciones, producción y usos
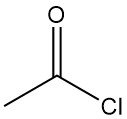
¿Qué es el cloruro de acetilo?
El cloruro de acetilo, también conocido como cloruro de etanoílo, es un compuesto orgánico con la fórmula molecular CH3COCl. Es un líquido incoloro, corrosivo y muy irritante, con un olor sofocante.
Concentraciones de cloruro de acetilo tan bajas como 0,5 ppm inducen lagrimeo y causan ardor en los ojos, las fosas nasales y la garganta. El cloruro de acetilo es tóxico porque reacciona fácilmente con los grupos hidroxilo, sulfhidrilo y amino, produciendo modificaciones que inhiben la actividad de enzimas esenciales en los tejidos vivos.
Tabla de contenido
1. Propiedades físicas del cloruro de acetilo
El cloruro de acetilo es un líquido incoloro y corrosivo. Sus principales propiedades físicas se resumen en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Número de registro CAS | 75-36-5 |
| Fórmula molecular | C2H3OCl |
| Masa molar (g/mol) | 78,50 |
| Punto de congelación (°C) | -112,0 |
| Punto de ebullición (°C, 101,3) kPa) | 50,2 |
| Densidad (g/mL) a 4 °C | 1,1358 |
| Densidad (g/mL) a 20 °C | 1,1051 |
| Densidad (g/mL) a 25 °C | 1,0982 |
| Entalpía estándar de formación (ΔHf, kJ/mol) | -243,93 |
| Entalpía de vaporización en el punto de ebullición (ΔHv, kJ/g) | 0,36459 |
| Índice de refracción (nD20) | 1,38976 |
2. Reacciones químicas del cloruro de acetilo
El cloruro de acetilo experimenta una amplia gama de reacciones químicas y se utiliza en síntesis orgánica para:
- Acetilación electrofílica de arenos, alquenos, alquinos, alcanos saturados, organometálicos y enolatos (en C u O)
- Escisión de éteres
- Esterificación de alcoholes estéricamente libres o sensibles al ácido
- Generación de soluciones de cloruro de hidrógeno anhidro en metanol
- Como agente deshidratante
- Como Solvente para reacciones organometálicas
- Para la desoxigenación de sulfóxidos
- Como depurador de cloro y bromo
- Como fuente de cetena
- Para la acetilación nucleófila
En disolventes inertes como el disulfuro de carbono o el éter de petróleo, el cloruro de acetilo reacciona con hidrocarburos aromáticos y olefinas para producir cetonas. Estas reacciones son catalizadas por ácidos de Lewis, con una actividad catalítica creciente en el siguiente orden:
ZnCl2 < BiCl3 < TeCl4 < TiCl4 < SnCl4 < TeCl2 < FeCl3 < SbCl5 < AlCl3
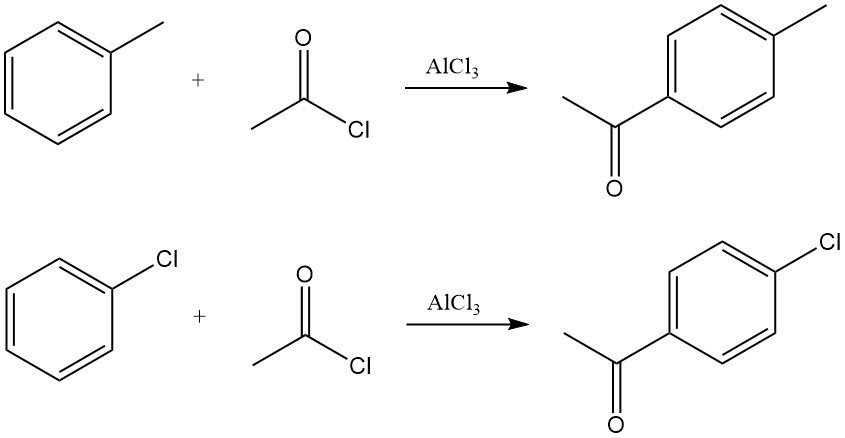
Los arenos reaccionan con cloruro de acetilo en presencia de ácidos de Lewis, típicamente cloruro de aluminio, para producir arilmetilcetonas. La reacción se produce mediante la generación del ion acilio, que sufre una sustitución aromática electrofílica.
Por ejemplo, la acetilación del tolueno produce predominantemente p-metilacetofenona, mientras que la acetilación del clorobenceno produce p-cloroacetofenona con alta selectividad.
Los alquenos reaccionan con cloruro de acetilo en condiciones de Friedel-Crafts para formar mezclas de cloroalquilmetilcetonas y productos relacionados. Los alquenos deficientes en electrones, como el etileno y el cloruro de alilo, ofrecen buenos rendimientos, mientras que los alquenos superiores suelen experimentar reordenamientos.
Por ejemplo, la reacción del cloruro de acetilo con ciclohexeno utilizando AlCl3 como catalizador produce 2-clorociclohexilmetilcetona y 4-clorociclohexilmetilcetona.

Los alquinos experimentan acetilación electrofílica en condiciones similares. El acetileno tratado con cloruro de acetilo y cloruro de aluminio produce β-clorovinilmetilcetona, mientras que los alquinos superiores producen productos cetónicos con rendimientos de moderados a altos.
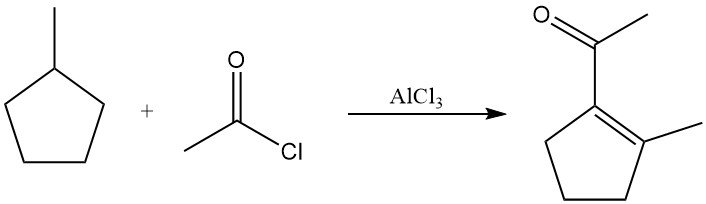
En presencia de cloruro de acetilo y cloruro de aluminio a temperatura elevada, los alcanos saturados experimentan deshidrogenación a alquenos, seguida de acetilación. Los productos suelen ser vinilmetilcetonas o alquilmetilcetonas saturadas. El metilciclopentano, por ejemplo, produce 1-acetil-2-metilciclopenteno con un rendimiento significativo.
El cloruro de acetilo reacciona con una amplia gama de compuestos organometálicos, como reactivos de Grignard, organolitio, organocinc y organocuprato, para producir metilcetonas. Con frecuencia se emplean catalizadores de metales de transición, como las sales de paladio o cobre, para mejorar la selectividad y el rendimiento.
Los enolatos metálicos reaccionan con el cloruro de acetilo para formar β-dicetonas. La reacción también puede dar lugar a productos O-acetilados competitivos, dependiendo del contraión metálico. El uso de enolatos de zinc o cobre mejora la selectividad para la C-acetilación. Las transformaciones relacionadas incluyen la acetilación de acetales y enaminas de sililceteno, lo que proporciona acceso a ésteres y cetonas funcionalizados.
Las cetonas y los β-cetoésteres pueden convertirse en acetatos de enol utilizando cloruro de acetilo. La reacción puede proceder a través de enolatos preformados o éteres de silil enol. Por ejemplo, las cetonas esteroidales pueden convertirse en acetatos de enol conjugados mediante tratamiento con cloruro de acetilo en presencia de bases amínicas.
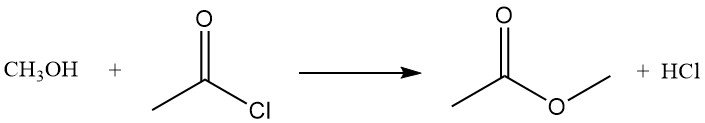
El cloruro de acetilo reacciona con alcoholes para formar ésteres o cloruros de alquilo. Los alcoholes primarios suelen formar ésteres, mientras que los secundarios y terciarios suelen formar cloruros por sustitución. La reacción del metanol con cloruro de acetilo produce acetato de metilo y cloruro de hidrógeno, y se utiliza para preparar soluciones de cloruro de hidrógeno anhidro en metanol.
Los éteres cíclicos y acíclicos pueden ser escindidos por cloruro de acetilo en presencia de sales de haluro o ácidos de Lewis. Por ejemplo, el tetrahidrofurano reacciona con cloruro de acetilo y yoduro de sodio para formar acetato de 4-yodobutilo y, en presencia de un ácido de Lewis como ZnCl2, para formar acetato de clorobutilo con un rendimiento aproximado del 76 %.
Esta propiedad hace que el cloruro de acetilo sea útil en la desprotección de grupos protectores de éter.

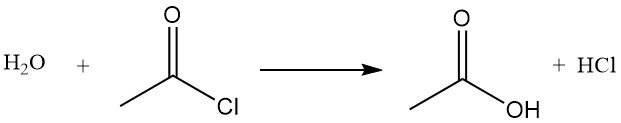
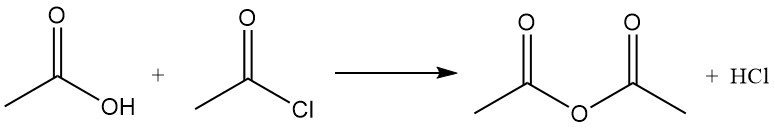
El cloruro de acetilo actúa como deshidratante al reaccionar con agua para formar ácido acético y cloruro de hidrógeno. Promueve la ciclización de ácidos dicarboxílicos a anhídridos, de cetoácidos a lactonas y de compuestos nitrogenados a óxidos de nitrilo. También se utiliza en la conversión de hidroperóxidos a cetonas insaturadas. Por ejemplo, reacciona con ácido acético para producir anhídrido acético.
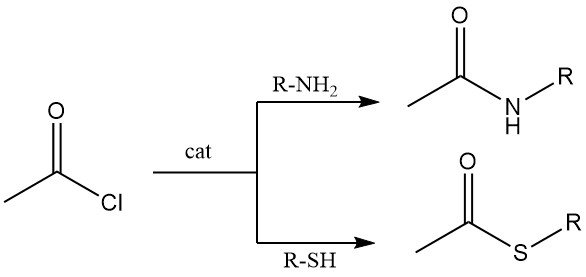
Las aminas primarias y secundarias reaccionan con cloruro de acetilo para producir acetamidas. En condiciones de Schotten-Baumann (base acuosa), la N-acetilación es eficiente, aunque la hidrólisis del cloruro de acetilo puede competir.
Las aminas terciarias producen sales de acetilamonio, que pueden descomponerse en cetenos o sufrir fragmentación de von Braun. Reacciones relacionadas incluyen la N-acetilación de iminas a enamidas y la conversión de uretanos a imidas.
Los tioles reaccionan con cloruro de acetilo para producir tioésteres. Tanto los tioles alifáticos como los aromáticos experimentan esta transformación, generalmente en presencia de cloruro de cobalto como catalizador.
El cloruro de acetilo forma aductos reversibles con aldehídos y cetonas en presencia de ácidos de Lewis, produciendo acetatos de α-cloroalquilo. Por ejemplo, la acetona reacciona con cloruro de acetilo y cloruro de zinc a baja temperatura para formar el aducto correspondiente con un buen rendimiento.
Los sulfóxidos se reducen a sulfuros mediante cloruro de acetilo en presencia de cloruro de estaño(II). La reacción se lleva a cabo en condiciones suaves y es compatible con grupos funcionales sensibles, incluidos los derivados de cefalosporina.
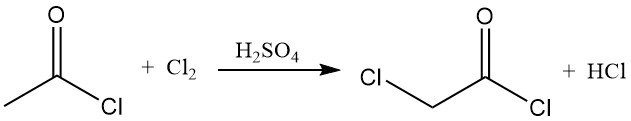
El cloruro de acetilo reacciona con cloro y bromo para formar cloruros de haloacetilo. En presencia de ácido sulfúrico, el cloro se convierte eficazmente en cloruro de cloroacetilo, un importante intermediario sintético.
Las reacciones del cloruro de acetilo con aminas terciarias, como la trietilamina, generan cetena in situ. La cetena puede ser atrapada por enolatos, enaminas o iminas para formar ésteres acetoacéticos, ciclobutanonas o aductos de dicetena.
En presencia de yoduro de samario(II), el cloruro de acetilo se comporta como un equivalente aniónico acetilo nucleófilo, dando lugar a productos acilo a partir de cetonas.
La reacción del cloruro de acetilo con peróxido de hidrógeno produce ácido peroxiacético y peróxido de acetilo, este último un compuesto altamente explosivo.
En presencia de ácidos grasos, forma anhídridos acético-alquilcarboxílicos mixtos o cloruros de acilo, ambos utilizables en reacciones de esterificación. Por ejemplo, el ácido láurico reacciona con cloruro de acetilo para formar los derivados correspondientes.
El cloruro de acetilo se reduce con reactivos organometálicos como el hidruro de litio y aluminio (LiAlH4). En presencia de alcohol terc-butílico, el LiAlH4 se convierte en hidruro de litio y tri-terc-butoxialuminio, que reduce selectivamente el cloruro de acetilo a acetaldehído. El hidruro de trifenilestaño también reduce el cloruro de acetilo.
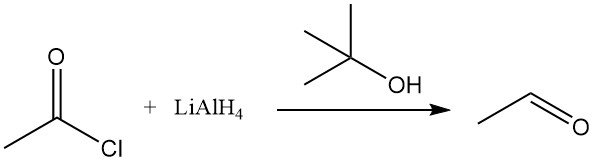
La hidrogenación catalítica del cloruro de acetilo mediante el método de Rosenmund es ineficiente, pero la reducción del anhídrido acético a diacetato de etilideno es posible en presencia de cloruro de acetilo sobre complejos de paladio. El tricloruro de rodio, el yoduro de metilo y la trifenilfosfina forman un complejo que participa activamente en la reducción del cloruro de acetilo.
3. Producción de cloruro de acetilo
El cloruro de acetilo se produce comercialmente en Europa y el Lejano Oriente. En Estados Unidos, la producción es limitada y se destina principalmente al uso in situ, en particular para la acetilación farmacéutica.
El cloruro de acetilo se describió por primera vez en la década de 1850. Se obtenía mediante la destilación de acetato de sodio anhidro con oxicloruro de fósforo.
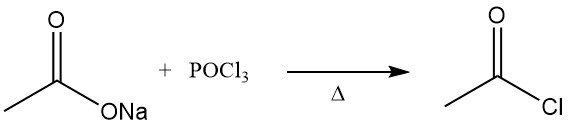
El antiguo método de fabricación de cloruro de acetilo consistía en la reacción del cloruro de tionilo (SOCl2) con acetato de cal gris. Este proceso ha sido sustituido en gran medida por la reacción del acetato de sodio o ácido acético con tricloruro de fósforo (PCl3). En la Unión Soviética se ha seguido aplicando un método similar. Ambos métodos son relativamente caros.
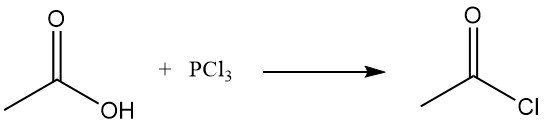
La carbonilación del cloruro de metilo con monóxido de carbono para producir cloruro de acetilo se ha descrito en varias patentes. Estos procesos utilizan catalizadores basados en complejos de rodio, paladio o iridio en combinación con compuestos de yodo y yoduros de fosfonio u óxidos de fosfina.
Por ejemplo, una reacción reportada produjo una conversión del 56 % a cloruro de acetilo a una temperatura de 453 K y una presión de 8360 kPa. Estas reacciones son factibles gracias a la disponibilidad de aleaciones resistentes a la corrosión. La aplicación industrial de este método no ha sido confirmada.
Las preparaciones alternativas incluyen la reacción del ácido acético con etilenos clorados en presencia de cloruro férrico, la combinación de cloruro de bencilo con ácido acético (rendimiento del 85%), la conversión de dicloruro de etilideno (rendimiento del 91%) y la descomposición del acetato de etilo por fosgeno para formar cloruro de acetilo y cloruro de etilo. El alto costo de las materias primas y el equipo hace inviable la ruta del fosgeno.
La cloración del ácido acético a ácido monocloroacético también produce cloruro de acetilo como subproducto. Debido a su alto costo de recuperación, el cloruro de acetilo suele reciclarse a ácido monocloroacético. Un método patentado describe la depuración de mezclas de cloruro de acetilo y cloruro de hidrógeno con ácido sulfúrico para formar sulfato de acetilo.
Una patente estadounidense informa sobre una mejora en el rendimiento de cloruro de acetilo mediante la reacción del anhídrido acético con cloruro de hidrógeno. En este proceso, el cloruro de acetilo y parte del subproducto, el ácido acético, se eliminan continuamente de la mezcla, mientras que los componentes restantes se reciclan al reactor para su posterior reacción.
4. Usos del cloruro de acetilo
Durante la fase inicial de la cloración del ácido acético a ácido monocloroacético se consume una pequeña cantidad de cloruro de acetilo. Una vez iniciada, el cloruro de acetilo formado como subproducto mantiene el efecto catalítico.
El cloruro de acetilo es un agente acetilante eficaz. Se utiliza en la síntesis de aspirina, acetaminofén, acetanilida y acetofenona. También se utiliza en la preparación de composiciones de cristal líquido necesarias para pantallas ópticas y dispositivos de memoria.
El cloruro de acetilo puede utilizarse para sustituir al anhídrido acético o al ácido acético como reactivo de acetilación altamente reactivo cuando las reacciones son difíciles o lentas. Esto hace que el cloruro de acetilo sea particularmente útil para la preparación de polímeros especializados que pueden quelarse con iones metálicos, como el cobre, lo que resulta en mejores propiedades eléctricas y magnéticas.
La antralina se acetila con cloruro de acetilo en tolueno, utilizando piridina como catalizador para producir 1,8-dihidroxi-10-acetilantrona, un intermediario en medicamentos para afecciones cutáneas como verrugas, psoriasis y acné. Los ésteres de azúcar se pueden sintetizar en condiciones anhidras con cloruro de acetilo de forma similar.
El cloruro de acetilo se ha utilizado en química analítica para la determinación de grupos hidroxilo, pero este método ha sido ampliamente reemplazado por técnicas espectroscópicas. Todavía se utiliza para la preparación de derivados fenólicos sin catalizadores ácidos fuertes y para la acetilación de aminas primarias y secundarias.
El cloruro de acetilo puede sustituir al anhídrido acético en muchas reacciones de acetilación. A diferencia del anhídrido, no requiere un catalizador ácido mineral. A pesar de su mayor coste, el cloruro de acetilo se utiliza ampliamente cuando la comodidad supera al coste. La reducción del coste de producción convertiría al cloruro de acetilo en una alternativa eficaz al anhídrido acético en procesos a gran escala.
5. Toxicología y seguridad
El cloruro de acetilo produce vapores sofocantes con un olor penetrante e irritante. Es altamente tóxico. Su inflamabilidad y su fuerte reactividad con el agua y los álcalis exigen precauciones estrictas durante su manipulación.
Es necesaria una ventilación adecuada para eliminar los vapores de las zonas de trabajo. El personal debe usar ropa protectora impermeable para evitar la exposición. Los contenedores a granel deben almacenarse en lugares frescos y secos, aislados de sustancias inflamables y no corrosivas.
Referencias
1. Wagner, F.S., Jr. (2002). Acetyl Chloride. In Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc (Ed.). https://doi.org/10.1002/0471238961.0103052023010714.a04.pub2
2. Pearlman, B.A. (2001). Acetyl Chloride. In Encyclopedia of Reagents for Organic Synthesis, (Ed.). https://doi.org/10.1002/047084289X.ra025
3. Le Berre, C., Serp, P., Kalck, P. and Torrence, G.P. (2014). Acetic Acid. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a01_045.pub3
