Ciclohexanona: propiedades, reacciones, producción y usos
¿Qué es la ciclohexanona?
La ciclohexanona, también conocida como cetohexametileno o cetona pimélica, es un compuesto orgánico con la fórmula química C6H10O. Es un líquido incoloro a amarillo pálido con un olor similar al de la acetona que es muy soluble en la mayoría de los disolventes orgánicos.
Primero fue sintetizada por la destilación en seco de pimelato de calcio, y luego por Bouveault por la deshidrogenación catalítica de ciclohexanol.
La ciclohexanona se produce industrialmente a gran escala como materia prima para la fabricación de nailon.
Tabla de contenido
1. Propiedades físicas de la ciclohexanona
La ciclohexanona es un líquido incoloro con un olor similar al de la menta y la acetona. Es muy soluble en metanol, etanol, acetona, benceno, n-hexano, nitrobenceno, éter dietílico, nafta, xileno, etilenglicol, acetato de isoamilo, dietilamina y la mayoría de los disolventes orgánicos.
La ciclohexanona puede disolver una variedad de productos, como nitrato de celulosa, acetato de celulosa, éteres de celulosa, resinas de vinilo, caucho crudo, ceras, grasas, goma laca, colorantes básicos, aceites, látex, betún, kaure y elemí. Forma un azeótropo con agua que hierve a 96,6 °C con una composición de agua:ciclohexanona de 56:44.
Las propiedades físicas de la ciclohexanona se presentan en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Número CAS | [108-94-1] |
| Fórmula química | C6H10O |
| Peso molecular | 98,15 g/mol |
| Punto de fusión | -47 °C |
| Punto de ebullición punto | 156,4 °C |
| Presión de vapor | 0,52 kPa a 20 °C |
| Densidad | 0,9455 g/cm3 |
| Índice de refracción | 1,4552 |
| Coeficiente de expansión | 9,14 × 10-4 |
| Viscosidad dinámica | 1,803 mPa · s a 30 °C |
| Calor específico | 1,811 j/g |
| Tensión superficial | 33,51 mN/m a 30 °C |
| Calor de fusión | 1,501 kJ/mol |
| Calor de combustión | -3,521 MJ/mol |
| Calor de vaporización | 44,92 kJ/mol |
| Calor de formación | -272 kJ/mol |
| Punto de inflamación | 54 °C |
| Temperatura de autoignición | 420 °C |
| Solubilidad en agua a 20 °C | 9,0 g/100 g de agua |
2. Reacciones de la ciclohexanona
Debido a la presencia de un grupo carbonilo, la ciclohexanona experimenta una variedad de reacciones típicas de las cetonas alifáticas. Aproximadamente el 0,02% de la molécula existe en el tautómero enólico a temperatura ambiente.
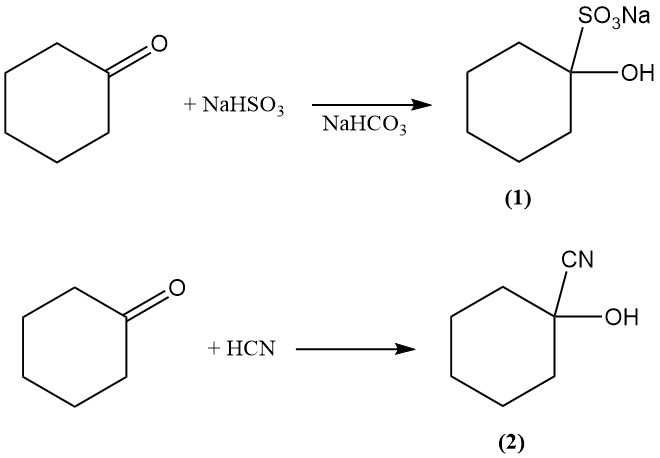
La reacción de adición de la ciclohexanona con bisulfito y cianuro de hidrógeno produce 1-hidroxiciclohexano-1-sulfonato (1) y 1-hidroxiciclohexano-1-carbonitrilo (2), respectivamente.
La reacción de Grignard forma alcoholes terciarios después de la hidrólisis.
La hidrogenación o reducción catalítica de ciclohexanona utilizando borohidruro de sodio o hidruro de litio y aluminio produce ciclohexanol, mientras que en condiciones más rigurosas se forma ciclohexano.
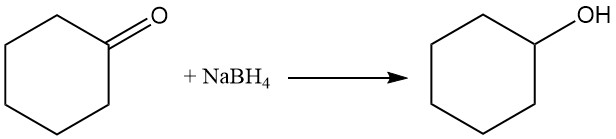
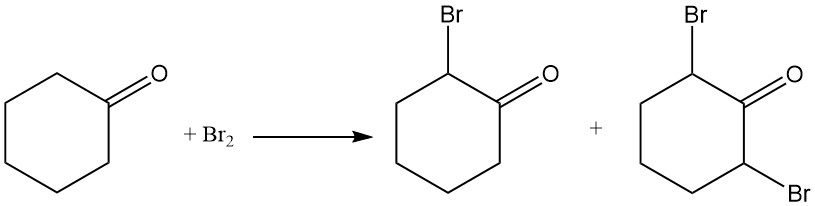
La ciclohexanona reacciona con cloro o bromo para formar compuestos halogenados en la posición α o en las posiciones 2 y 6.
Puede experimentar fácilmente una condensación aldólica catalizada por bases consigo misma o con otros aldehídos o cetonas.
La ciclohexanona forma enaminas cuando reacciona con aminas secundarias.
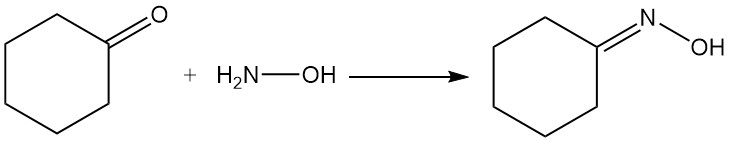
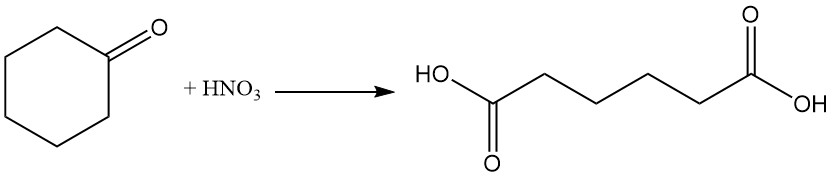
Las reacciones de importancia industrial de la ciclohexanona son la formación de oxima de ciclohexanona por reacción con hidroxilamina y la oxidación con ácido nítrico a ácido adípico.
3. Producción industrial de ciclohexanona
La ciclohexanona se produce comercialmente mediante los siguientes procesos principales:
- Deshidrogenación de ciclohexanol
- Oxidación de ciclohexano
- Hidrogenación de fenol
La mayoría de las instalaciones a gran escala utilizan la tecnología de oxidación de ciclohexano para producir una mezcla de ciclohexanol y ciclohexanona. DSM en Holanda y Allied Signal Corp. en los Estados Unidos son las únicas plantas grandes que aún utilizan la hidrogenación de fenol.
Se utilizan procesos catalíticos y no catalíticos para oxidar el ciclohexanol a ciclohexanona.
3.1. Producción de ciclohexanona mediante hidrogenación de fenol
La distribución de productos de hidrogenación de fenol, incluidos ciclohexanol, ciclohexanona o su mezcla, depende de la elección del catalizador y de las condiciones de reacción.
La figura 1 ilustra la producción de ciclohexanona en fase de vapor a partir de fenol.
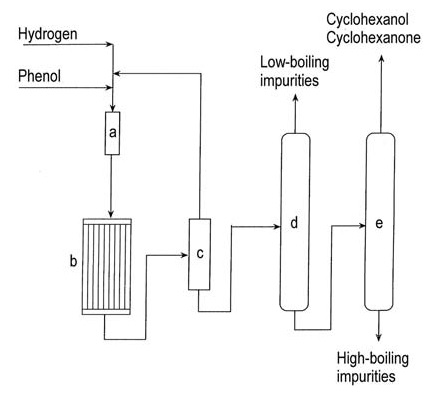
a) Evaporador de fenol; b) Reactor de hidrogenación; c) Condensador; d) Columna de eliminación de compuestos de bajo punto de ebullición; e) Columna de recuperación de ciclohexanol/ciclohexanona
La hidrogenación de fenol a ciclohexanona en fase de vapor utiliza diversos catalizadores de metales nobles soportados, incluidos paladio, platino, iridio, rutenio, rubidio y osmio. La reacción ocurre a 140–170 °C bajo presión atmosférica y alcanza un rendimiento del 95 % en conversión completa.
La hidrogenación comercial en fase líquida de fenol utilizando paladio sobre un catalizador de carbono produce >99 % de ciclohexanona con una conversión del 90 % en condiciones suaves.
3.2. Producción de ciclohexanona por deshidrogenación de ciclohexanol
La deshidrogenación de ciclohexanona produce ciclohexanona, que es un precursor de caprolactama.
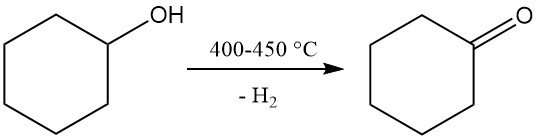
La deshidrogenación no catalítica en fase de vapor del ciclohexanol se lleva a cabo a una temperatura de 400–450 °C. Los vapores generados se enfrían, se separa el hidrógeno y la ciclohexanona cruda, que contiene ciclohexeno y agua como subproductos, se purifica mediante destilación. La pureza de la ciclohexanona resultante alcanza el 98–99%.
La deshidrogenación catalítica del ciclohexanol a ciclohexanona utilizando catalizadores como óxido de cromo-cobre, cromato de cobre, níquel, sulfuro de cinc, cinc-hierro, carbonato de cobalto y otros metales se produce en condiciones más suaves y da mejores rendimientos.
3.3. Producción de ciclohexanona por oxidación de ciclohexano
La oxidación en aire en fase líquida de ciclohexano a ciclohexanol y ciclohexanona se lleva a cabo normalmente, ya sea sin catalizar o con un catalizador de cobalto soluble, en una serie de reactores agitados o en un oxidante de una sola torre a una temperatura de 140–180 °C y una presión de 0,8–2 MPa.
El hidroperóxido de ciclohexilo es un intermediario en esta reacción y es convertido por los oxidantes a ciclohexanol, ciclohexanona y subproductos.
Cuando se añade cromo (III) al oxidante de aire, cataliza la deshidratación del hidroperóxido de ciclohexilo a ciclohexanona y agua, lo que conduce a una mayor selectividad para la ciclohexanona.
Otro método para aumentar la proporción de ciclohexanona a ciclohexanol en el producto final es descomponiendo el hidroperóxido de ciclohexilo con una fase cáustica acuosa que contiene unas pocas ppm de cobalto.
En la Figura 2 se muestra un diagrama de flujo de este proceso cáustico.
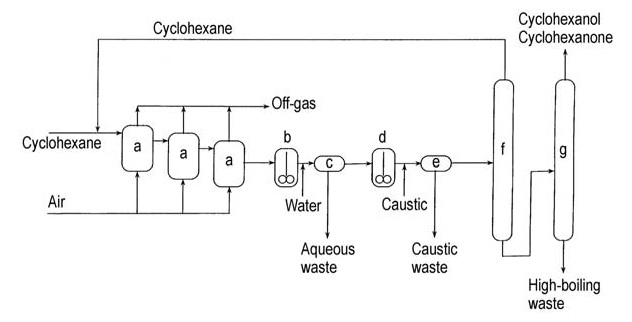
a) Oxidadores de aire; b) Decantador de lavado con agua; c) Decantación; d) Reactor de descomposición cáustica; e) Decantación cáustica; f) Columna de recuperación de ciclohexano; g) Columna de recuperación de ciclohexanol/ciclohexanona
El producto crudo de este proceso contiene una mezcla de ciclohexanona y ciclohexanol, que se puede separar por destilación y convertir en ciclohexanona por deshidrogenación para aumentar el rendimiento general de ciclohexanona.
4. Usos de la ciclohexanona
Más del 97 % de toda la ciclohexanona producida se utiliza como materia prima para la producción de ácido adípico y caprolactama, que se utilizan en la fabricación industrial de nailon.
La ciclohexanona también se utiliza como disolvente para lacas, resinas, polímeros y otros compuestos. Otros usos incluyen como material de partida en la síntesis de insecticidas, herbicidas y productos farmacéuticos.
La ciclohexanona se utiliza en la fabricación de cintas magnéticas y de vídeo.
El cumplimiento de la Norma 66 de California permite su uso como sustituto de la isoforona para aplicaciones de disolventes de resinas y polímeros.
5. Toxicología de la ciclohexanona
La ciclohexanona presenta una baja toxicidad por exposición oral, dérmica e inhalatoria. El contacto con el líquido o el vapor puede inducir una lesión corneal transitoria. El contacto prolongado o sustancial con la piel puede causar irritación y pérdida de grasa.
La exposición por inhalación causó congestión pulmonar, edema y hemorragia. Las altas concentraciones de vapor o la exposición repetida pueden provocar depresión del sistema nervioso central.
Los valores de LD50 oscilaron entre 0,93 y 1,54 g/kg (ip) y entre 1,8 y 2,1 g/kg (intragástrico) en estudios con animales, y los conejillos de indias mostraron la mayor sensibilidad.
Si bien existen resultados de actividad genética tanto positivos como negativos, la evidencia de carcinogenicidad sigue sin ser concluyente. La ciclohexanona demostró no ser teratógena en ratas y ratones.
Los estudios de inhalación de dos generaciones en ratas no revelaron efectos adversos en el crecimiento, desarrollo o reproducción a 1000 ppm durante una generación o 250/500 ppm durante dos generaciones.
La exposición de la progenie a 1400 ppm produjo efectos reversibles, entre ellos letargo, reducción de la fertilidad masculina y supervivencia y peso de la progenie.
Se estableció un NOEL de al menos 500 ppm. El PEL de OSHA y el TLV de ACGIH para ciclohexanona son 25 ppm (100 mg/m³) con notación de absorción cutánea.
Se aplican las precauciones estándar para la manipulación de disolventes volátiles, que incluyen ventilación, evitar la inhalación y el contacto con la piel, prevenir la ingestión y proteger los ojos.
Referencias
- Cyclohexanol and Cyclohexanone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_217.pub2
- Cyclohexanol and Cyclohexanone. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471238961.0325031206091908.a01
- https://www.sciencedirect.com/science/article/abs/pii/0041008X7990454X
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse2329.pub2
- https://pubchem.ncbi.nlm.nih.gov/compound/Cyclohexanone
