Alcohol isopropílico: propiedades, reacciones químicas, producción industrial, aplicaciones y toxicología
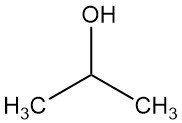
¿Qué es el alcohol isopropílico?
El alcohol isopropílico, también conocido como isopropanol o 2-propanol, es el alcohol secundario más simple, con la fórmula química C3H7OH. Es un líquido incoloro, volátil e inflamable, con un sabor ligeramente amargo y un ligero olor similar al de una mezcla de etanol y acetona.
El isopropanol se encuentra en la naturaleza en aceites crudos de fusel y como producto de la fermentación y descomposición de diversos vegetales. Se considera el primer alcohol derivado de la petroquímica y, entre los alcoholes inferiores (C1-C5), ocupa el tercer lugar en producción mundial, después del metanol y el etanol.
Tabla de contenido
1. Propiedades físicas del alcohol isopropílico
El alcohol isopropílico (2-propanol) es un alcohol secundario completamente miscible en agua y fácilmente soluble en una amplia gama de disolventes orgánicos comunes, incluyendo éteres, ésteres, cetonas, ácidos y otros alcoholes.
La solubilidad del isopropanol en agua disminuye en presencia de sales disueltas, y la adición de sales como el cloruro de sodio o el sulfato de sodio induce la separación de fases, produciendo una capa orgánica inmiscible. Esta propiedad se aprovecha en la extracción de compuestos polares de soluciones acuosas.
Las propiedades físicas del alcohol isopropílico se ven influenciadas por su grupo hidroxilo polar (–OH) y su estructura de alcohol secundario. Presenta puntos de ebullición e inflamación más bajos que los del n-propanol, mientras que su presión de vapor y punto de congelación son más altos.
La Tabla 1 muestra las propiedades físicas del alcohol isopropílico anhidro, así como su mezcla azeotrópica al 91 % vol. con agua.
| Propiedad | Anhidro | 91 % vol. |
|---|---|---|
| Peso molecular | 60,10 | |
| Punto de ebullición a 101,3 kPa, °C | 82,3 | 80,4 |
| Punto de congelación, °C | −88,5 | −50,0 |
| Gravedad específica, 20/20 | 0,7864 | 0,8183 |
| Densidad a 20 °C: g/cm3 | 0,7854 | 0,8173 |
| Tensión superficial a 20 °C: mN/m (= dinas/cm) | 21,32 | 21,40 |
| Calor específico del líquido a 20 °C: J/(kg·K) | 2510,4 | |
| Refracción Índice | 1,3772 | 1,3769 |
| Calor de combustión a 25 °C, kJ/mol | 2005,8 | |
| Calor latente de vaporización a 101,3 kPa, kJ/mol | 39,8 | |
| Presión de vapor a 20 °C, kPa | 4,4 | 4,5 |
| Temperatura crítica, °C | 235,2 | |
| Presión crítica a 20 °C, kPa | 4764 | |
| Viscosidad a 0 °C, mPa·s(= cP) | 4,6 | |
| Viscosidad a 20 °C, mPa·s(= cP) | 2,4 | 2,1 |
| Viscosidad a 40 °C, mPa·s(= cP) | 1,4 | |
| Límite de inflamabilidad en el aire, % vol. | Inferior: 2,5 Superior: 12 |
|
| Punto de inflamación, °C (vaso abierto) | 17,2 | 21,7 |
| Punto de inflamación, °C (vaso cerrado) | 11,7 | 18,3 |
| Temperatura de autoignición, °C | 399 |
Los grados comerciales de isopropanol en Estados Unidos consisten predominantemente en alcohol isopropílico anhidro y un azeótropo acuoso al 91 % vol., conocido como mezcla de ebullición constante. Las formulaciones de alcohol isopropílico suelen contener al menos un 70 % de alcohol isopropílico en agua.
El alcohol isopropílico también forma azeótropos con diversos compuestos, como hidrocarburos, ésteres, halocarbonos, aminas, cetonas e hidrocarburos aromáticos. No forma azeótropos binarios con acetona, etanol, etilbenceno, hexilamina ni metilisobutilcetona, pero puede formar sistemas azeotrópicos ternarios con algunos de estos compuestos.
En la Tabla 2 se presentan ejemplos de azeótropos binarios de alcohol isopropílico.
| Componente | Punto de ebullición, °C | Punto de ebullición del azeótropo, °C | Composición del alcohol isopropílico, % en peso |
|---|---|---|---|
| Agua | 100 | 80,3 | 87,4 |
| Tolueno | 110,6 | 80,6 | 69 |
| Propionato de metilo | 79,6 | 77 | 28 |
| Metiletilcetona | 79,6 | 77,9 | 32 |
| Acetato de etilo | 77,05 | 75,9 | 25 |
| 2-clorobutano | 68,25 | 64 | 18 |
| hexano | 68,9 | 62,7 | 23 |
| ciclohexano | 80,8 | 68,6 | 33 |
| butilamina | 77,8 | 84,7 | 60 |
| éter diisopropílico | 69 | 66,2 | 16,3 |
2. Reacciones químicas del alcohol isopropílico
Las propiedades químicas del alcohol isopropílico están determinadas por la presencia de un grupo hidroxilo secundario. Su reactividad es característica de los alcoholes secundarios y generalmente es mayor en el grupo hidroxilo que en alcoholes primarios como el n-propílico o el etílico. La mayoría de las reacciones implican la ruptura del enlace C-OH o del enlace O-H.
El alcohol isopropílico experimenta una amplia gama de transformaciones, como la deshidrogenación, la oxidación, la esterificación, la eterificación, la aminación y la halogenación. Ejemplos de importancia industrial incluyen la preparación de isopropóxido de aluminio y haluros de isopropilo.
El isopropóxido de aluminio se produce con un rendimiento cuantitativo mediante el reflujo de alcohol isopropílico con aluminio metálico en presencia de cantidades catalíticas de cloruro de mercurio.
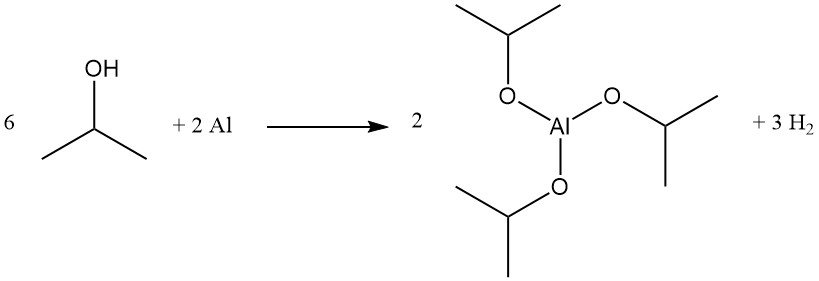
Este compuesto es un agente reductor Meerwein-Ponndorf-Verley eficaz para ciertas reacciones de intercambio de ésteres y reducción de carbonilo, y se utiliza como precursor del glicinato de aluminio, un agente tampón.
Los haluros de isopropilo, como el bromuro de isopropilo, se obtienen por desplazamiento del grupo hidroxilo mediante la reacción con haluros de hidrógeno. El reflujo del alcohol isopropílico con ácido bromhídrico produce bromuro de isopropilo y agua.
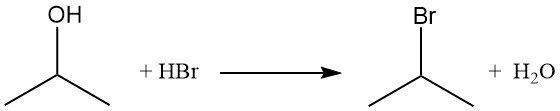
El orden de reactividad con haluros de hidrógeno es HI > HBr > HCl. La reacción con ácido clorhídrico para formar cloruro de isopropilo se cataliza por la presencia de cloruro de zinc.
El alcohol isopropílico puede desprotonarse para producir sales de isopropóxido, que se utilizan ampliamente como bases fuertes no nucleófilas en la síntesis orgánica.
En reacciones de hidrogenación por transferencia catalítica, se utiliza como reductor terminal para la reducción de aldehídos, cetonas y otros grupos funcionales. Durante estas reacciones, el 2-propanol se oxida a acetona.
Este proceso es reversible, y el contacto prolongado entre el producto y el catalizador puede disminuir la enantiopureza en reducciones asimétricas. El equilibrio puede desviarse hacia la formación de producto utilizando un exceso de isopropanol, eliminando la acetona por destilación o separando el producto reducido del medio de reacción.
2.1. Deshidrogenación del alcohol isopropílico
La deshidrogenación del alcohol isopropílico es una reacción industrial importante para la producción de acetona. Antes de la coproducción a gran escala de acetona en los procesos de fabricación de fenol, era el principal método comercial para la síntesis de acetona.
El proceso es endotérmico, con un requerimiento de calor de 66,5 kJ/mol a 327 °C. Se lleva a cabo en fase de vapor a temperaturas de 300-500 °C y presiones moderadas de alrededor de 207 kPa, lo que proporciona una selectividad de aproximadamente el 90 % para la acetona y una conversión de 2-propanol del 98 %.
Los catalizadores comúnmente utilizados incluyen cobre, cromo, zinc y níquel, aplicados individualmente, como óxidos o en mezclas soportadas sobre materiales inertes. Una reacción representativa es la siguiente:

La selectividad hacia la acetona es alta, pero se forman pequeñas cantidades de subproductos mediante deshidratación, condensación u oxidación. Estos incluyen propileno, éter diisopropílico, óxido de mesitilo, acetaldehído y propionaldehído.
La reacción también puede tener lugar en fase líquida.
La deshidrogenación del alcohol isopropílico también puede realizarse oxidativamente utilizando catalizadores de plata o cobre a temperaturas de 400-600 °C. Existen procesos patentados que describen la deshidrogenación oxidativa en fase de vapor para la producción de cetonas mixtas, como acetona, metilisobutilcetona y cetonas superiores.
En un ejemplo, la deshidrogenación en fase de vapor de una mezcla azeotrópica de 2-propanol y agua sobre un catalizador a base de cobre a 220 °C produce una mezcla que contiene acetona (52,4 %), 2-propanol sin reaccionar (11,4 %), metilisobutilcetona (21,6 %), diisobutilcetona (6,5 %) y 4-metil-2-pentanol (2,2 %).
2.2. Oxidación del alcohol isopropílico
El alcohol isopropílico se oxida catalíticamente con aire u oxígeno a 400-600 °C para producir acetona y agua.
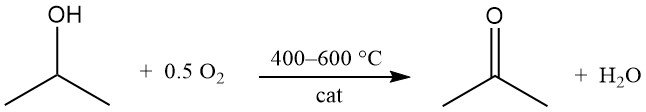
Los catalizadores son similares a los utilizados en los procesos de deshidrogenación. A diferencia de la deshidrogenación, la reacción de oxidación es altamente exotérmica y libera 180 kJ/mol a 295 °C. Es necesario un control minucioso de las condiciones del proceso para limitar la formación de subproductos, especialmente en las vías de deshidratación.
La oxidación y la deshidrogenación pueden llevarse a cabo simultáneamente con el catalizador y las condiciones de operación adecuados, aunque el uso industrial de la oxidación para la producción de acetona es limitado en comparación con la deshidrogenación.
La oxidación parcial del alcohol isopropílico puede realizarse en fase líquida sin catalizador para producir peróxido de hidrógeno y acetona.
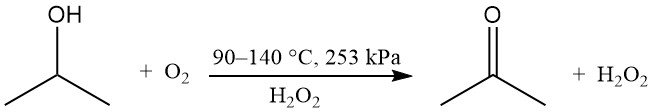
Se utiliza oxígeno o aire con un iniciador de peróxido, como el peróxido de hidrógeno. La velocidad de reacción se ve afectada por la concentración del subproducto, ácido acético. La relación teórica en peso entre acetona y peróxido de hidrógeno es de 1,7. Este método se utiliza cuando el producto deseado es peróxido de hidrógeno, mientras que la acetona y el isopropanol no reaccionado se reciclan.
En el proceso de Shell, el peróxido de hidrógeno producido de esta manera se utiliza para oxidar el alcohol alílico a acroleína, mientras que en el proceso de Burmah Oil se convierte en ácido peracético.
El 2-propanol también reacciona con aldehídos o cetonas α,β-insaturados sobre catalizadores de óxido metálico a temperaturas elevadas. En un proceso de Shell para la producción de alcohol alílico, una mezcla en fase de vapor de isopropanol y acroleína se pasa sobre óxido de magnesio y óxido de zinc sin calcinar a 400 °C para obtener aproximadamente un 77 % de alcohol alílico basado en acroleína.
2.3. Esterificación del alcohol isopropílico
El alcohol isopropílico se esterifica con ácidos carboxílicos en presencia de catalizadores ácidos como el ácido p-toluenosulfónico. La reacción se lleva a cabo típicamente a 100-160 °C y presión atmosférica, utilizando un exceso de alcohol para impulsar el equilibrio hacia la formación de ésteres.
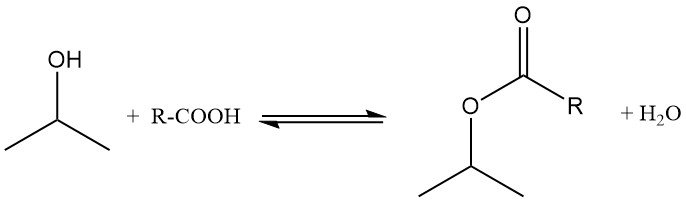
El agua formada durante la reacción se elimina como azeótropo para alterar el equilibrio. El exceso de isopropanol se destila y se recicla, y la producción de ésteres se aproxima a niveles cuantitativos. Por ejemplo, el acetato de isopropilo se prepara a partir de isopropanol y ácido acético en presencia de ácido sulfúrico, utilizando tolueno como agente azeotrópico.
Se han realizado estudios cinéticos sobre la esterificación del isopropanol con diversos ácidos orgánicos utilizando resinas de intercambio catiónico sulfonadas. La reacción con ácido mirístico produce miristato de isopropilo, un emoliente y lubricante utilizado en cosméticos y productos farmacéuticos tópicos. Una forma gelatinosa de este éster se comercializa como Estergel.
El alcohol isopropílico reacciona con disulfuro de carbono para producir ésteres de xantato. El xantato de isopropilo de sodio se utiliza en procesos de flotación de minerales y como herbicida en el cultivo de frijol y guisante.
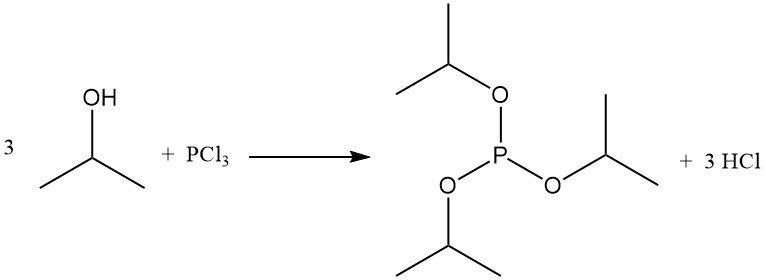
La reacción del 2-propanol con haluros de fósforo forma ésteres de fosfito. El fosfito de triisopropilo se obtiene a partir de tricloruro de fósforo y alcohol isopropílico a bajas temperaturas en presencia de un depurador de ácido como la piridina.
El tetracloruro de titanio reacciona con isopropanol para producir titanato de tetra(isopropilo), un catalizador comercial de polimerización.
El nitrato de isopropilo se prepara mediante la reacción de isopropanol con ácido nítrico. Los reactivos se introducen por separado en un alambique y el producto se elimina continuamente por destilación.
El nitrato de isopropilo se utiliza como combustible para el arranque de motores y en formulaciones explosivas. El éster de nitrito, nitrito de isopropilo, se forma a partir de isopropanol y cloruro de nitrosilo o ácido nitroso a temperatura ambiente y sirve como propelente para motores a reacción.
2.4. Eterificación del alcohol isopropílico
El alcohol isopropílico puede deshidratarse en fase líquida sobre catalizadores ácidos fuertes, como el ácido sulfúrico, o en fase de vapor sobre alúmina ácida para producir éter diisopropílico (DIPE) o propileno.
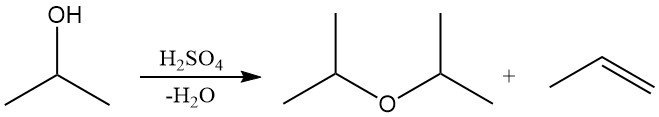
La selectividad hacia el DIPE o el propileno depende de la elección del catalizador y de las condiciones de reacción. Industrialmente, el DIPE se obtiene principalmente como subproducto durante la producción de alcohol isopropílico. El exceso de DIPE se suele reciclar sobre catalizadores ácidos para regenerar el alcohol isopropílico mediante hidratación. El DIPE se utiliza en cantidades limitadas como disolvente y en procesos de extracción industrial.
La Ley de Aire Limpio de EE. UU. de 1990, que exigió el uso de oxigenados en la gasolina, generó una demanda potencial de DIPE como oxigenado de combustible. El DIPE se puede sintetizar mediante la reacción del alcohol isopropílico con propileno sobre catalizadores ácidos de intercambio iónico a bajas temperaturas.
Los éteres glicólicos también se pueden preparar a partir del alcohol isopropílico mediante la reacción con óxidos de olefina, como el óxido de etileno o el óxido de propileno. Por ejemplo, la reacción con óxido de etileno produce 2-isopropoxietanol (conocido comercialmente como isopropil Cellosolve), generalmente catalizado por hidróxidos alcalinos.
La alcoxilación secundaria del producto inicial con óxido de olefina adicional forma derivados alcoxilados superiores (oligómeros). Esta reacción competitiva es particularmente significativa cuando se utiliza óxido de etileno, ya que el grupo hidroxi primario terminal producido es más reactivo.
Los éteres glicólicos derivados del alcohol isopropílico se utilizan como disolventes en lacas, esmaltes y recubrimientos al agua para mejorar el brillo, la fluidez y las propiedades de la película.
2.5. Aminación del alcohol isopropílico
El alcohol isopropílico se amina mediante amonólisis con catalizadores de deshidratación o mediante amonólisis reductora con catalizadores de hidrogenación. Ambos métodos producen isopropilamina y diisopropilamina. La triisopropilamina se forma solo en cantidades insignificantes.
La proporción de mono- a diisopropilamina depende de la relación molar entre el alcohol isopropílico y el amoníaco, que suele oscilar entre 2:1 y 5:1.
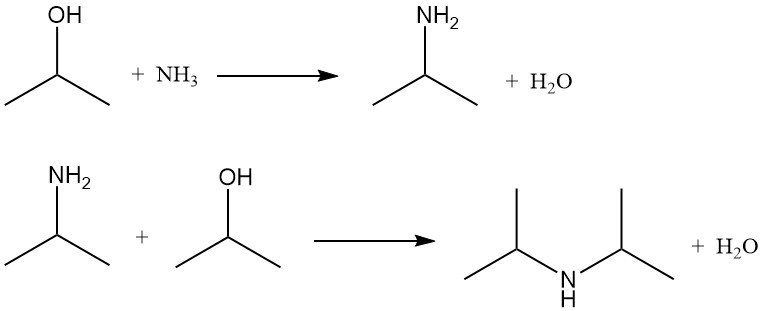
En la amonólisis reductora, el hidrógeno está presente para prolongar la vida del catalizador al prevenir la formación de coquización y alquitrán, pero no se consume significativamente. Las reacciones se llevan a cabo normalmente a 150-250 °C y 790-2860 kPa en un reactor de lecho fijo utilizando catalizadores de cobre, cromo o níquel soportados sobre alúmina.
La conversión de alcohol isopropílico supera el 85 % y los rendimientos de amina superan el 90 %. Subproductos como nitrilos y amidas se reciclan para mejorar el rendimiento.
La amonólisis directa con catalizadores de deshidratación se lleva a cabo a 300-500 °C y presiones similares. Los catalizadores utilizados incluyen alúmina, sílice, dióxido de titanio y fosfato de aluminio. Los rendimientos superan el 80 %, con mínima formación de coquización y nitrilos, pero el control sobre la composición de aminas es limitado.
La isopropilamina se utiliza principalmente en la producción de herbicidas, en particular para la 2-cloro-4-etil-6-isopropilamino-s-triazina, y en menor medida en la fabricación de pesticidas. La diisopropilamina se utiliza en pesticidas y como inhibidor de la corrosión, como el nitrato de diisopropilamonio.
2.6. Halogenación del alcohol isopropílico
Los derivados del 2-halopropano pueden sintetizarse a partir del alcohol isopropílico mediante la reacción con el haluro de ácido correspondiente, que constituye el método más económico. Los haluros de fósforo y los halógenos elementales también pueden reaccionar en condiciones adecuadas para reemplazar el grupo hidroxilo y producir el haluro.
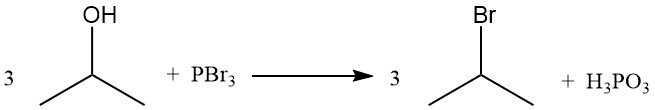
La halogenación en solución acuosa se acompaña de oxidación. La cloración a 65 °C produce derivados de la cloroacetona, principalmente 1,3-dicloroacetona y 1,1,3-tricloroacetona. Una cloración posterior a 70-100 °C produce una conversión casi completa en productos con mayor contenido de cloro, como la 1,1,1,3,3-pentacloroacetona y la hexacloroacetona.
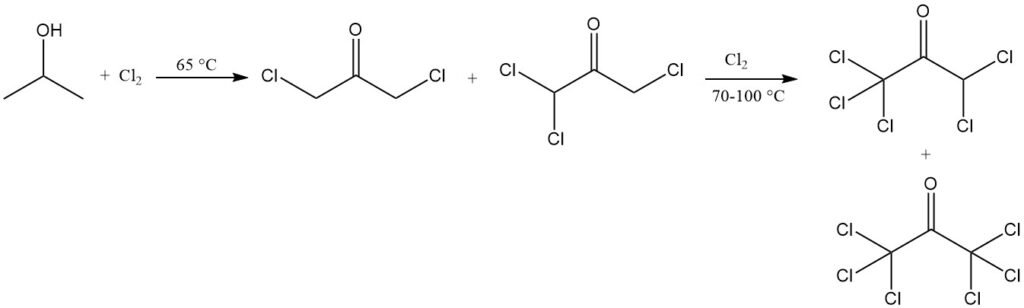
La cloración del isopropanol en condiciones específicas puede producir 1,1,1,3-tetracloroacetona, que puede convertirse en 1,1,1-tricloro-2,3-epoxipropano, un intermedio para productos químicos agrícolas y farmacéuticos, así como para plásticos de baja inflamabilidad.
2.7. Reacciones diversas del isopropanol
El alcohol isopropílico se acila con cetena para producir acetato de isopropilo:
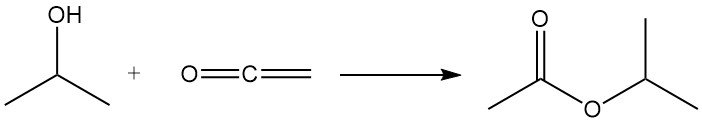
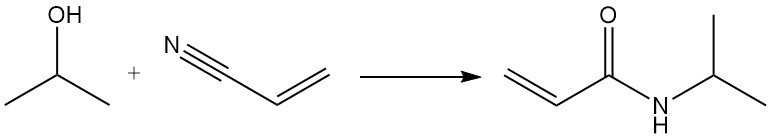
La reacción de Ritter del isopropanol con acrilonitrilo produce N-isopropilacrilamida:
El alcohol isopropílico también puede condensarse con compuestos aromáticos como el tolueno y el fenol para formar derivados isopropoxilados que se utilizan como intermediarios en la síntesis de resinas, surfactantes y productos químicos especiales.
3. Producción industrial de alcohol isopropílico
El alcohol isopropílico se produce industrialmente mediante dos procesos principales: hidratación indirecta e hidratación directa del propeno. Se obtienen volúmenes más pequeños mediante la hidrogenación de acetona.
La fabricación industrial de alcohol isopropílico comenzó en 1920 en la planta petroquímica de Standard Oil (Exxon) en Bayway, Nueva Jersey. En 1921, Union Carbide (Carbide and Carbon Chemicals Corporation) inició la producción en Clendenin, Virginia Occidental. Shell Oil Company inició sus operaciones en la década de 1930 en Domínguez, California. Estas empresas se mantuvieron como los principales productores estadounidenses hasta mediados de la década de 1990.
El proceso de hidratación indirecta, también conocido como proceso de ácido sulfúrico, fue históricamente el único método comercial hasta 1951, cuando Imperial Chemical Industries (ICI) puso en marcha el primer proceso comercial de hidratación directa.
Ambos métodos utilizan propileno y agua como materias primas. El proceso indirecto puede procesar corrientes de gases de escape C3 de refinería con un contenido de 40-60 % en peso de propileno, lo que lo hace adecuado para su integración en refinerías estadounidenses. La ruta de hidratación directa se desarrolló para superar los problemas de corrosión, el alto consumo de energía y las emisiones atmosféricas asociadas con el método indirecto; sin embargo, requiere propileno de alta pureza.
Otros métodos sintéticos potenciales incluyen la fermentación de carbohidratos, la oxidación del propano y la hidrólisis del acetato de isopropilo. De estos, la hidrogenación de la acetona, subproducto de la producción de fenol, es el único proceso alternativo con relevancia comercial.
3.1. Producción de alcohol isopropílico mediante hidratación indirecta de propileno
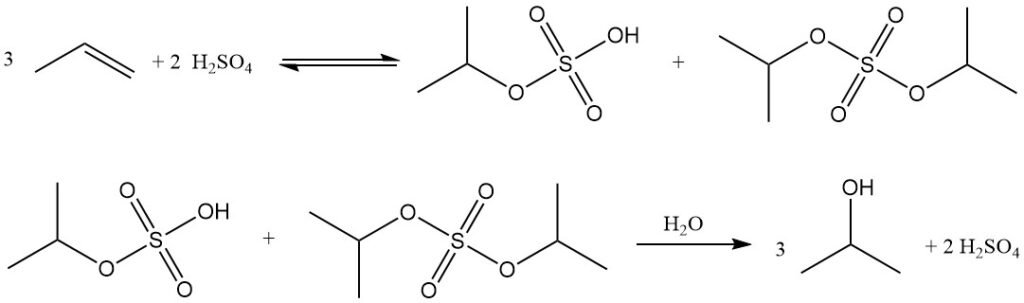
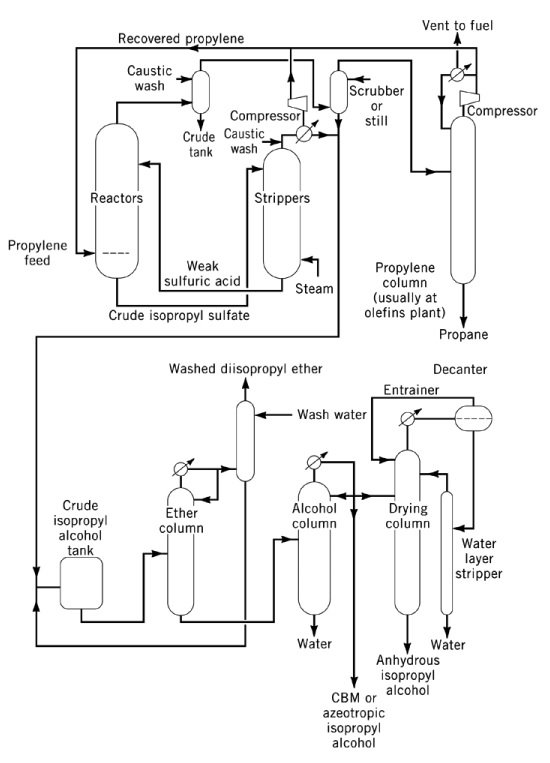
La hidratación indirecta de propileno a alcohol isopropílico es un proceso de dos pasos que utiliza ácido sulfúrico concentrado como catalizador. En el primer paso, se produce la esterificación para formar ésteres de sulfato, principalmente sulfato de isopropilo hidrogenado, junto con cantidades menores de sulfato de diisopropilo. En el segundo paso, la hidrólisis de estos ésteres produce isopropanol y regenera el ácido sulfúrico.
El principal subproducto de este proceso es el éter diisopropílico (DIPE), formado por la reacción de ésteres de sulfato intermedios con isopropanol. Otros subproductos incluyen acetona (procedente de la descomposición térmica de ésteres de sulfato), óxido de mesitilo, oligómeros de propileno (dímeros y trímeros) y alcoholes menores como el etanol, el 2-butanol y el n-propanol, provenientes de las impurezas de la alimentación.
Los compuestos que contienen azufre, en combinación con oligómeros insaturados, pueden causar olores indeseables, que se mitigan optimizando las condiciones de reacción y el postratamiento sobre metales como el cobre o el níquel.
La reacción se lleva a cabo a 0,7–2,8 MPa y a 20–80 °C, utilizando concentraciones de ácido sulfúrico superiores al 60 % en peso. Se utilizan dos modos de operación comunes:
- El proceso de ácido fuerte es una operación de dos etapas que utiliza >80 % en peso de H2SO4 a 1–1,2 MPa y 20–30 °C.
- El proceso de ácido débil es una operación de una sola etapa que utiliza entre 60 y 80 % en peso de H2SO4 a aproximadamente 2,5 MPa y 60–65 °C.
Ambos procesos alcanzan una selectividad superior al 98 % para 2-propanol y DIPE.
El hidrolizado se separa para obtener una mezcla de isopropanol, DIPE y agua en la parte superior, con ácido sulfúrico diluido como residuo. El DIPE generalmente se recicla al reactor para su hidratación. Tras la destilación, se obtiene isopropanol húmedo (87 % p/p, 91 % vol), con una conversión de propileno superior al 93 %. La deshidratación final a grado anhidro se realiza mediante destilación azeotrópica utilizando DIPE o ciclohexano como arrastradores.
El control de la corrosión requiere reactores de acero para el ácido concentrado a temperaturas moderadas, y de acero inoxidable, tántalo o Hastelloy para el ácido diluido a temperaturas más altas. El alcohol isopropílico de alta pureza o grado esencial se produce mediante postratamiento sobre carbón activado, tamices moleculares o lechos fijos con metal, seguido de la destilación final en equipos no ferrosos.
La hidratación indirecta sigue siendo la principal vía comercial en Estados Unidos y también la practican varios productores europeos y japoneses.
3.2. Producción de alcohol isopropílico mediante hidratación directa de propileno
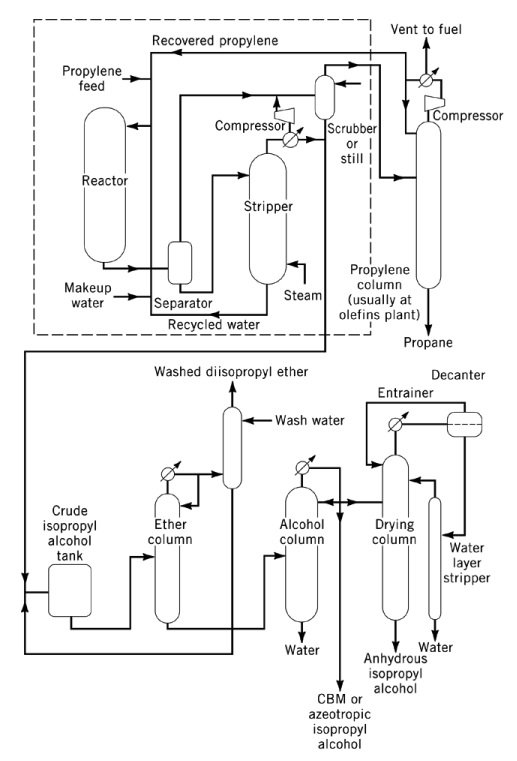
La hidratación directa de propileno a 2-propanol es una reacción exotérmica catalizada por ácido con un calor de reacción de −50 kJ/mol. Termodinámicamente, las altas presiones y las bajas temperaturas favorecen la formación de alcohol isopropílico, aunque la mayoría de los catalizadores requieren temperaturas moderadas a altas para alcanzar rendimientos comerciales.
Los procesos comerciales de hidratación directa se clasifican en tres tipos principales: hidratación en fase de vapor, hidratación mixta en fase vapor-líquida e hidratación en fase líquida.
En los procesos en fase de vapor, como los procesos Veba-Chemie e ICI, el propileno y el vapor de agua se pasan sobre un catalizador ácido de lecho fijo. El proceso Veba-Chemie utiliza ácido fosfórico soportado sobre sílice a 240–260 °C y 2,5–6,6 MPa para alcanzar una selectividad del 96 % con una conversión del 5–6 % por pasada.
El proceso ICI utiliza un catalizador de óxido de tungsteno-óxido de zinc sobre sílice a 230-290 °C y 20,3-25,3 MPa. En ambos casos, la alta temperatura y el límite de conversión a baja presión requieren un amplio reciclaje de propileno. Los requisitos de pureza de la materia prima suelen rondar el 99 % en peso.
La hidratación mixta en fase vapor-líquida, desarrollada por Deutsche Texaco AG, se lleva a cabo en un reactor de lecho percolador utilizando un catalizador de resina de intercambio catiónico de ácido sulfónico. La reacción opera a 130-160 °C y 8-10 MPa con una relación molar de propileno a agua de 1:12-15.
Este proceso alcanza una conversión superior al 75 % por pasada y una selectividad del 93 % cuando la pureza de la materia prima es de al menos el 92 % en peso. Los subproductos formados durante la reacción incluyen aproximadamente un 5 % de éter diisopropílico (DIPE) y pequeñas cantidades de alcoholes oligoméricos superiores. La vida útil del catalizador supera los ocho meses en condiciones normales de funcionamiento.
La hidratación en fase líquida, desarrollada por Tokuyama Soda, utiliza un catalizador acuoso de silicotungstato débilmente ácido a 270 °C y 20,3 MPa. El proceso alcanza una conversión del 60-70 % por pasada con una selectividad del 98-99 % molar.
El catalizador se recicla con pérdidas mínimas, y el proceso presenta baja corrosión y emisiones insignificantes. La pureza de la materia prima es del 95 % en peso o superior. El isopropanol crudo, obtenido por destilación azeotrópica, contiene un 88 % en peso de isopropanol y posteriormente se purifica hasta alcanzar una pureza superior al 99,99 %.
Los catalizadores utilizados en la hidratación directa son ácidos fuertes capaces de protonar el propileno para formar un carbocatión secundario. Algunos ejemplos incluyen ácido fosfórico soportado, óxido de tungsteno, ácido molibdofosfórico, óxido de titanio, óxido de zinc, óxido de zirconio, silicotungstatos, oxalato de molibdeno y diversas zeolitas.
Las resinas de intercambio iónico fuertemente ácidas son las preferidas para operaciones a temperatura moderada. Se ha demostrado que ciertos aniones poliácidos, como el fosfomolibdato y el fosfotungstato, mejoran las tasas de hidratación en comparación con el sulfato o el fosfato, posiblemente debido a efectos específicos de asociación iónica con el carbocatión.
El mecanismo de reacción implica la protonación del propileno para generar un ion carbonio secundario, seguido de un ataque nucleófilo con agua para producir alcohol isopropílico protonado, que posteriormente se desprotona para formar el alcohol neutro. La velocidad de reacción es proporcional a la concentración del ion hidronio e independiente del contraanión, aunque los aniones poliácidos pueden acelerarla.
Desde una perspectiva termodinámica, la constante de equilibrio en fase de vapor se define como log K = 2624/T = 7,584, y en fase líquida, la energía libre estándar es ΔF° = 23,25T = 9352 (donde T está en K).
Las bajas temperaturas reducen la formación de DIPE, pero la actividad del catalizador establece un límite inferior práctico. Las altas presiones aumentan la concentración de alcohol y reducen la necesidad de un reciclaje intensivo de propileno.
3.3. Producción de alcohol isopropílico mediante hidrogenación de acetona
La hidrogenación de acetona se emplea en Estados Unidos, Rusia, Asia y Sudamérica. El proceso puede llevarse a cabo en fase líquida sobre un catalizador de níquel Raney de lecho fijo y alcanza una selectividad del 99,9 % y una conversión de acetona del 99,9 %.
Como alternativa, la hidrogenación sobre un catalizador de óxido de cobre-óxido de cromo a 120 °C y 196 kPa proporciona selectividades más bajas, de alrededor del 98 %, y conversiones de aproximadamente el 94 %. Este proceso no requiere acetona de alta pureza, lo que lo hace especialmente ventajoso en instalaciones donde se genera un exceso de acetona como subproducto, como en el proceso de cumeno-fenol.
4. Aplicaciones del alcohol isopropílico
El alcohol isopropílico (2-propanol) se utiliza principalmente como disolvente industrial, intermediario químico y antiséptico.
4.1. Usos del alcohol isopropílico en la industria química
Los principales derivados químicos del isopropanol incluyen la metilisobutilcetona (MIBK), el metilisobutilcarbinol (MIBC), la diisobutilcetona (DIBK) y el acetato de isopropilo. El 2-propanol también es una materia prima para la producción de isopropilaminas, que se utilizan en la fabricación de herbicidas y pesticidas. Cierta diisopropilamina se utiliza en la síntesis de nitrato de diisopropilamonio, un inhibidor de la corrosión.
El uso de alcohol isopropílico para la producción de acetona ha disminuido significativamente debido a la prevalencia del proceso de oxidación del cumeno.
4.2. Usos del alcohol isopropílico como disolvente
Como disolvente, el alcohol isopropílico presenta propiedades similares a las de alcohol, agua e hidrocarburos, lo que lo hace eficaz para disolver aceites, gomas, ceras, resinas y alcaloides. Se utiliza en la formulación de cementos, imprimaciones, barnices, pinturas, tintas de impresión, recubrimientos y en procesos de extracción.
En cosméticos y productos de cuidado personal, se utiliza como disolvente para lociones, perfumes, champús, limpiadores de piel, esmaltes de uñas, desmaquillantes, desodorantes y aceites corporales, con fragancia añadida para disimular su olor.
Las formulaciones en aerosol que contienen alcohol isopropílico incluyen lacas para el cabello, productos de limpieza, insecticidas, descongelantes para automóviles, ambientadores, desinfectantes y diversos aerosoles domésticos e industriales.
4.3. Uso médico del alcohol isopropílico
En el sector farmacéutico, el alcohol isopropílico se utiliza como disolvente de procesamiento y como antiséptico y desinfectante activo en entornos domésticos, hospitalarios e industriales. Es más eficaz que el etanol para el control microbiano y se utiliza ampliamente en soluciones acuosas al 70 % como alcohol isopropílico.
También está presente en linimentos medicinales, tinturas, tónicos para el cuero cabelludo, baños de sutura quirúrgica y soluciones para apósitos, así como en formulaciones como la tintura de yodo y el jabón verde.
4.4. Otros usos
El alcohol isopropílico de alta pureza (99,99 %) se utiliza en la industria electrónica para la limpieza de dispositivos de integración a gran escala (LSI) y obleas de silicio. Otras aplicaciones incluyen su uso como potenciador de octano, aditivo antihielo para carburadores y codisolvente con metanol en mezclas de gasolina.
En los procesos de extracción, se aplican soluciones acuosas de alcohol isopropílico para la extracción líquido-líquido de ácidos grasos de aceites vegetales a bajas temperaturas.
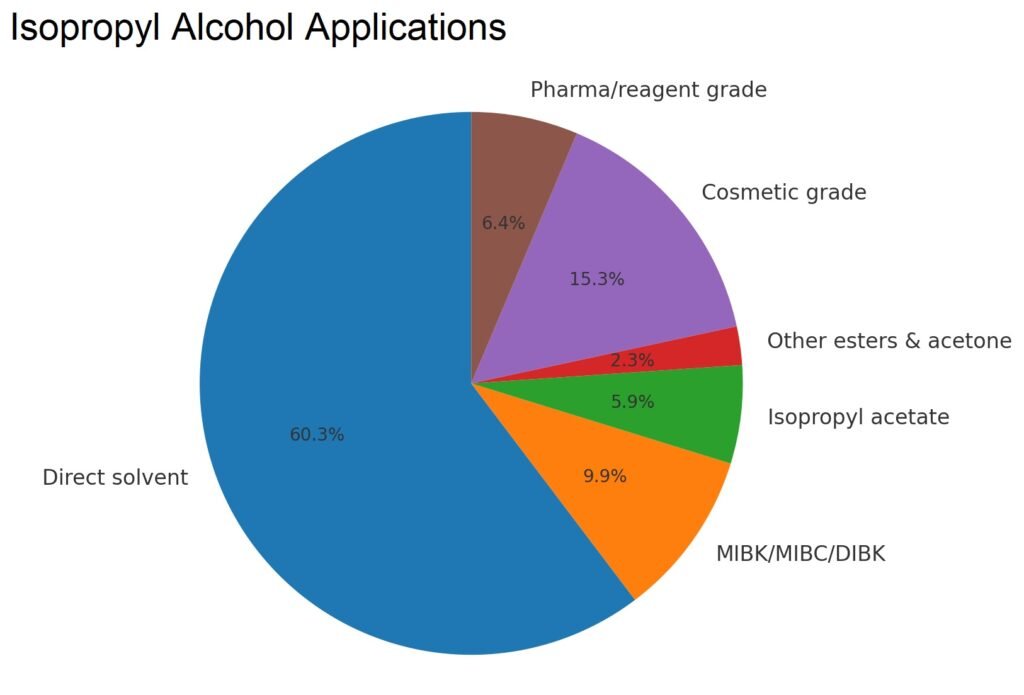
Los datos de consumo en EE. UU. de la Tabla 3 muestran los principales usos del isopropanol en disolventes, recubrimientos, derivados químicos, cosméticos, productos farmacéuticos y aplicaciones especiales. Las tendencias indican una disminución en la producción de acetona e isopropilamina, pero un uso estable en cosméticos, productos farmacéuticos y disolventes de alto rendimiento.
| Año | |||
|---|---|---|---|
| 2002 | 2008 | 2014 | |
| Disolvente directo | 243 | 269 | 237 |
| Derivados químicos | |||
| MIBK/MIBC/DIBK | 71 | 45 | 39 |
| Isopropilaminas | 85 | 50 | – |
| Acetato de isopropilo | 24 | 17 | 23 |
| Otros ésteres y acetona | 17 | 17 | 9 |
| Grado cosmético | 52 | 56 | 60 |
| Grado farmacéutico (USP)/reactivo | 21 | 25 | 25 |
| Total | 513 | 479 | 393 |
5. Toxicología del alcohol isopropílico
El alcohol isopropílico está ampliamente presente en productos domésticos e industriales, como alcohol isopropílico, desinfectantes, limpiadores, cosméticos, productos farmacéuticos y disolventes. Su toxicidad es mayor que la del etanol, aproximadamente el doble, pero menor que la del metanol. La principal vía de exposición es la ingestión, con casos menos frecuentes por inhalación o exposición dérmica.
El alcohol isopropílico se absorbe rápidamente tras la ingestión, alcanzando concentraciones plasmáticas máximas en 30 minutos. Se distribuye ampliamente en el agua corporal, con un volumen de distribución de 0,45-0,55 L/kg.
El metabolismo se produce principalmente en el hígado por la alcohol deshidrogenasa, dando lugar a acetona, acetol, metilglioxal, propilenglicol, acetato y formiato, con posterior conversión a glucosa y otros productos metabólicos.
La acetona es el principal metabolito y aparece en el aliento en los 15 minutos posteriores a la ingestión. La eliminación se produce principalmente por vía renal: el 20 % se excreta sin cambios y el resto en forma de acetona y sus metabolitos. La semivida de eliminación del alcohol isopropílico es de 2,5 a 8 horas, mientras que la de la acetona es más lenta, con una semivida de 7,7 a 27 horas.
El mecanismo de toxicidad es predominantemente la depresión del tronco encefálico causada tanto por el alcohol isopropílico como, en menor medida, por la acetona. Las manifestaciones clínicas varían desde una intoxicación leve hasta una depresión grave del sistema nervioso central (SNC) y respiratoria, colapso circulatorio, shock y coma. Los síntomas iniciales incluyen ataxia, vómitos, dolor abdominal y hematemesis, que en casos graves progresan a hipotensión, hipotermia y pérdida de reflejos.
A diferencia del metanol y el etilenglicol, el alcohol isopropílico y la acetona no causan acidosis metabólica con brecha aniónica elevada, pero sí cetonemia, cetonuria y una brecha osmolar elevada. Es característico un olor afrutado en el aliento.
La dosis tóxica del alcohol isopropílico al 70 % es de aproximadamente 1 ml/kg, y la ingestión de 100 a 250 ml puede ser mortal. La muerte se produce por parálisis del sistema nervioso central (SNC). La inhalación de altas concentraciones de vapor puede causar efectos anestésicos e irritación leve de ojos, nariz y garganta.
Los límites de exposición ocupacional establecidos por la OSHA y la ACGIH son de 400 ppm (TWA de 8 h) y 500 ppm (STEL). El umbral de olor oscila entre 3 y 200 ppm. El uso industrial en condiciones normales no supone un riesgo significativo para la salud.
Los estudios en animales, incluyendo pruebas de inhalación subcrónica, neurotoxicidad, desarrollo, reproducción y oncogenicidad, no han demostrado efectos adversos.
El diagnóstico de intoxicación por isopropanol se basa en el historial de exposición, los hallazgos clínicos y los resultados de laboratorio que muestran brecha osmolar con cetosis en ausencia de acidosis metabólica. La medición de los niveles séricos de alcohol isopropílico puede confirmar la exposición, pero no siempre está disponible.
El tratamiento de la intoxicación por isopropanol se basa principalmente en medidas de soporte para mantener las funciones vitales, incluyendo la protección de las vías respiratorias, la estabilización cardiovascular (para abordar una posible hipotensión) y la monitorización del equilibrio ácido-base y electrolítico del paciente. El carbón activado es ineficaz en este tipo de intoxicación y, por lo tanto, no se recomienda.
La hemodiálisis mejora la eliminación tanto del alcohol isopropílico como de la acetona, pero generalmente se reserva para casos graves y potencialmente mortales con hipotensión profunda, coma o concentraciones séricas muy elevadas. La mayoría de los pacientes se recuperan completamente con medidas de soporte inmediatas.
Referencias
- Klabunde, J., Bischoff, C. and Papa, A.J. (2025). Propanols. In Ullmann’s Encyclopedia of Industrial Chemistry. https://doi.org/10.1002/14356007.a22_173.pub3
- Logsdon, J.E. and Loke, R.A. (2000). Isopropyl Alcohol. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0919151612150719.a01
- Jolliff, H.A. (2017). Isopropyl Alcohol. In: Brent, J., et al. Critical Care Toxicology. Springer, Cham. https://doi.org/10.1007/978-3-319-17900-1_53
- Co, I. N.; Gunnerson, K. J. Chapter 71 – Iatrogenic and Poison-Derived Acid Base Disorders. In Critical Care Nephrology, 3rd ed.; Ronco, C., Bellomo, R., Kellum, J. A., Ricci, Z., Eds.; Elsevier, 2019; pp 417-423.e2. DOI: 10.1016/B978-0-323-44942-7.00071-6
- Gwaltney-Brant, S. M. Chapter 24 – Miscellaneous Indoor Toxicants. In Small Animal Toxicology, 3rd ed.; Peterson, M. E., Talcott, P. A., Eds.; W.B. Saunders, 2013; pp 291-308. DOI: 10.1016/B978-1-4557-0717-1.00024-7
- Slaughter, R. J., Mason, R. W., Beasley, D. M. G., Vale, J. A., & Schep, L. J. (2014). Isopropanol poisoning. Clinical Toxicology, 52(5), 470–478. https://doi.org/10.3109/15563650.2014.914527
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Chemical Agents and Related Occupations. Lyon (FR): International Agency for Research on Cancer; 2012. (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 100F.) ISOPROPYL ALCOHOL MANUFACTURE BY THE STRONG-ACID PROCESS. Available from: https://www.ncbi.nlm.nih.gov/books/NBK304434/
- Carls, R.-R.; Osterburg, G.; Prezelj, M.; Webers, W. «Process for the production of isopropyl alcohol.» U.S. Patent 4,760,203, 1988. Available from: https://patents.google.com/patent/US4760203A/en
- Hirata, S.; Ogawa, S. «Process for producing isopropyl alcohol.» U.S. Patent 5,763,693, 1998. Available from: https://patents.google.com/patent/US5763693A/en
- Gershbein, L. L.; Pines, H.; Ipatieff, V. N. «Reactions of Isopropyl Alcohol in the Presence of Catalysts Containing Magnesium Oxide.» J. Am. Chem. Soc., 1947, 69 (11), 2888–2893. DOI: 10.1021/ja01203a074
