Ácido glucónico: propiedades, reacción, producción y usos
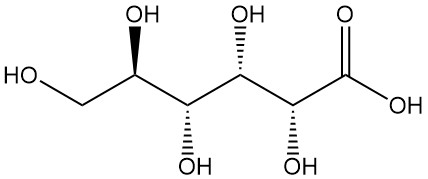
¿Qué es el ácido glucónico?
El ácido glucónico, también conocido como ácido 1,2,3,4,5-pentahidroxi pentano-1-carboxílico, es un ácido orgánico con la fórmula C6H12O7. Es un polvo blanco, inodoro y cristalino que se encuentra de forma natural en los seres humanos y otros organismos y también en productos alimenticios como el vino y la miel.
El ácido glucónico fue descubierto por primera vez en la década de 1870 por Hlasiwetz y Habermann durante la oxidación de la glucosa con cloro, y fue aislado en forma de sales de bario y calcio.
Más tarde, los investigadores descubrieron que el ácido glucónico se podía producir tratando varios mono-, di- y polisacáridos con agentes oxidantes como halógeno elemental, sales de cobre (II) o hexacianoferrato (III), u óxido de mercurio (II).
Los subproductos de estas reacciones dependen del tipo de azúcar y del oxidante utilizado, pero pueden incluir ácido fórmico, ácido glicólico, ácido oxálico y dióxido de carbono.
En la década de 1880, Butroux descubrió que el ácido glucónico se producía, junto con el ácido acético, por la acción oxidativa de Acetobacter aceti sobre la glucosa, que también se descubrió que era característica de otras bacterias.
Molliard fue el primero en informar sobre la presencia de ácido glucónico en cultivos de Aspergillus niger, anteriormente conocido como Sterigmatocystis nigra. El método preferido para producir ácido glucónico y sus derivados en la actualidad se basa en cepas de Aspergillus, según el trabajo de varios investigadores.
La oxidación anódica se propuso en la década de 1930 como método para preparar gluconato de calcio, seguida más tarde por estudios sobre la oxidación catalítica de la glucosa utilizando aire u oxígeno.
Tabla de contenido
1. Propiedades físicas del ácido glucónico
La cristalización del ácido D-glucónico en su forma libre es difícil y, según algunos estudios, la cristalización de la sustancia anhidra solo es posible por debajo de los 30 °C, y la del monohidrato a 0–3 °C.
La masa molecular del ácido glucónico es de 196,16 g/mol.
La forma anhidra del ácido glucónico es un polvo cristalino blanco, inodoro, con un punto de fusión que oscila entre 120 y 131 °C debido a la formación de anhídridos intramoleculares y una rotación específica de [α]D20 = -6,7° y [α]D25 = -5,4°.
Es altamente soluble en agua, ligeramente soluble en etanol e insoluble en solventes no polares. La solución acuosa comercial de ácido glucónico al 50% tiene un pH de 1,82 y una densidad de 1,23 g/cm3.
El ácido D-glucónico forma lactonas al almacenarse sobre un desecante a temperatura ambiente o al calentarse por encima de 50 °C y sufre pirólisis por encima de los 200 °C.
Existe en equilibrio con dos lactonas (1,5-lactona (1) y 1,4-lactona (2)) en solución acuosa y en estado sólido. El ácido libre tiene una constante de disociación (KA) de 1,99 x 10-4 y un pKa de 3,70.
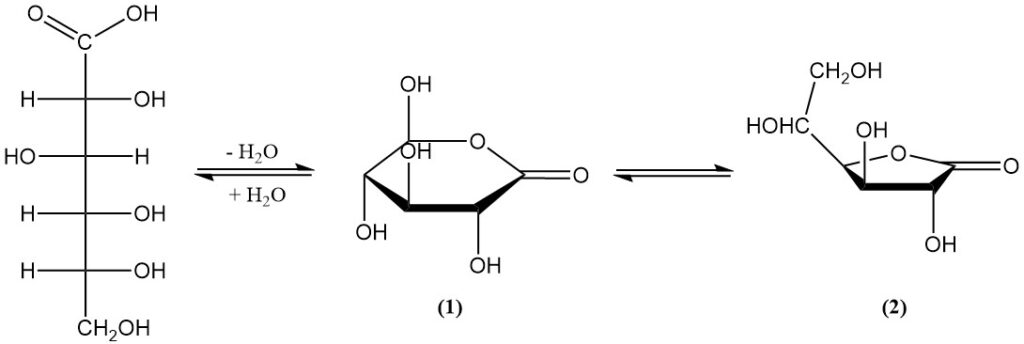
La 1,5-lactona (1) es un sólido cristalino blanco con un ligero dulzor, un punto de fusión de 153 °C y una rotación específica: [α]D20 = +66,2°. Es muy soluble en agua (y aumenta con la temperatura) y ligeramente soluble en algunos disolventes orgánicos.
La 1,4-lactona (2) aparece como agujas finas con un punto de fusión de 134–136 °C y una rotación específica: [α]D20 = +67,8°. Tiene baja solubilidad en la mayoría de los disolventes.
2. Reacciones químicas del ácido glucónico
La oxidación de las lactonas del ácido glucónico o de la sal de calcio con oxidantes suaves como el ácido nítrico o el peróxido de hidrógeno produce una mezcla de ácidos oxoglucónicos, principalmente con grupos cetona en las posiciones 2 y 5.
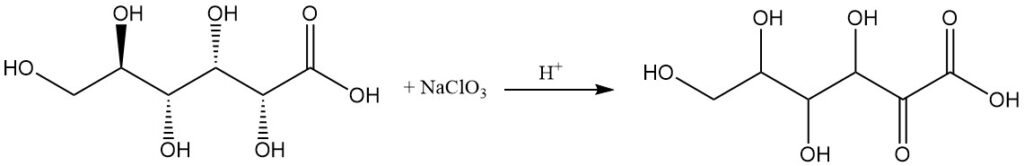
La oxidación anódica, la oxidación con clorato de sodio en una solución ácida o la fermentación por bacterias específicas, como las especies de Acetobacter, pueden producir ácido 2-oxo-D-glucónico como producto principal.
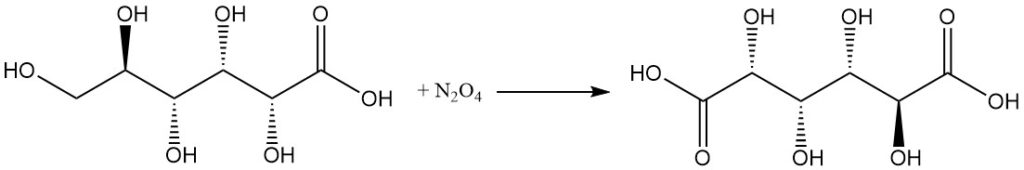
La reacción con ácido nítrico concentrado, o N2O4, convierte el ácido glucónico en ácido glucárico.
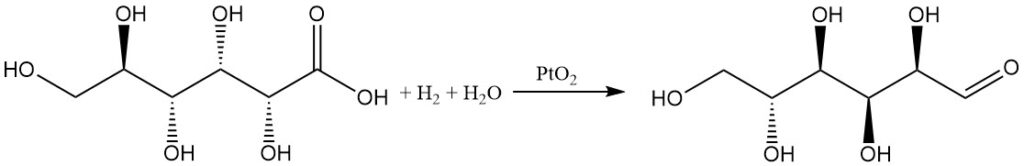
La hidrogenación del ácido glucónico en agua con un catalizador de óxido de platino produce D-glucosa con un rendimiento moderado, mientras que la 1,5-lactona da un alto rendimiento.
El reflujo de ácido glucónico con ácido yodhídrico concentrado y fósforo rojo produce ácido hexanoico.
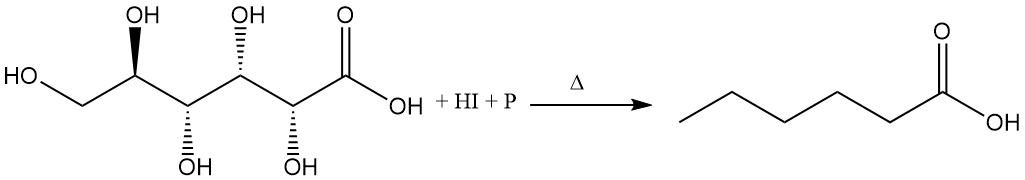
Los grupos funcionales del ácido glucónico pueden reaccionar teóricamente con varios reactivos (alcoholes, ácidos, etc.); sin embargo, es necesaria una reacción completa para obtener derivados estables. Las reacciones parciales crean mezclas inestables susceptibles a la hidrólisis y tienen un valor práctico limitado.
El ácido glucónico y sus sales alcalinas son valiosos debido a su capacidad para formar complejos estables con cationes polivalentes. Algunos ejemplos incluyen sales de gluconato de calcio, cobre, hierro y manganeso.
Los estudios de resonancia magnética nuclear sugieren que tanto los grupos carboxilo como los hidroxilo están involucrados en la formación de complejos con estos cationes.
3. Producción de ácido glucónico
El ácido D-glucónico se produce industrialmente mediante la oxidación de glucosa o materias primas ricas en glucosa. El proceso de oxidación puede ser químico, electrolítico, catalítico o bioquímico.
3.1. Producción de ácido glucónico mediante oxidación química de glucosa
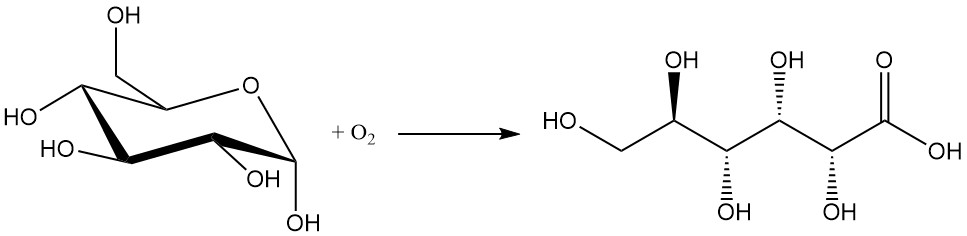
La oxidación química de la glucosa es el método menos preferido debido a sus bajos rendimientos (entre el 60 y el 80%) y a la formación de subproductos no deseados. El aislamiento y la purificación del producto deseado son difíciles.
Los oxidantes comunes utilizados en este proceso incluyen peróxido de hidrógeno, ozono y oxígeno.
3.2. Producción de ácido glucónico por oxidación electroquímica de glucosa
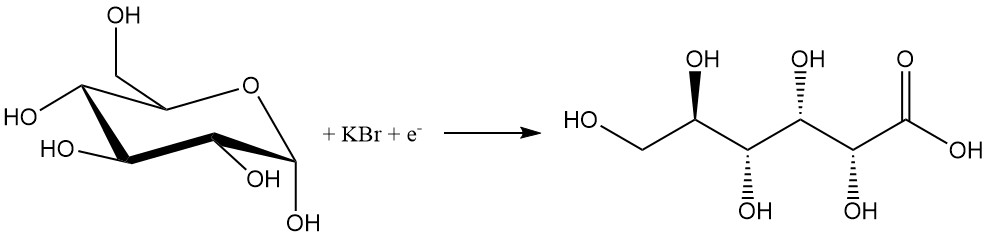
Al igual que los métodos químicos, el proceso electroquímico tiene una baja selectividad debido al uso de halógenos.
Una solución de glucosa que contiene un 10 % de bromuro se electroliza a una densidad de corriente de 1 a 20 A/dm2 para producir un 80 a un 97 % de ácido glucónico. Se añaden bases como carbonato de calcio o hidróxidos para neutralizar el ácido resultante.
El alto costo de la electricidad hace que este método sea menos competitivo.
3.3. Producción de ácido glucónico por oxidación catalítica de glucosa
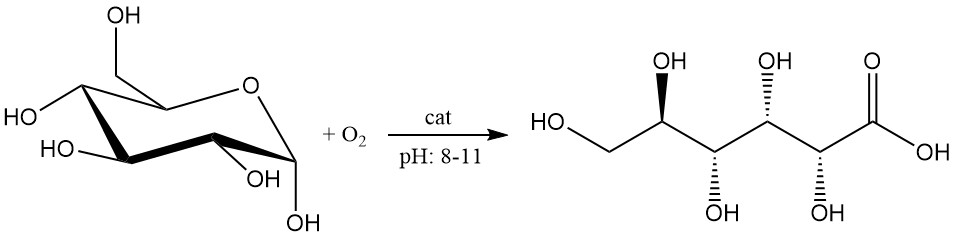
La oxidación catalítica de la glucosa ha experimentado avances recientes y se considera prometedora para la producción a escala industrial.
La solución de glucosa a una concentración de 1 – 2 mol/L se oxida con oxígeno o aire a un pH entre 8 y 11.
Originalmente, se utilizaban como catalizadores metales del grupo del platino sobre soportes, como carbón activado y óxido de aluminio. Sin embargo, algunos de los desafíos que han surgido al utilizar este tipo de catalizador incluyen la desactivación del catalizador, la necesidad de glucosa pura y la formación de subproductos.
El dopado de estos catalizadores con elementos como plomo, selenio o bismuto mejora la actividad y la selectividad, y el carbón activado es el soporte preferido para estos catalizadores.
Al utilizar estos catalizadores para oxidar una solución de glucosa 2 M a ácido glucónico con oxígeno a 50 °C y pH 9,5, se han logrado altos rendimientos (>99,5 %) y pureza (>99,5 %) con necesidades mínimas de purificación.
Estos catalizadores también son reutilizables, con una pérdida mínima de actividad.
La viabilidad económica de este método depende en gran medida del coste, la actividad, la selectividad y la vida útil del catalizador, junto con la purificación del producto y los requisitos energéticos.
A pesar de las sugerencias anteriores, la oxidación fotoquímica de la glucosa a ácido glucónico no es viable.
3.4. Producción de ácido glucónico por fermentación
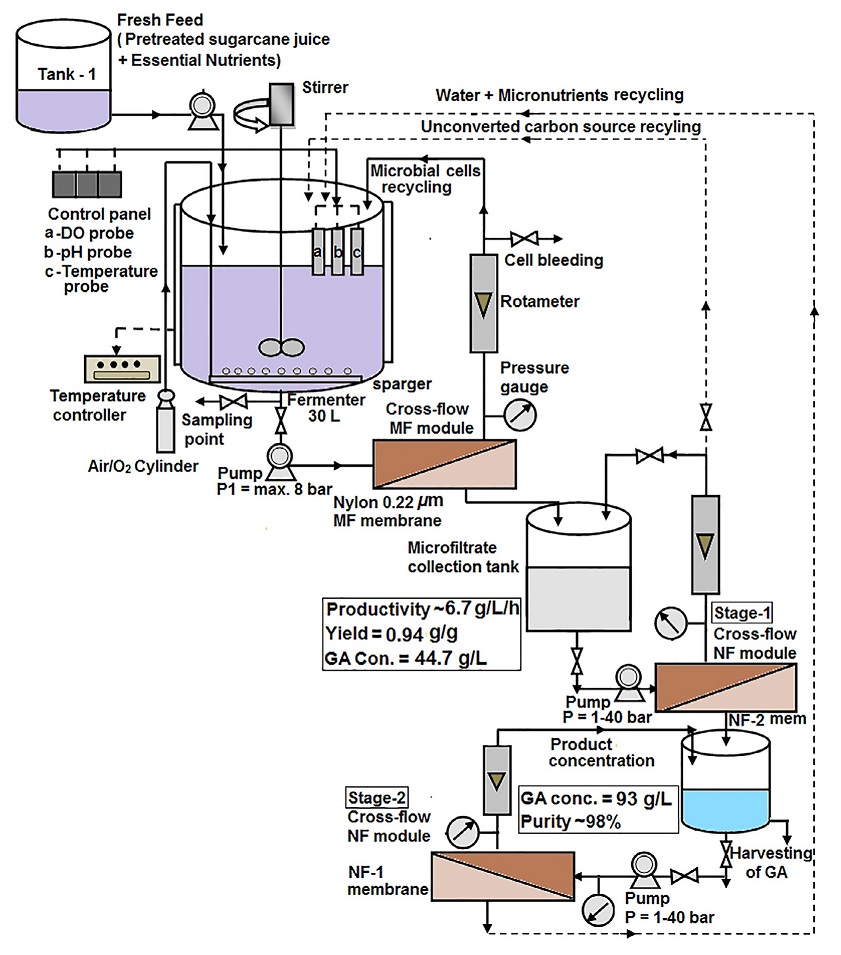
El ácido D-glucónico se produce comercialmente mediante fermentación biológica utilizando dos organismos principales: Aspergillus niger y Gluconobacter suboxydans.
3.4.1. Proceso de Aspergillus niger
La glucosa se oxida a ácido glucónico por la enzima glucosa oxidasa en las células fúngicas. Esta enzima utiliza el dinucleótido de flavina y adenina como cofactor, produciendo finalmente peróxido de hidrógeno. La catalasa, otra enzima presente en el hongo, descompone el peróxido de hidrógeno en agua y oxígeno.
El ácido glucónico formado puede existir en equilibrio con su forma lactona. El pH óptimo para este proceso es de alrededor de 5,6.
La producción a gran escala implica la fermentación de un caldo nutritivo esterilizado que contiene glucosa, sulfato de magnesio, fosfato de potasio y una fuente de nitrógeno. El caldo se inocula con un cultivo de Aspergillus niger.
Durante la fermentación, la actividad de la glucosa oxidasa aumenta rápidamente, lo que conduce a un aumento correspondiente en la producción de ácido glucónico. El proceso suele durar entre 40 y 100 horas, y es importante mantener un buen suministro de oxígeno y un control adecuado del pH para obtener un rendimiento eficiente.
Después de la fermentación, la biomasa fúngica se elimina por filtración y la solución de ácido glucónico se purifica mediante varios pasos, como la decoloración y la filtración. Según el producto final deseado, la solución se puede cristalizar para obtener ácido glucónico o secar por aspersión para obtener una solución concentrada.
3.4.2. Proceso de Gluconobacter suboxydans
Este proceso utiliza dos enzimas deshidrogenasas de glucosa para la conversión de glucosa en ácido glucónico. A diferencia del método de Aspergillus niger, Gluconobacter suboxydans requiere menos aireación debido a su mayor afinidad por el oxígeno.
Además, este organismo tolera condiciones más ácidas, lo que permite el aislamiento directo del ácido glucónico libre del caldo de fermentación.
3.4.3. Otros métodos y procesamiento posterior
Aunque todavía no son comercialmente viables, se están explorando algunos procesos que utilizan bacterias metilotrópicas acidófilas como Acetobacter methanolicus para la producción directa de ácido glucónico. También se están realizando investigaciones sobre el uso de enzimas o microorganismos inmovilizados para este propósito.
La recuperación de ácido glucónico libre de caldos de fermentación que contienen gluconato de sodio (la sal de sodio del ácido glucónico) se puede lograr mediante técnicas como el intercambio de cationes o la electrodiálisis.
La cristalización a partir de una solución sobresaturada es el método principal para obtener ácido glucónico puro en su forma de lactona. La deshidratación con alcoholes específicos seguida de la cristalización es otro método para la producción de lactona.
4. Usos del ácido glucónico
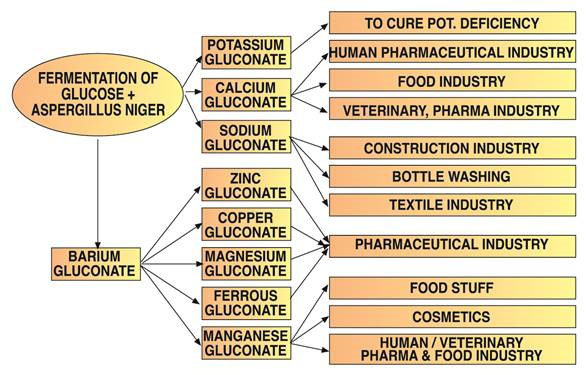
El ácido glucónico se utiliza en aplicaciones de limpieza debido a su capacidad para disolver óxidos, hidróxidos y carbonatos metálicos y también debido a la formación de complejos solubles en agua con estos cationes.
El ácido glucónico se utiliza para eliminar depósitos calcáreos y de óxido de varios metales, incluidos el hierro galvanizado, las aleaciones de magnesio y el acero inoxidable. Se emplea para limpiar las incrustaciones de cerveza y leche de estas superficies.
Junto con las sales de magnesio, el ácido glucónico actúa como estabilizador para los baños de blanqueador de peróxido en la industria textil.
Las propiedades fisiológicas del ácido D-glucónico lo hacen adecuado para aplicaciones en alimentos y bebidas. Las concentraciones bajas (0,02-0,1 %) invierten eficazmente la sacarosa sin más reacciones de fructosa.
Los oligoelementos se administran a menudo como sales de gluconato debido a su alta biodisponibilidad y tolerancia. El gluconato de potasio, disponible en formas anhidras o monohidratadas, tiene usos farmacéuticos específicos.
El ácido glucónico 1,5-lactona es un sustituto conveniente del ácido libre en muchos ejemplos. Ofrece ventajas en entornos ácidos, como encurtidos, curado de embutidos y fermentación de productos horneados.
El gluconato de sodio es la sal de gluconato más común. Forma complejos con cationes metálicos y su estabilidad aumenta a un pH más alto. Limpia eficazmente diversas superficies y elimina la grasa, la corrosión, el óxido y los recubrimientos de óxido del aluminio, el acero, el cobre y sus aleaciones.
Las soluciones de gluconato de sodio alcalinas calientes (95-100 °C) eliminan eficazmente la pintura y el barniz sin dañar las superficies subyacentes.
Las soluciones de gluconato se utilizan para el pretratamiento de superficies para la soldadura fuerte de níquel-cobalto sobre aluminio y para preparar superficies galvanizadas lisas y brillantes de níquel, estaño y zinc. Cada vez más, está sustituyendo al ion cianuro tóxico en algunas aplicaciones.
El gluconato de sodio, a veces combinado con polifosfatos, se utiliza en la industria papelera como agente de encolado que imparte resistencia al ácido al papel. En los textiles, ayuda a desencolar tejidos de poliéster o poliamida y a dar acabado a las fibras de celulosa natural.
La estabilidad del gluconato de sodio a altas temperaturas y pH, junto con su capacidad para secuestrar agentes endurecedores del agua, lo convierte en un componente útil de los limpiadores comerciales. Se utiliza para lavar botellas y limpiar superficies de aluminio.
Los fabricantes de hormigón utilizan el gluconato de sodio como un retardante de curado muy eficaz. Mejora la homogeneidad del hormigón, la resistencia al agua, la resistencia a las heladas y la trabajabilidad, al tiempo que reduce el agrietamiento.
Una ventaja significativa del ácido glucónico, su lactona y sus sales es su biodegradabilidad en los sistemas de tratamiento de aguas residuales. Esto se extiende a sus complejos metálicos con aluminio, cobre, hierro y zinc. Incluso los complejos de gluconato de cromo se biodegradan, aunque de forma más lenta.
Los iones metálicos liberados se eliminan durante la purificación de las aguas residuales, lo que reduce la posible movilización de metales pesados. La biodegradación y la precipitación de hidróxido (a pH 9-10) contribuyen a la destrucción de los complejos de gluconato de metales pesados en las aguas residuales.
Referencias
- Gluconic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a12_449
- S. Banerjee et al., Fermentative production of gluconic acid: A membrane-integrated Green process, Journal of the Taiwan Institute of Chemical Engineers (2018), https://doi.org/10.1016/j.jtice.2018.01.030
