Ácido gálico: propiedades, reacciones, producción y usos
¿Qué es el ácido gálico?
El ácido gálico, también conocido como ácido 3,4,5-trihidroxibenzoico, es un ácido hidroxiaromático con la fórmula química C7H6O5. Es un sólido blanco, pero a menudo aparece marrón debido a la oxidación, que es soluble en alcohol y disolventes polares. Fue descubierto por Carl Wilhelm Scheele en 1786.
El ácido gálico se encuentra en las hojas de gayuba, en la corteza de la raíz de la granada, en las agallas, en el hamamelis, en el zumaque, en las hojas de té, en la corteza de roble y en muchas otras plantas, tanto en su estado libre como parte de la molécula de tanino.
Tabla de contenido
1. Propiedades físicas del ácido gálico
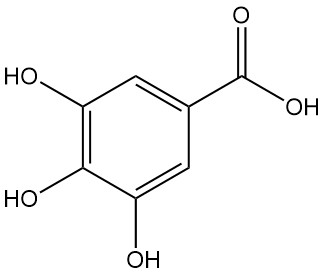
El ácido 3,4,5-trihidroxibenzoico, comúnmente llamado ácido gálico, se presenta como un polvo cristalino de color blanco a amarillo pálido. La cristalización a partir de soluciones acuosas da una forma monohidrato en forma de agujas sedosas, que se descompone en pirogalol y dióxido de carbono al calentarse a 258–263 °C.
El ácido gálico es soluble en agua tibia, etanol, éter dietílico y acetona, e insoluble en benceno y cloroformo.
Las propiedades físicas del ácido gálico se enumeran en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Número CAS | [149-91-7] |
| Fórmula química | C7H6O5 |
| Masa molecular | 170,12 g/mol |
| Punto de fusión | 258–263 °C (descomposición) |
| Temperatura de sublimación | 210 °C |
| Densidad a 25 °C | 1,694 g/cm3 |
| pKa1 a 30 °C | 2,33 |
| pKa2 | 8,85 |
2. Reacciones químicas del ácido gálico
La molécula de ácido gálico contiene dos grupos funcionales: grupos hidroxilo (fenólicos) y un grupo de ácido carboxílico. Como ambos grupos funcionales tienen hidrógenos ácidos, pueden reaccionar para formar numerosos ésteres, éteres y sales, incluido el ácido digálico (1).

Las soluciones de ácido gálico, en particular las que contienen sales de metales alcalinos, son susceptibles a la oxidación por el oxígeno atmosférico, lo que produce un cambio de color a marrón como el del pirogalol.
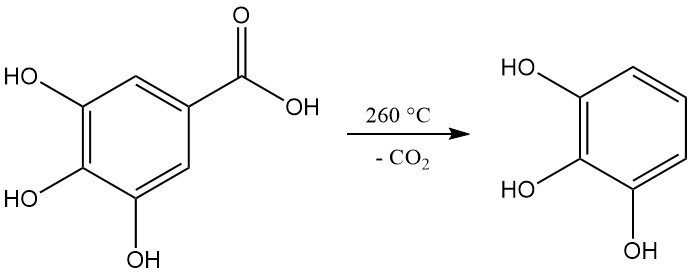
La descarboxilación del ácido gálico mediante calentamiento a una temperatura superior a 260 °C produce pirogalol.
El ácido gálico es un potente agente reductor capaz de reducir las sales de oro o plata a sus formas elementales.
La reacción del ácido gálico con las sales de hierro (III) produce un complejo azul intenso, que se utiliza en la formulación de tintes de tinta. La tinta de nuez de agalla, compuesta de ácido gálico y sulfato de hierro (II), sufre una oxidación en el aire para generar el complejo azul de hierro (III) y ácido gálico.
El calentamiento del ácido gálico con ácido sulfúrico concentrado produce hexahidroxiantraquinona (2; ácido rufigálico) por reacción de condensación.

La reacción con clorhidrato de p-nitrosodimetilanilina forma derivados de oxazina.
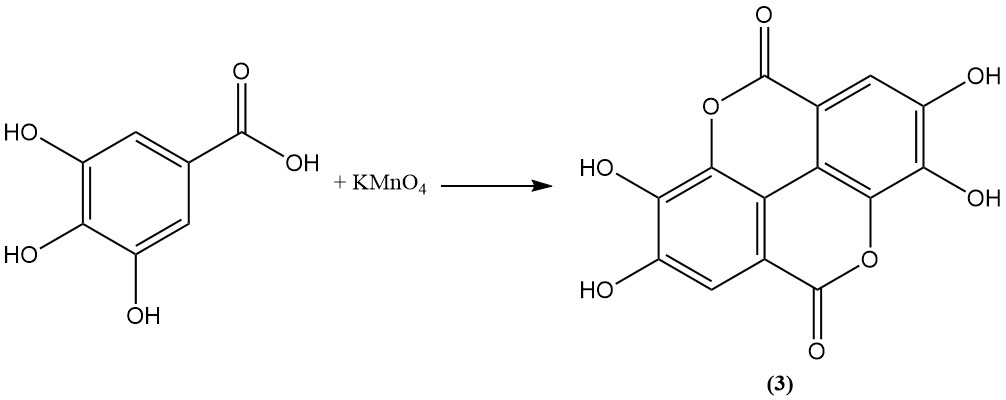
La oxidación del ácido gálico con ácido arsénico, permanganato, persulfato o yodo conduce a la formación de ácido elágico (3).
El grupo ácido carboxílico del ácido gálico se puede esterificar con alcoholes mediante esterificación azeotrópica o por el método de Fischer utilizando alcohol con ácido clorhídrico.

Los derivados éter-éster del ácido gálico se pueden preparar mediante alquilación utilizando sulfatos de dialquilo o haluros de alquilo en presencia de una base o utilizando diazometano.
El grupo hidroxilo en la posición 4 es más reactivo en comparación con los demás. La hidrólisis parcial del ácido 3,4,5-trimetoxibenzoico utilizando ácidos fuertes produce ácido 4-hidroxi-3,5-dimetoxibenzoico (4) (ácido siríngico).

3. Producción de ácido gálico
El ácido gálico es un componente de numerosos agentes curtientes y existe en forma libre o unido a taninos en fuentes naturales como el divi-divi, la corteza de roble, las agallas, las raíces de granada, el zumaque y el té.
El ácido gálico se produce a partir de extractos acuosos de agallas ricos en taninos mediante hidrólisis ácida utilizando ácido sulfúrico a 110–120 °C o mediante tratamiento alcalino.

También se puede preparar por escisión enzimática del tanino por la tanasa o por fermentación utilizando mohos como Penicillium glaucum y Aspergillus niger.
Se han desarrollado procesos de fermentación en estado sólido o sumergidos que utilizan hongos filamentosos libres o inmovilizados, como R. oryzae y Aspergillus foetidus, para hidrolizar el ácido tánico a partir de polvo de tara de bajo costo u otras materias primas ricas en taninos de bajo costo.
Luego, el ácido gálico se extrae de la solución de fermentación con éter dietílico, lo que da como resultado altos rendimientos de aproximadamente el 95 %. Este proceso de biosíntesis consume menos energía en comparación con la hidrólisis ácida convencional.
4. Usos del ácido gálico
El ácido gálico se utiliza en la producción de tinta de nuez de hierro y varios tintes, incluidos antragalol, galocianina, galoflavina y ácido rufigálico.
Los ésteres de galato, especialmente el galato de metilo (galicina) y el galato de propilo, se utilizan como antioxidantes y conservantes alimentarios para las grasas.
El ácido gálico se utiliza como agente reductor en productos farmacéuticos (Dermatol, Airol y sal de bismuto del ácido gálico) y como materia prima para la producción del alcaloide alucinógeno, mescalina, y trimetoprima (antibiótico de amplio espectro).
El ácido gálico se utiliza en la producción de reveladores fotográficos, al igual que el pirogalol, que se utiliza en la absorción de oxígeno y la síntesis de colorantes azoicos.
También se utiliza en el proceso de curtido del cuero debido a sus propiedades astringentes y como antioxidante y conservante en productos alimenticios.
Muchos estudios están investigando los posibles beneficios para la salud del ácido gálico como agente antioxidante, antimicrobiano, antiinflamatorio y anticancerígeno.
5. Toxicología del ácido gálico
Los estudios de toxicidad del ácido gálico indican una baja toxicidad aguda y subaguda. Sin embargo, el compuesto indujo efectos hemorrágicos en embriones de pollo, lo que pone de relieve la necesidad de limitar la dosis.
Los valores de LD50 informados son 320 mg/kg (ratón, intravenoso), 5000 mg/kg (conejo, oral) y 4300 mg/kg (ratón, intraperitoneal). Los valores de LDL0 son 800 mg/kg (ratón, intraperitoneal) y 5 mg/kg (ratón, subcutáneo, 1 día de embarazo)
La exposición humana al ácido gálico se produce principalmente en el trabajo y a través de fuentes dietéticas.
Se clasifica como mutágeno y teratógeno.
Referencias
- Hydroxycarboxylic Acids, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_519
- Organic and Fatty Acid Production, Microbial. – https://www.sciencedirect.com/science/article/abs/pii/B9780123739445001565
- Toxicity of natural products. – https://www.sciencedirect.com/science/article/abs/pii/B9780128243152011891
- https://pubchem.ncbi.nlm.nih.gov/compound/Gallic-Acid
