Acetileno
El acetileno, también conocido como etino, es un gas incoloro e inflamable con la fórmula química C2H2. Es el hidrocarburo más simple con un triple enlace. Se utiliza ampliamente como combustible en la soldadura y el corte con oxiacetileno debido a su llama increíblemente caliente, y como componente químico para diversos plásticos y productos químicos orgánicos.
El acetileno era el componente principal de la química orgánica industrial antes de la adopción generalizada del petróleo como materia prima principal. El proceso de carburo de calcio dominó exclusivamente la producción de acetileno hasta la década de 1940, cuando los métodos de craqueo térmico que utilizaban metano y surgieron otros hidrocarburos.
Las implementaciones iniciales empleaban arcos eléctricos, pero la década de 1950 fue testigo del desarrollo de procesos regenerativos y de oxidación parcial.
A pesar de iniciativas prometedoras como el proceso de llama sumergida de BASF, el HTP de Hoechst y el proceso de plasma de Hüls, la tendencia hacia el etileno como sustancia química fundamental se mantuvo inquebrantable.
Todos los procesos de acetileno, incluidos los métodos de carburo, consumen mucha energía y requieren una importante generación y transferencia de calor. Se diferencian principalmente en cómo se genera y aplica esta energía.
- Para obtener un artículo completo sobre la producción industrial de acetileno, visite el siguiente enlace.
- Para obtener información detallada sobre los usos del acetileno, visite el siguiente enlace.
Tabla de contenido
1. Propiedades físicas del acetileno
El acetileno tiene un triple enlace carbono-carbono (C≡C), caracterizado por una longitud corta (0,1205 nm) y una alta energía de formación. Esta configuración hace que el acetileno sea altamente inestable y reactivo debido a su naturaleza insaturada.
El hidrógeno ácido de los enlaces C-H (pKa=25) contribuye a la reactividad del acetileno. Es más ácido que el etileno (pKa=44) y puede formar acetiluros con bases fuertes.
En condiciones normales, el acetileno es un gas incoloro, no tóxico y con propiedades narcóticas. Ligeramente más ligero que el aire, posee distintas propiedades físicas descritas en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Masa molecular | 26.0379 |
| Temperatura crítica | 308,32 K (35,17 °C) |
| Presión crítica | 6,139 MPa |
| Volumen crítico | 0,113 m3/kmol |
| Punto triple | 192,4 K (-80,75 °C) |
| Presión de triple punto | 128,3kPa |
| Punto de sublimación normal y punto de ebullición normal | 189,15 K (-84,0 °C) |
| Punto de transición cristalina | 133,0 K (-140,15 °C) |
| Entalpía de transición | 2,54 kJ/mol |
| Densidad |
760,2 kg/m3 (131 K) 764,3 kg/m3 (141 K) |
| Densidad (líquido C2H2) | 465,2 kg/m3 (273,15 K) |
| Densidad (C2H2 gaseoso a 1 bar) | 1,095 kg/m3 (288,15 K) |
| Volumen molecular (0 °C, 1,013 bar) | 22.223 m3/kmol |
| Entalpía de vaporización (calculada) | 10,65 kJ/mol (273,15 K) |
| Entalpía de sublimación | 21,168 kJ/mol (5,55 K) |
| Entalpía de formación | 227,5 ± 1,0 kJ/mol (298,15 K) |
| Energía libre de formación de Gibbs | 209,2 ± 1,0 kJ/mol (298,15 K) |
| Entropía de formación | 200,8 J mol−1 K−1 (298,15 K) |
| Entalpía de combustión | −1255,6 kJ/mol (298,15 K) |
| Mayor poder calorífico | 50 400 kJ/kg |
| Poder calorífico inferior | 48 700 kJ/kg |
| Presión de vapor | 2,6633 MPa (273,15 K) |
| Conductividad térmica (0 °C, 1,013 bar) | 0,0184 W·m−1 K−1 |
| Capacidad calorífica (estado de gas ideal) | 43,990 J mol−1 K−1 (298,15 K) |
2. Reacciones químicas del acetileno
El acetileno es altamente reactivo con varios elementos y compuestos debido a su alta insaturación y energía libre positiva de formación. Esta característica lo convierte en una materia prima versátil para numerosas sustancias. Los tipos de reacciones clave incluyen reacciones de adición, sustituciones de hidrógeno, polimerización y ciclación.
El acetileno es más susceptible al ataque nucleofílico en comparación con el etileno. Además, su enlace C-H polarizado (pKa ≈ 25) le otorga propiedades ácidas, facilitando la solubilidad en disolventes básicos y la formación de enlaces de hidrógeno. Este comportamiento difiere de la ley de Raoult para soluciones que contienen acetileno.
El desarrollo de las reacciones de presión del acetileno por parte de W. Reppe marcó un gran avance en la química del acetileno. Los grupos de reacción notables incluyen vinilación, etinilación, carbonilación y polimerización cíclica y lineal.
2.1. Reacciones industrialmente importantes
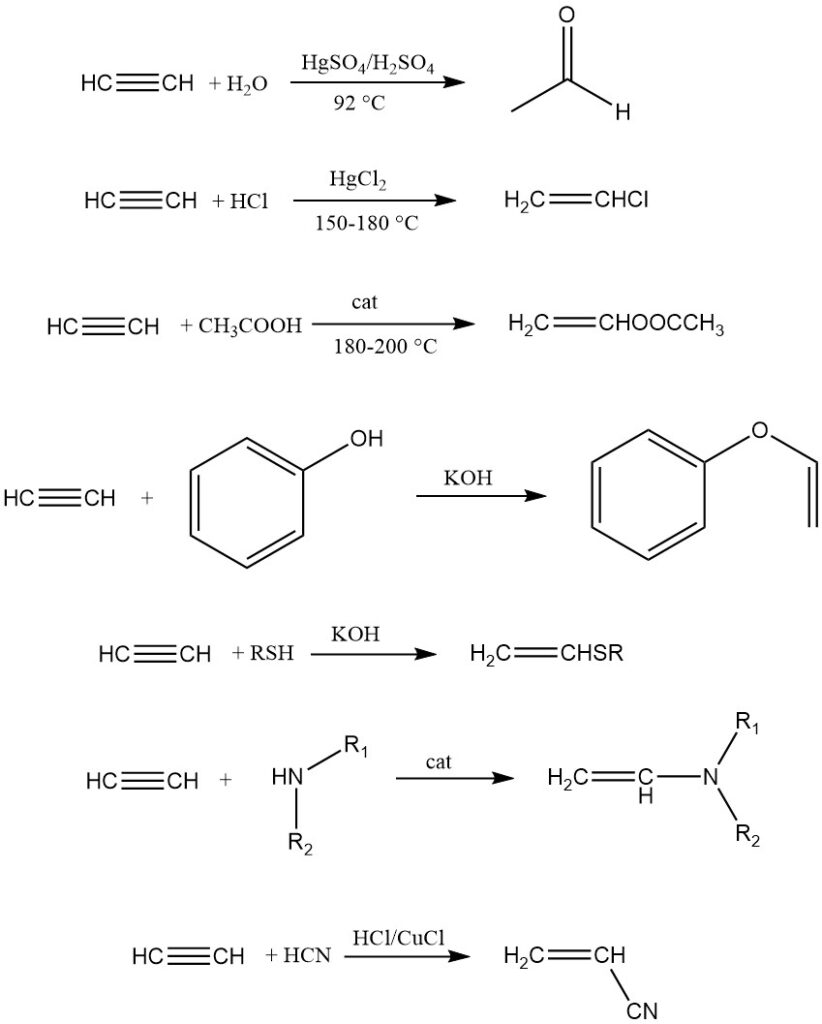
1. Vinilación:
La vinilación implica la adición de compuestos con átomos de hidrógeno móviles (agua, alcoholes, tioles, aminas, etc.) al acetileno, produciendo derivados vinílicos utilizados principalmente para la polimerización.
Existen dos tipos: heterovinilación (hidrógeno de O, S o N) y vinilación C (hidrógeno de carbono unido directamente). Los ejemplos incluyen dimerización de acetileno, trimerización, síntesis de acrilonitrilo y adición de hidrocarburos insaturados reactivos como el ciclopentadieno.
2. Etinilación:
La etinilación agrega compuestos carbonílicos al acetileno preservando al mismo tiempo el triple enlace. Reppe descubrió que los acetiluros de metales pesados, en particular Cu₂C₂·2H₂O·2C₂H₂, catalizan eficazmente la reacción con aldehídos.
La etinilación de cetonas se cataliza con catalizadores alcalinos. El esquema de reacción general es:

El alcohol propargílico y el butinodiol son productos clave de esta reacción.

3. Carbonilación:
La carbonilación implica la reacción de acetileno y monóxido de carbono con compuestos que poseen átomos de hidrógeno móviles, catalizada por carbonilos metálicos (por ejemplo, Ni(CO)₄). También se pueden utilizar haluros metálicos capaces de formar carbonilos.
El ácido acrílico es un producto destacado que se obtiene a partir de acetileno, agua y monóxido de carbono utilizando un catalizador de Ni(CO)₄. Otros productos de la carbonilación de acetileno incluyen tioésteres de ácido acrílico, amidas acrílicas, anhídridos de ácido carboxílico e hidroquinona.

4. Ciclación y Polimerización:
El acetileno, bajo catalizadores adecuados, puede sufrir ciclación y polimerización lineal. Berthelot observó por primera vez la ciclación, produciendo una mezcla de compuestos aromáticos como benceno y naftaleno. Posteriormente, Reppe sintetizó 1,3,5,7-ciclooctatetraeno con un alto rendimiento (70%).
La polimerización lineal se produce con sales de cobre (I), lo que da como resultado vinilacetileno, divinilacetileno, etc. Un ejemplo notable es el cupreno, que se forma calentando acetileno con una esponja de cobre. Los catalizadores Ziegler-Natta facilitan la formación de poliacetileno, que exhibe propiedades únicas como la conductividad tras el dopaje.

2.2. Otras reacciones y derivadas
1. Acetiluros metálicos:
El acetileno forma acetiluros metálicos reemplazando sus átomos de hidrógeno con átomos metálicos (M). Los acetiluros alcalinos y alcalinotérreos se preparan mediante amidas metálicas o reacción directa con metales fundidos o finamente divididos.

Los acetiluros de cobre explosivos (Cu₂C₂·H₂O) se forman mediante la reacción de sales de cobre (I) con acetileno en amoníaco líquido o sales de cobre (II) con acetileno en solución básica con agentes reductores como hidroxilamina.
Además, los óxidos de cobre y otras sales de cobre pueden convertirse fácilmente en acetiluros. Debido a esta reactividad, se deben evitar estrictamente las tuberías de cobre en los sistemas de acetileno. Existen otros acetiluros metálicos explosivos para la plata, el oro y el mercurio.
2. Halogenación:
El cloro se agrega al acetileno con FeCl₃ como catalizador para producir 1,1,2,2-tetracloroetano, un intermedio importante en la producción de solventes. El bromo y el yodo también pueden participar en reacciones de adición, deteniéndose el yodo en 1,2-diyodoetileno.
3. Hidrogenación:
El acetileno sufre una hidrogenación parcial o completa sobre catalizadores de Pt, Pd o Ni, lo que da como resultado etileno o etano.
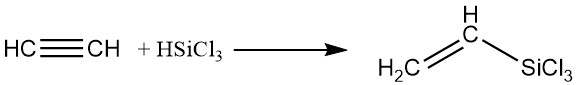
4. Compuestos de Silicio Orgánico:
Los silanos se pueden añadir al acetileno utilizando catalizadores de platino en fase líquida, produciendo derivados que contienen silicio.
5. Oxidación:
El acetileno es resistente a la oxidación a temperatura ambiente pero forma mezclas explosivas con el aire o el oxígeno. Agentes oxidantes como el ozono o el ácido crómico lo convierten en ácido fórmico, dióxido de carbono y otros productos. La reacción con ozono diluido produce glioxal.
6. Hidrata:
Bajo presión y temperaturas inferiores a aproximadamente 15°C, el acetileno forma hidratos cerosos con la composición C₂H₂·6H₂O. Estas estructuras similares a clatratos incorporan moléculas de agua en su red cristalina, lo que afecta el almacenamiento y manipulación del acetileno. La formación de hidratos puede causar bloqueos en los equipos y presentar riesgos de descomposición debido a ondas de choque.
7. Cloroacetilenos:
7.1. Monocloroacetileno (HC≡CCl):
El monocloroacetileno es un gas de olor nauseabundo que irrita las mucosas. Se obtiene haciendo reaccionar 1,2-dicloroetileno con NaOH alcohólico en presencia de Hg(CN)₂. Es altamente inflamable y explota fácilmente en presencia de incluso trazas de oxígeno o aire y extremadamente venenoso.
7.2. Dicloroacetileno (ClC≡CCl):
El dicloroacetileno es un aceite incoloro con un olor desagradable que explota en el aire o al calentarse. Se prepara a partir de acetileno en una solución de hipoclorito de potasio fuertemente alcalino o haciendo reaccionar vapor de tricloroetileno con álcali cáustico. Es altamente explosivo y se descompone fácilmente, lo que presenta importantes problemas de seguridad.
3. Toxicología del acetileno
El acetileno puro actúa como un asfixiante simple al desplazar el oxígeno de la atmósfera. Sin embargo, el acetileno comercial ya no contiene cantidades significativas de impurezas tóxicas como arsina, sulfuro de hidrógeno y fosfina, que históricamente contribuyeron a los efectos adversos para la salud derivados de la exposición al acetileno producido a partir de carburo de calcio.
La concentración letal (CL) más baja documentada para ratas es del 9 % por volumen en el aire. Los perros exhiben una mayor tolerancia y requieren un 80 % de acetileno para inducir la narcosis con aumento de la presión arterial y disminución del pulso (lo que indica estimulación vasomotora y del nervio vago).
En humanos, la inhalación de un 10% de acetileno produce una intoxicación leve, mientras que un 20% provoca una intoxicación importante y un 30% provoca falta de coordinación. La pérdida del conocimiento se produce en 5 minutos con una exposición del 35 %.
La inhalación letal implica un 35 % durante 5 a 10 minutos o un 10 % durante 30 a 60 minutos. Los síntomas de intoxicación incluyen excitación, coma, cianosis, pulso débil/irregular y pérdida de memoria.
No hay evidencia que sugiera efectos perjudiciales para la salud por la exposición repetida a niveles tolerables de acetileno. Curiosamente, los estudios en humanos revelaron una menor susceptibilidad tras la exposición repetida.
Si bien el 33 % de acetileno indujo la pérdida del conocimiento en 6 minutos inicialmente, las exposiciones posteriores dentro de la misma semana requirieron duraciones más largas (9 minutos en la segunda y más de 33 minutos en la tercera). para lograr el mismo efecto.
A diferencia de otros gases, el acetileno no irrita las membranas mucosas. En particular, no se ha establecido ningún valor límite umbral (TLV) ni concentración máxima permitida (MAK) para el acetileno.
La actual Administración de Salud y Seguridad Ocupacional (OSHA) y el Instituto Nacional de Seguridad y Salud Ocupacional ( NIOSH) el límite de exposición permisible (PEL) es de 2500 ppm (partes por millón) en el aire.
Referencia
- Acetileno; Enciclopedia de química industrial de Ullmann. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_097.pub4
