Zitronensäure: Herstellung, Reaktionen und Verwendungen
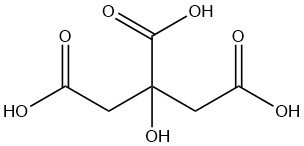
Zitronensäure ist eine schwache organische Säure, die natürlicherweise in Zitrusfrüchten, insbesondere Zitronen und Limetten, vorkommt. Bei Raumtemperatur ist es ein farbloser, kristalliner Feststoff mit der Formel C6H8O7.
Zitronensäure ist eine Tricarbonsäure, die erstmals 1784 von SCHEELE durch Ausfällung von Calciumcitrat mit Kalk aus Zitronensaft gewonnen und kristallisiert wurde. Die drei Carboxyl- und eine Hydroxylgruppe des Moleküls wurden 1838 von LIEBIG identifiziert.
Im Vereinigten Königreich wurde Zitronensäure erstmals 1860 aus Calciumcitrat hergestellt, und 1880 begann die Produktion aus Calciumcitrat in Frankreich, Deutschland und den Vereinigten Staaten.
Zitrusfrüchte sind reichliche Quellen für Zitronensäure, wobei der Fruchtsaft zwischen 5 und 9 % Zitronensäure enthält. Darüber hinaus ist Zitronensäure in verschiedenen anderen Früchten enthalten und kommt in fast allen Pflanzen- und Tierarten vor.
Der Zitronensäurezyklus, auch Krebszyklus oder Tricarbonsäurezyklus genannt, ist entscheidend für die Oxidation von Zuckern und Acetaten zu Kohlendioxid und Wasser und setzt Energie für physiologische Funktionen frei
Inhaltsverzeichnis
1. Herstellung von Zitronensäure
Zitronensäure wird seit etwa 50 Jahren traditionell aus unreifen Zitrusfrüchten gewonnen.
In Süditalien war diesem Zweck ein ganzer Industriezweig mit Obstgärten und Verarbeitungsanlagen gewidmet. Dabei wurde der Saft unreifer Früchte gepresst und mit Kalk (CaO) vermischt, um Calciumcitrat auszufällen.
Der Feststoff wurde dann mit Schwefelsäure behandelt, um Calciumsulfat auszufällen und eine Lösung zu bilden, aus der Zitronensäure kristallisierte.
Die Ausbeute an gereinigtem Produkt betrug etwa 2–3 Gew.-% der Frucht, und es wurden auch Zitrusöle erhalten. Mittlerweile wurde diese Methode jedoch durch die Fermentation ersetzt.
1.1. Herstellung von Zitronensäure durch Fermentation
Seit den 1930er Jahren ist die Fermentation die kostengünstigste Methode zur Herstellung von Zitronensäure. In diesem Prozess werden Stämme von A. niger eingesetzt, um Kohlenhydrate in Zitronensäure umzuwandeln.
In großtechnischen Produktionsanlagen werden sowohl Oberflächenfermentation als auch Submersfermentation eingesetzt.
Einige kleinere Anlagen nutzen die Feststofffermentation auf Basis von Kohlenhydraten, die in landwirtschaftlichen Abfällen oder Nebenprodukten enthalten sind.
Die biochemischen Prozesse, die zur Ausscheidung von Zitronensäure führen, werden seit über einem Jahrhundert von zahlreichen Forschern untersucht.
Die theoretische Ausbeute an Zitronensäure-Monohydrat aus 100 kg Saccharose beträgt 123 kg bzw. 112 kg wasserfreie Säure. Allerdings verbraucht A. niger im Fermentationsprozess etwas Zucker für Wachstum und Atmung, was zu einem tatsächlichen industriellen Ertrag führt, der unter dem theoretischen Ertrag liegt.
Die Ausbeute schwankt zwischen 60 und 85 % der Theorie, abhängig von Faktoren wie der Reinheit des Substrats, dem spezifischen Stamm von A. niger und der Kontrolle der Fermentation.
1.1.1. Festkörperfermentation
Bei der Festkörperfermentation zur Zitronensäureproduktion werden kohlenhydrathaltige landwirtschaftliche Rückstände in Gräben ausgebracht und mit Wasser befeuchtet.
Verschiedene landwirtschaftliche Rückstände wie Apfeltrester, Maniok-Bagasse, Kaffeeschalen, Maiskolben, Traubentrester, Abfälle von Kiwi, Okara, Orange, Ananas und Zuckerrohr können als potenzielle Substrate für die Zitronensäureproduktion verwendet werden.
Dem Wasser können Nährstoffe zugesetzt werden, um das mikrobielle Wachstum zu unterstützen. Anschließend wird der Graben mit einem geeigneten Aspergillus-Stamm beimpft, der die Kohlenhydrate in Zitronensäure umwandeln kann.
Sobald die Kohlenhydrate aufgebraucht sind, wird das Medium mit Wasser gewaschen, um Zitronensäure zu extrahieren. Anschließend wird die Zitronensäure einem entsprechenden Rückgewinnungs- und Reinigungsprozess unterzogen.
1.1.2. Oberflächenfermentation
Die Oberflächenfermentation ist eine weit verbreitete Methode zur Zitronensäureproduktion, bei der Aspergillus niger auf einem flüssigen Substrat in vertikal gestapelten Pfannen in einer sterilisierten Kammer wächst.
Das Fermentationssubstrat, typischerweise Melasse oder Zuckersirup, enthält eine unterschiedliche Konzentration an Zucker und es werden anorganische Nährstoffe wie Ammoniumnitrat, Kaliumphosphat, Magnesiumsulfat, Zinksulfat und Kaliumferrocyanid hinzugefügt.
Der pH-Wert wird je nach Kohlenhydratquelle zwischen 3 und 7 eingestellt. Die Beimpfung des sterilen Substrats erfolgt mit A. niger-Sporen, die keimen und auf der Flüssigkeitsoberfläche eine Schimmelschicht bilden. Nach zwei bis drei Tagen beginnt die Produktion von Zitronensäure und läuft konstant weiter, bis etwa 80-90 % des Zuckers verbraucht sind.
Die Fermentation verläuft weitere vier bis zehn Tage lang langsam, bevor die Pfannen geleert und das Myzel von der Flüssigkeit getrennt wird. Das Myzel wird typischerweise als Futterzutat vermarktet, während die Flüssigkeit einem Rückgewinnungsprozess zur weiteren Zitronensäurereinigung unterzogen wird.
Die Kammer und die Pfannen werden mit Dampf sterilisiert und feuchte und sterile Luft mit kontrollierter Temperatur wird eingeleitet, um die Kammer während der Fermentation zu kühlen.
Das Substrat kann manuell oder automatisch eingebracht und bei Bedarf mit Nährstoffen ergänzt werden.
Die Sterilisation kann diskontinuierlich oder kontinuierlich erfolgen, wobei letzteres Verfahren weniger Energie verbraucht und schneller ist.
1.1.3. Untergetauchte Fermentation
Die submerse Gärung wird in großen Gärbehältern durchgeführt, die sich seit der zweiten Hälfte des 20. Jahrhunderts aufgrund geringerer Arbeits- und Investitionskosten sowie kompakterer Bauflächen zum bevorzugten Verfahren für Neuinvestitionen entwickelt hat.
Die Gärtanks sind typischerweise hoch und schmal, um den Sauerstofftransfer zu maximieren, und können mit Mischgeräten ausgestattet sein.
Das Mischen ist besonders wichtig, wenn das Kohlenhydrat-Ausgangsmaterial im Fermentationsgefäß hydrolysiert wird. Für weniger viskose flüssige Ausgangsstoffe sind Airlift-Fermentationsbehälter wirtschaftlicher.
Am Boden des Behälters oder unter dem Rührer angebrachte Einblasdüsen liefern Luft, die mit Sauerstoff angereichert werden kann. Die Luft strömt durch einen Sterilfilter und wird bei Bedarf gekühlt.
Da der Prozess exotherm ist, muss der Behälter mit Wärmeaustauschflächen ausgestattet sein, bei denen es sich um Außenwände oder Innenschlangen handeln kann.
Für die Einführung von Substrat, Inokulum und Dampf oder anderen Sterilisationsmitteln sind Anschlüsse vorhanden. Probenahme- und Auslassöffnungen sind ebenfalls vorhanden.
Das Substrat wird in einem separaten Tank vorbereitet und der pH-Wert eingestellt. Die Mikronährstoffe können in diesen Tank oder direkt in den Fermenter gegeben werden. Das Substrat wird im diskontinuierlichen oder häufiger kontinuierlichen Betrieb sterilisiert.
Der Fermenter wird sterilisiert, mit Substrat beschickt und beimpft. Der eigentliche Fermentationsprozess verläuft in zwei Schritten. Ein kleiner Teil des Substrats wird zum Befüllen eines Saatfermenters verwendet, der typischerweise ein Zehntel des Volumens eines Hauptfermenters enthält.
Nach der Sterilisation und Abkühlung auf 25–35 °C werden Sporen von A. niger hinzugefügt. Die Sporen keimen und am ersten Tag der Operation beginnen sich Myzelpellets zu entwickeln. In der Zwischenzeit wird ein Hauptfermenter mit Substrat gefüllt, sterilisiert und abgekühlt.
Der Inhalt des Saatfermenters wird dann in den Hauptfermenter gepumpt, wo die Umwandlung der Kohlenhydrate sofort beginnt. Die Gärung im Hauptfermenter dauert je nach Substrat und Prozessbedingungen 3–7 Tage.
Nach Abschluss der Fermentation wird die Luftzufuhr gestoppt, um zu verhindern, dass die Mikroorganismen die Zitronensäure verbrauchen. Der Inhalt wird dann zu Rotationsvakuum- oder Bandpressfiltern gepumpt, um das Myzel von der Flüssigkeit zu trennen.
Wie beim Oberflächenfermentationsprozess wird das Myzel gewaschen und typischerweise als Futterzutat vermarktet.
Fast die gesamte Zitronensäure wird weltweit als kristallines Produkt verkauft. Um Zitronensäurekristalle in Lebensmittelqualität herzustellen, wird die Zitronensäure zunächst aus der Fermentationsbrühe isoliert und anschließend die rohe Zitronensäurelösung gereinigt. Abschließend wird die gereinigte Zitronensäurelösung kristallisiert und verpackt.
2. Chemische Reaktionen von Zitronensäure
Bei einer Temperatur von 175 °C wird Zitronensäure dehydriert, um Aconitsäure zu bilden, die weiter Kohlendioxid abgeben kann, um Itaconsäureanhydrid zu bilden. Letzteres kann sich zu Citraconsäureanhydrid umlagern oder unter Zugabe von Wasser Itaconsäure bilden.
Ebenso kann Citraconsäureanhydrid durch Zugabe von Wasser in Citraconsäure umgewandelt werden. Mesaconsäure, das trans-Isomer der Citraconsäure, kann durch Eindampfen einer Citraconsäurelösung in Gegenwart von Salpetersäure gewonnen werden.
Bei der Oxidation von Zitronensäure mit Kaliumpermanganat entsteht bei 35 °C 1,3-Acetondicarbonsäure, bei 85 °C entsteht Oxalsäure. Die Fusion von Zitronensäure mit Kaliumhydroxid ergibt eine Mischung aus Oxalsäure und Essigsäure.
Zitronensäure kann mit verschiedenen Kationen mono-, di- und tribasische Salze bilden, und der Hydratationsgrad dieser Salze kann variieren. Trinatriumcitrat kann beispielsweise mit 2 oder 5,5 Molekülen Wasser kristallisieren. Durch die Kombination verschiedener Metallkationen können komplexe Salze wie ZnNa3H(C6H5O7)2 und ZnNa4(C6H5O7)2 entstehen.
Zahlreiche Metalle können mit Zitronensäure stabile Komplexe bilden, wobei einige Komplexe, wie zum Beispiel Ferroammoniumcitrate, kristallisieren können.
Der aus Kupfer und Zitronensäure gebildete Komplex ähnelt dem Kupfer-Weinsäure-Komplex der Fehling-Lösung, und zur Untersuchung dieser Komplexe wurden verschiedene klassische Methoden eingesetzt.
Zitronensäure kann viele Metallionen in Lösung chelatisieren, indem sie Bindungen zwischen den Carboxyl- oder Hydroxylgruppen des Zitronensäuremoleküls und dem Metallion bildet.
Manchmal ist mehr als ein Zitronensäuremolekül an der Wechselwirkung mit dem Metallion beteiligt. Diese Eigenschaft ist nützlich, um Ausfällungen zu verhindern, das chemische Potenzial zu verändern und andere chemische Eigenschaften zu modifizieren.
Zitronensäure kann unter normalen Bedingungen in Gegenwart eines Katalysators wie Schwefelsäure, p-Toluolsulfonsäure oder eines sauren Ionenaustauscherharzes mit vielen Alkoholen verestert werden.
Auch eine katalysatorfreie Veresterung mit über 150 °C siedenden Alkoholen ist möglich. Beispielsweise können aus Benzylchlorid und Natriumcitrat Di- oder Tribenzylester entstehen, und Trimethyl-, Triethyl- und Tributylcitrat werden häufig als Weichmacher in Lebensmittelverpackungsmaterialien eingesetzt.
Polyester können durch Reaktion von Zitronensäure mit zweiwertigen Alkoholen, zweiwertigen Phenolen und mehrwertigen Alkoholen wie Mannit, Sorbit und Glycerin gebildet werden.
Die Veresterungsreaktion kann manchmal vorzeitig abgebrochen werden, sodass eine der Carbonsäureeinheiten frei bleibt und ein Salz bilden kann. Der resultierende Polyester kann in Wasser löslich sein.
Zitronensäure kann an der Hydroxylgruppe mit Säurechloriden und -anhydriden reagieren und Allylester der Zitronensäure bilden. Bis(zitronensäureester) können aus Dicarbonsäurechloriden gewonnen werden.
Epoxide, einschließlich Ethylenoxid, Propylenoxid und Styroloxid, können Polymere bilden, indem sie mit Zitronensäure oder ihren Estern an verfügbaren Hydroxyl- und Carboxylgruppen reagieren.
Zitronensäure kann mit Ammoniak, Aminen, Amiden und Carbamiden auf ähnliche Weise wie einfache Carbonsäuren reagieren. Aldehyde können auch Addukte mit Zitronensäure bilden, beispielsweise Anhydromethylenzitronensäure 5-Oxo-1,3-dioxolan-4,4-diessigsäure.
3. Verwendung von Zitronensäure
Zitronensäure und ihre Natrium- oder Kaliumsalze werden häufig in verschiedenen Lebensmitteln verwendet, darunter kohlensäurehaltige Getränke, trocken abgepackte Getränke, Fruchtgetränke, Marmeladen, Gelees und Obstkonserven.
Sie spielen auch eine entscheidende Rolle bei der Erhaltung der Farbe, des Geschmacks und des Vitamingehalts von frischem und gefrorenem Gemüse und Obst sowie bei der Herstellung von Pflanzenölen.
In pharmazeutischen Anwendungen wird Zitronensäure überwiegend als Antikoagulans in der Blutkonservierung und in Brausetabletten eingesetzt.
Zitronensäure wird aufgrund ihrer Chelatisierungsfähigkeit häufig in Reinigungsprozessen eingesetzt, insbesondere bei der Entfernung von Kesselsteinen und Wärmetauschern.
Zahlreiche industrielle Anwendungen von Zitronensäure profitieren von ihrer starken Sequestrierwirkung mit verschiedenen Übergangsmetallen wie Eisen, Kupfer, Nickel, Kobalt, Chrom und Mangan.
Zitronensäure wird üblicherweise als Waschmittelgerüststoff eingesetzt, insbesondere in flüssigen Formulierungen. Darüber hinaus können seine Lösungen Schwefeldioxid aus Gasen entfernen und Mikronährstoffe in Düngemitteln chelatisieren.
Zitronensäureester wie Trimethyl-, Triethyl- und Tributylcitrat werden als Weichmacher für Kunststoffbehälter in Lebensmittelqualität verwendet.
Referenz
- Citric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a07_103.pub3
