Produktionsmethoden aliphatischer Amine
Die Herstellung von Aminen umfasst unterschiedliche Methoden, die jeweils für bestimmte Rohstoffe und gewünschte Produkte geeignet sind. Aliphatische Amine werden aus Alkoholen, Carbonylverbindungen, Nitrilen, Alkylhalogeniden, Nitroverbindungen und Olefinen hergestellt.
Inhaltsverzeichnis
1. Herstellung von Aminen aus Alkoholen
Die am weitesten verbreitete Technik zur Synthese niederer Alkylamine beinhaltet die Reaktion zwischen einem geeigneten Alkohol und Ammoniak unter Verwendung eines geeigneten Katalysators. Diese Reaktion ergibt eine Mischung aus primären, sekundären und tertiären Aminen, da das zunächst gebildete primäre Amin die Fähigkeit besitzt, mit einem oder zwei Alkoholmolekülen weiter zu reagieren.
Während die Umwandlung von Alkohol in primäres Amin thermoneutrale Eigenschaften aufweist, erfolgt die Bildung sekundärer und tertiärer Amine exotherm, was die Thermodynamik begünstigt. Darüber hinaus weist das primäre Amin aufgrund seiner größeren Nukleophilie eine höhere Reaktivität als Ammoniak auf.
Die Verteilung der Produkte kann teilweise durch Anpassung der Reaktionsbedingungen wie Temperatur, Ammoniaküberschuss und Verweilzeit gesteuert werden. Da die erhaltene Aminmischung häufig nicht den Marktanforderungen entspricht, können nicht marktfähige Amine recycelt werden, wodurch die Ausbeute des gewünschten Amins auf über 90 % erhöht wird.
RCH2OH + NH3 ↔ RCH2NH2 + H2O
RCH2NH2 + RCH2OH ↔ (RCH2)2NH + H2O
(RCH2)2NH + RCH2OH ↔ (RCH2)3N + H2O
Bisher wurde diese Reaktion mit reinen Dehydratisierungskatalysatoren wie Aluminiumoxid, Siliciumoxid, Titanoxid, Thoriumoxid, Wolframoxid, Chromoxiden, Phosphaten oder verschiedenen Mischoxiden (z. B. Siliciumoxid-Aluminiumoxid, Tone, Zeolithe) bei Temperaturen bis zu 500 °C durchgeführt . Allerdings ist der Einsatz dieser Katalysatoren mittlerweile auf die Methylaminproduktion beschränkt.
Für die Umsetzung von Alkoholen mit zwei oder mehr Kohlenstoffatomen haben Katalysatoren mit hydrierenden und dehydrierenden Eigenschaften an Bedeutung gewonnen. In erster Linie werden Katalysatoren auf Nickel-, Kobalt-, Kupfer-, Eisen-, Platin- oder Palladiumbasis eingesetzt, wobei Edelmetallkatalysatoren dazu neigen, C-C- oder C-N-Bindungsspaltungen zu verursachen, was zu geringeren Selektivitäten führt. Zur Verbesserung der Katalysatorleistung werden Promotoren wie Ag, Zn, In, Mn, Mo und Alkalimetalle zugesetzt.
Typischerweise werden die aktiven Komponenten auf Trägern wie Al2O3, SiO2 oder ZrO2 getragen. Zur Verbesserung der Selektivität gegenüber primären Aminen wurden Zeolithe als Träger vorgeschlagen. Bei diesem kontinuierlichen Verfahren werden Alkohol, Ammoniak und Wasserstoff in einem Festbettreaktor über den Katalysator geleitet.
Die Reaktion findet bei Drücken von etwa 0,5–25 MPa und Temperaturen von etwa 100–250 °C statt, abhängig vom Katalysator und der Wahl zwischen Flüssigphasen- und Gasphasenprozessen.
Der erste und geschwindigkeitsbestimmende Schritt ist die Dehydrierung des Alkohols zur Carbonylverbindung. Die anschließende Zugabe von Ammoniak führt zum Wasserverlust und zur Bildung eines Imins oder Enamins, das dann zum endgültigen Amin hydriert wird.
Zu den Nebenreaktionen gehören die Disproportionierung von Aminen, insbesondere bei höheren Reaktionstemperaturen, und in geringerem Maße die Aldolkondensation intermediärer Aldehyde, die Bildung einer Schiffschen Base zwischen diesen Aldehyden und dem Aminprodukt sowie die Nitrilbildung bei hohen Temperaturen und niedrigen Wasserstoffdrücken.
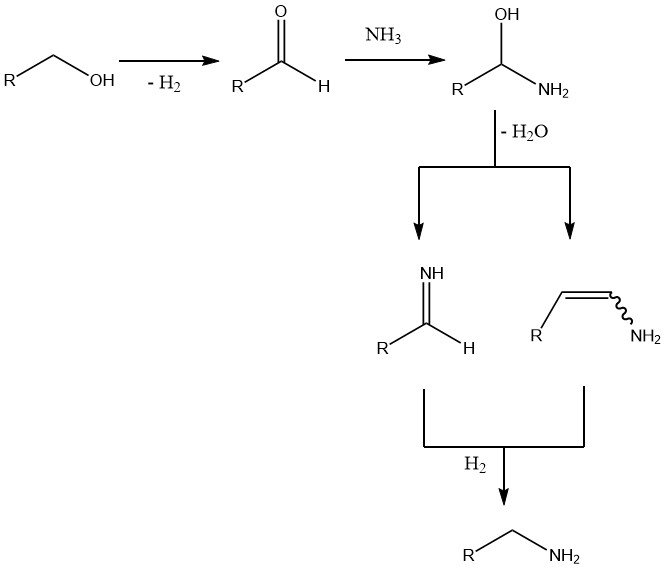
Um das Gleichgewicht in Richtung der primären Amine zu verschieben, wird ein Überschuss der zwei- bis achtfachen Menge Ammoniak eingesetzt. Während Wasserstoff nicht direkt an der Reaktion beteiligt ist, führt seine Abwesenheit zur Bildung von Iminen, Enaminen und sogar Nitrilen.
Darüber hinaus trägt Wasserstoff zur Aufrechterhaltung der Katalysatoraktivität bei, indem er kohlenstoffhaltige Ablagerungen und Metallcarbide oder -nitride entfernt und eine Disproportionierung der Aminprodukte verhindert.
Die Aminierung von Diolen und Polyolen folgt ähnlichen Prinzipien wie Monoalkohole, allerdings erschwert das Auftreten von Nebenreaktionen wie Cyclisierungen den Prozess.
Die gleiche Methode kann zur Alkylierung primärer oder sekundärer Amine anstelle von Ammoniak eingesetzt werden. Wenn ein Amin und ein Alkohol mit unterschiedlichen aliphatischen Substituenten reagieren, entsteht ein gemischtes aliphatisches Amin. Beispielsweise kann N,N-Dimethylethylamin aus Dimethylamin und Ethanol synthetisiert werden.
Um bei solchen Reaktionen eine Transalkylierung am Stickstoffatom zu verhindern, werden Kupferkatalysatoren empfohlen. Insbesondere Kupferchromit ist ein wirksamer Katalysator für langkettige tertiäre Amine wie Dimethyldodecylamin.
2. Herstellung von Aminen aus Carbonylverbindungen
Wenn es kostengünstiger ist, werden Aldehyde und Ketone für die Aminsynthese gegenüber Alkoholen bevorzugt. Dies beschränkt sich jedoch im Allgemeinen auf niedere Aldehyde, die aus der Oxosynthese gewonnen werden, und auf Aceton, das als Nebenprodukt bei der Phenol produktion (Hock-Synthese) entsteht.
Die Reaktion zwischen einer Carbonylverbindung und Ammoniak oder einem Amin erfolgt in zwei Schritten. Dabei entsteht zunächst ein Imin bzw. eine Schiffsche Base, die in einem zweiten Schritt mit Wasserstoff zum Amin hydriert wird. Das typische Verfahren ähnelt der Alkoholumwandlung, bei der die Reaktionsmischung, die die Carbonylverbindung, Ammoniak und Wasserstoff enthält, über einen Festbettkatalysator geleitet wird.
In manchen Fällen kann es vorteilhaft sein, die Reaktion in zwei Stufen durchzuführen. Zuerst reagieren die Carbonylverbindung und Ammoniak oder Amin, das entstehende Wasser wird entfernt und dann wird der Hydrierungsschritt durchgeführt.
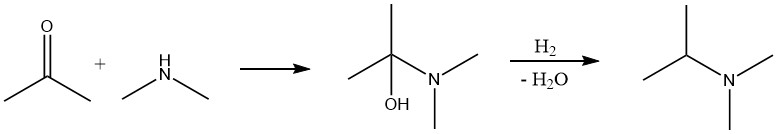
Der wesentliche Unterschied zwischen der Aminierung eines Aldehyds oder Ketons und eines Alkohols besteht darin, dass Wasserstoff als Reaktant fungiert und im ersteren Fall in stöchiometrischer Menge verbraucht wird.
Aufgrund der erheblich höheren Reaktionswärme bei diesem Verfahren (z. B. 60,4 kJ/mol für Aceton im Vergleich zu 7,1 kJ/mol für Isopropylalkohol) ist ein anderes Reaktordesign erforderlich.
Typischerweise wird der Prozess in der Dampfphase bei Temperaturen von 100–160 °C und Atmosphärendruck oder leicht über Atmosphärendruck durchgeführt. Auch Hochdruckverfahren können eingesetzt werden, wenn die Reaktionswärme effektiv abgeführt wird, etwa durch eine hohe Rückführungsrate oder den Einsatz eines Rohrbündelreaktors. Niedrigere Reaktionstemperaturen im Vergleich zu Alkoholreaktionen ermöglichen im Allgemeinen grundsätzlich höhere Selektivitäten.
Im Allgemeinen können die gleichen Katalysatoren verwendet werden, die auch für die hydrierende Aminierung von Alkoholen verwendet werden. Auch die Steuerung der Produktverteilung durch Einstellung des überschüssigen Ammoniaks und die destillative Aufarbeitung sind ähnlich. Detaillierte Übersichten über industrielle und präparative Möglichkeiten zur Synthese von Aminen aus Carbonylverbindungen sind verfügbar.
Obwohl alternative Reduktionsmittel anstelle von Wasserstoff verwendet werden können, ist ihre industrielle Bedeutung aufgrund der Herausforderungen bei der Handhabung und ihrer Kosten begrenzt (z. B. Selenophenol oder NaBH4).
Die Leuckart-Wallach-Reaktion, bei der Ammoniumformiat zur Aminierung der Carbonylverbindung unter Bildung von CO2 als Nebenprodukt eingesetzt wird, hat einige Anwendung gefunden.
3. Herstellung von Aminen aus Nitrilen
In vielen Fällen sind Nitrile kostengünstiger zu erhalten als die entsprechenden Alkohole oder Carbonylverbindungen. Es gibt verschiedene Methoden zur Synthese von Nitrilen, darunter Ammoxidation, Addition eines Amins oder Alkohols an Acrylnitril oder Umwandlung aus der entsprechenden Carbonsäure.
Um Nitrile in die entsprechenden Amine umzuwandeln, wird die katalytische Hydrierung bevorzugt. Üblicherweise werden Edelmetallkatalysatoren wie Palladium, Platin und Rhodium sowie Nickel-, Kobalt- und zunehmend auch Eisenkatalysatoren eingesetzt.
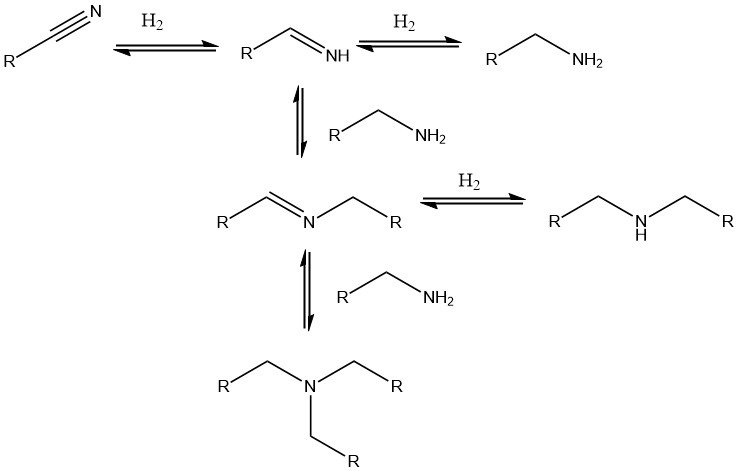
Geträgerte Edelmetallkatalysatoren ermöglichen mildere Reaktionsbedingungen (20–100 °C, 0,1–0,5 MPa), während Nickel- oder Kobaltkatalysatoren höhere Drücke von bis zu 25 MPa und Temperaturen bis zu 180 °C erfordern. Wenn Di- oder Polynitrile zu Di- oder Polyaminen hydriert werden, wird dem Katalysator häufig eine Base wie NaOH zugesetzt.
Es gibt verschiedene Varianten des Verfahrens, am häufigsten werden jedoch das Batch-Verfahren mit suspendiertem Katalysator und das kontinuierliche Verfahren mit Festbettkatalysator eingesetzt.
Nebenreaktionen, die zur Bildung sekundärer Amine führen, sind unvermeidlich, können jedoch durch Zugabe von Ammoniak, Natronlauge oder einer Säure unterdrückt werden.
Alternativ können die Prozessbedingungen so angepasst werden, dass die Bildung sekundärer oder tertiärer Amine Vorrang hat. Dieser Ansatz ist beispielsweise bei der Synthese von Di- und Triethylamin aus Acetonitril oder Dibutylamin aus Butyronitril nützlich.
Ein Sonderfall ist die Hydrierung von Acrylnitril. Während gesättigte Amine typischerweise die einzigen Produkte dieser Reaktion sind, führt die Verwendung von Kupferchromit als Katalysator anstelle von Edelmetallen, Nickel oder Kobalt zur Bildung von Allylamin und Diallylamin.
Viele bedeutende Nitrilhydrierungen zur Herstellung der entsprechenden Amine basieren auf früheren Additionsreaktionen mit Acrylnitril. Alkohole können sich nur in Gegenwart eines basischen Katalysators wie NaOH, KOH oder quartären Ammoniumhydroxiden an Acrylnitril addieren.
Da Amine selbst ausreichend basisch sind, erfolgt die Addition leicht. In einigen Fällen können für die Cyanoethylierung höhere Temperaturen erforderlich sein, und es wurden Stabilisatoren beschrieben, die die Polymerisation von Acrylnitril verhindern sollen.
4. Synthese von Aminen aus Alkylhalogeniden
Wenn ein Alkylhalogenid mit Ammoniak oder einem Amin reagiert, entsteht ein Alkylammoniumhalogenid, das durch Behandlung mit einer starken alkalischen Lösung in das Amin umgewandelt werden kann. Obwohl diese Methode häufig in der präparativen Chemie eingesetzt wird, hat sie nur begrenzte industrielle Bedeutung und wird hauptsächlich für die Herstellung von Ethylendiamin, Polyaminen und einigen speziellen Aminen wie Allylamin sowie bestimmten Pharmazeutika mit geringen Produktionsmengen eingesetzt.
Die Gründe für die begrenzte Nutzung im industriellen Maßstab sind die hohen Kosten der Ausgangsmaterialien, Herausforderungen im Zusammenhang mit Korrosion und Produktqualität bei der Halogenidverarbeitung sowie die Notwendigkeit der Entsorgung des entstehenden Salznebenprodukts.
5. Synthese von Aminen aus Nitroverbindungen
Während die Reduktion von Nitroverbindungen eine wichtige Methode zur Synthese aromatischer Amine darstellt, hat sie bei der Herstellung aliphatischer Amine keine nennenswerte Bedeutung erlangt. Aufgrund der begrenzten Verfügbarkeit geeigneter Nitroalkane wird diese Methode nur in bestimmten Fällen eingesetzt, beispielsweise bei der Herstellung von 2-Amino-2-methyl-1-propanol, das bei der Formulierung von Pufferlösungen, Latexbeschichtungen, Metallbearbeitungsflüssigkeiten und Kosmetika verwendet wird.
Der Reduktionsprozess umfasst die Bildung eines Nitroso- oder Hydroxylamin-Zwischenprodukts und kann in einigen Fällen bei Raumtemperatur erfolgen, wodurch Aminprodukte mit einer Ausbeute von 90 % oder mehr entstehen. Zum Einsatz kommen Hydrierungskatalysatoren wie Platin, Palladium, Rhodium, Nickel oder Kupfer.
Die Reaktion ist stark exotherm (ungefähr 500 kJ/mol pro Nitrogruppe), was eine effiziente Wärmeabfuhr zur Prozesskontrolle erfordert. Nitroparaffine stellen im Vergleich zu ihren aromatischen Gegenstücken größere Herausforderungen bei der Hydrierung dar.
Es wurde über die Funktionalisierung von Alkenen mit NO oder NO2 berichtet, die über einen radikalischen Mechanismus abläuft und zu einer Mischung von Produkten, einschließlich Nitroalkenen, führt. Allerdings hat die Reduktion von Nitroalkenen zu Aminen bisher keine industrielle Anwendung gefunden. In ähnlicher Weise wurden primäre Amine aus Paraffinen durch Nitrierung mit HNO3 oder flüssigem NO2 und anschließende Hydrierung der resultierenden Mischung aus Nitroparaffinen und Ketonen in Gegenwart von Ammoniak gewonnen.
6. Herstellung von Aminen aus Olefinen
Amine, die neben dem Stickstoffatom eine tertiäre Alkylgruppe haben, wie etwa tert-Butylamin, sind mit herkömmlichen Methoden schwer zu synthetisieren. Diese Verbindungen können jedoch leicht hergestellt werden, indem Cyanwasserstoff in einem sauren Medium an ein Alken wie 2-Methylpropen addiert wird.
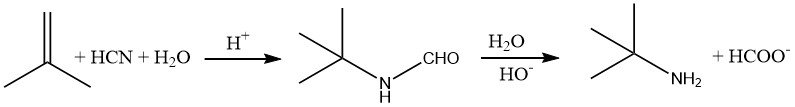
Diese als Ritter-Reaktion bekannte Reaktion wird typischerweise bei Temperaturen von 30–60 °C durchgeführt. Das resultierende Formamid-Zwischenprodukt wird dann durch Erhitzen der Reaktionsmischung auf etwa 100 °C hydrolysiert.
Um das Amin zu isolieren, wird die saure Mischung neutralisiert, wodurch Natriumformiat und das Salz der ursprünglichen Säure (z. B. Natriumsulfat) entstehen.
Aufgrund der Schwierigkeiten beim Umgang mit Blausäure, die ätzend ist und Sicherheitsbedenken aufwirft, geht bei der Reaktion ein Kohlenstoffatom als Formiat verloren und eine erhebliche Menge Salz (ca. 3,3 kg/kg tert-Butylamin) muss entsorgt werden tiefe Brunnen. Dadurch ist dieses Verfahren auf die Synthese von Aminen beschränkt, die mit anderen Methoden nicht gewonnen werden können.
Obwohl die direkte Addition von Ammoniak oder einem Amin an eine olefinische Doppelbindung thermodynamisch günstig ist, ist sie auf einige spezielle Fälle beschränkt, in denen es um aktivierte Amine oder Verbindungen mit aktivierten Doppelbindungen geht. Ein Beispiel ist die Addition eines Amins an Acrylnitril.
Es ist jedoch möglich, die Addition von Ammoniak an nicht aktivierte Alkene unter Druck mithilfe von Katalysatoren zu erreichen. Saure Zeolithe sind besonders wirksame Katalysatoren für diese Reaktion. Der erste erfolgreiche Nachweis war die Bildung von Ethylamin aus Ethylen und Ammoniak unter Verwendung von H-Mordenit.
Obwohl der Umsatz bei der direkten Aminierung von Alkenen aufgrund kinetischer und thermodynamischer Einschränkungen typischerweise gering ist, kann die Selektivität für Monoalkylamine bei geeigneter Auswahl von Zeolith und Alken hervorragend sein.
Kleinporige Zeolithe eignen sich gut für die Herstellung von Ethylaminen, während mittelporige Zeolithe für die Tert-Butylamin-Synthese verwendet werden können. Bestimmte großporige Zeolithe haben gegenüber mittelporigen Zeolithen Verbesserungen gezeigt.
Hohe Selektivitäten (>95 %) mit akzeptablen Umsätzen (10–15 %) wurden bei der Aminierung von Isobuten an RE-Y-Zeolithen und Al-, Fe- oder B-substituierten Zeolithen vom Pentasil-Typ bei Temperaturen von 250–150 °C erzielt. 300 °C und Drücke um 30 MPa. Diese Zeolithe weisen im Vergleich zu X- und Y-Zeolithen eine hervorragende Langzeitstabilität auf.
Die homogen katalysierte Aminierung von Alkenen ist auf bestimmte Fälle beschränkt. Obwohl die Hydroformylierung von Alkenen in Gegenwart von Ammoniak oder Aminen nicht sehr selektiv ist, zeigt sie Potenzial für zukünftige Anwendungen.
Allerdings steht diese Methode derzeit vor Herausforderungen, da neben den gewünschten, von n-Aldehyd und Isoaldehyd abgeleiteten Aminen auch erhebliche Mengen an Alkoholen und Dimerisierungsprodukten entstehen.
7. Andere Prozesse
Die Hydrierung aromatischer Amine zu Cycloalkylaminen beschränkt sich in erster Linie auf die Herstellung von Cyclohexylamin im industriellen Maßstab. Andere Cycloalkylamine werden auf industrieller Ebene üblicherweise nicht mit dieser Methode synthetisiert.
Es wurde ein Verfahren zur Synthese von Aminen aus Kohlenmonoxid, Wasserstoff und Ammoniak oder Aminen unter Verwendung eines aktivierten Eisenkatalysators auf Basis der Fischer-Tropsch-Reaktion beschrieben. Allerdings findet diese Methode im industriellen Maßstab keine breite Anwendung.
Die Reduktion von Amiden und andere in der Literatur erwähnte Synthesewege sind zwar vorhanden, aber hauptsächlich Labormethoden, die für Herstellungen im kleinen Maßstab geeignet sind. Auf industrieller Ebene werden diese Methoden nur selten eingesetzt und nur in Einzelfällen umgesetzt.
Referenz
- Amines, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
