Malonsäuredinitril: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist Malonsäuredinitril?
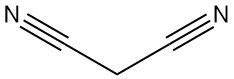
Malononitril, auch bekannt als Propandinitril, Malonsäuredinitril oder Dicyanomethan, ist eine organische Verbindung mit der chemischen Formel C3H2N2. Es ist ein farbloser oder weißer Feststoff, der ein wertvoller Baustein ist, der häufig in der organischen Synthese verwendet wird.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Malonsäuredinitril
Malonsäuredinitril bildet farblose Kristalle, die in polaren Lösungsmitteln wie Wasser, niederen Alkoholen, Acetonitril und Diethylether löslich sind, aber in unpolaren Lösungsmitteln wie Tetrachlormethan, Petrolether und Xylol unlöslich sind.
Längere Lagerung kann zu Farbveränderungen führen, die die Kristalle von farblos zu gelb oder sogar dunkelbraun verwandeln, ohne ihre Qualität zu beeinträchtigen.
Malonsäuredinitril ist bei Einnahme giftig und kann schwere Haut- und Augenreizungen verursachen.
Die physikalischen Eigenschaften von Malonsäuredinitril sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Registriernummer | [109-77-3] |
| Molekularformel | C3H2N2 |
| Molekularmasse | 66,06 g/mol |
| Schmelzpunkt | 31,6 °C |
| Siedepunkt | 218 – 219 °C |
| Dichte (20 °C) | 1,19 g/mL |
| Brechungsindex (34 °C) | 1,4146 |
| Dipolmoment (25 °C) | 3,57 D |
| pKa | 11,2 |
| Dampfdichte | 2,3 |
| Dampfdruck | 0,2 mmHg |
| Flammpunkt | > 86 °C |
| Löslichkeit (20 °C) | |
| Wasser | 133 g/L |
| Diethylether | 200 g/L |
| Ethanol | 400 g/L |
2. Chemische Reaktionen von Malonsäuredinitril
Malonsäuredinitril weist aufgrund der Nukleophilie des Malonsäuredinitril-Anions, das durch Deprotonierung mit einer schwachen Base erhalten werden kann, und der elektrophilen Natur seiner Cyanogruppen eine vielseitige Reaktivität auf.
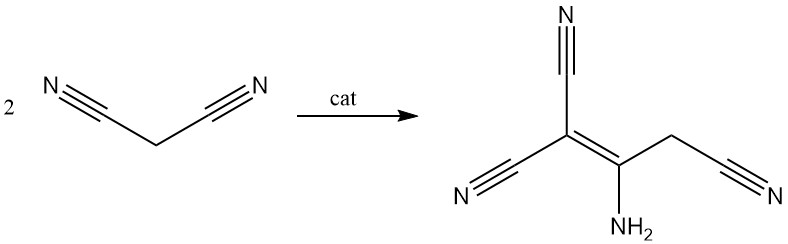
Malonsäuredinitril wird in Gegenwart einer Base dimerisiert, wodurch 2-Amino-1,1,3-tricyano-2-propen entsteht.
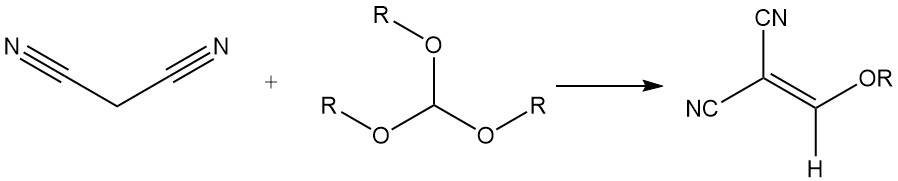
Es reagiert mit Trialkylorthoformiaten zu Alkoxymethylenmalonitrilen, die zur Synthese von Styrylfarbstoffen verwendet werden.
Die Dialkylierung von Malonsäuredinitril mit Alkylhalogeniden und die Acylierung mit Säurechloriden/-anhydriden ist möglich.
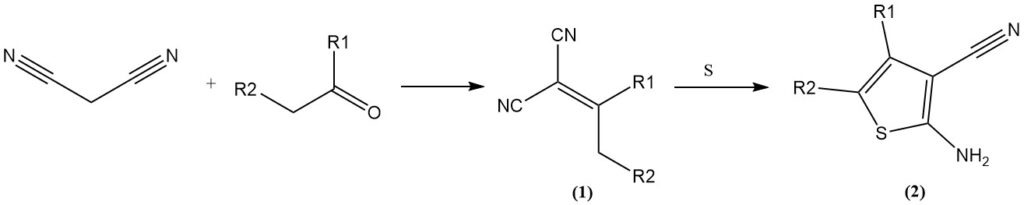
Die Knoevenagel-Kondensation mit Aldehyden/Ketonen ergibt Ylidenmalonsäuredinitrile (1), die weitere Reaktionen eingehen können. Beispiele hierfür sind die Reaktion mit elementarem Schwefel (Gewald-Reaktion) zu 3-Cyano-2-amino-thiophenen (2) oder die Cycloaddition mit Aziden zu Tetrazolen.
Malonsäuredinitril reagiert mit Brom zu mono- oder dibromierten Derivaten. Die thermische Zersetzung des Dibromidkomplexes ergibt Tetracyanethylen.
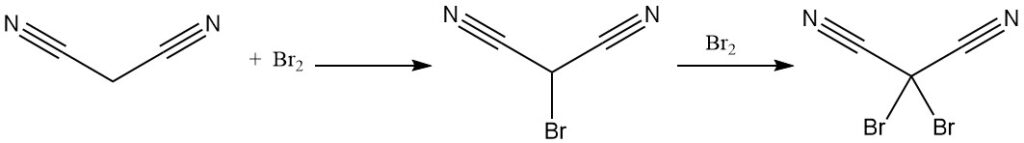
Die Reaktion von Dibrommalonitril mit Kaliumcyanid ergibt das Kaliumsalz von Tricyanomethan, das ebenfalls aus Malonsäuredinitril und Cyanogenchlorid hergestellt wird. Tricyanomethan wird bei der Synthese ionischer Flüssigkeiten verwendet.
Die Reaktion von Malonsäuredinitril mit Kohlenstoffdisulfid in Gegenwart einer Base erzeugt Salze von (Dimercaptomethylen)malonitril, einem Vorläufer für antimikrobielle Mittel. Durch Dimethylierung entsteht ein weiterer wichtiger Baustein für Heterocyclen.
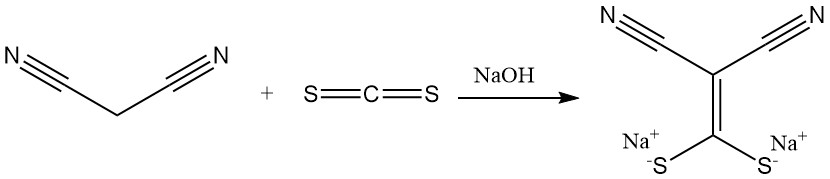
Cyanothioacetamid wird durch Reaktion mit Schwefelwasserstoff hergestellt.
Säurekatalysierte Reaktionen von Malonsäuredinitril mit Alkoholen erzeugen Imidate (3), die Ausgangsstoffe für Stickstoff-Heterocyclen wie 4,6-Dimethoxypyrimidine (4) oder Bis(oxazoline) (5) sind.
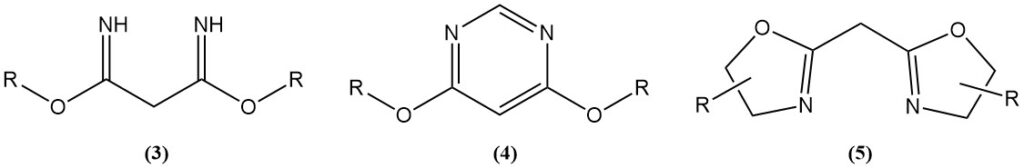
Bis(oxazoline) werden durch Ritter-artige Reaktionen oder durch Verwendung eines Katalysators hergestellt. Aus Malonsäuredinitril oder seinen Derivaten und chiralen Aminoalkoholen synthetisierte Bis(oxazoline) werden als Liganden in asymmetrischen Übergangsmetall-katalysierten Reaktionen verwendet.
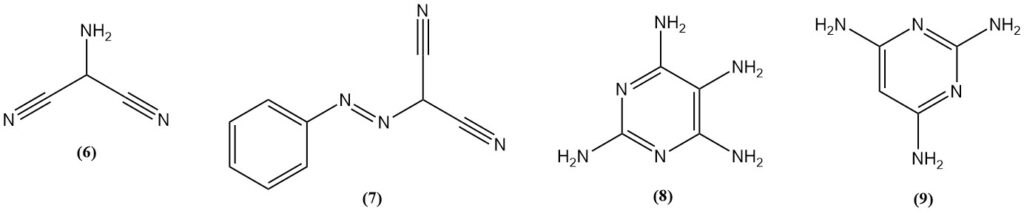
2-Aminomalononitril (6) wird durch Nitrosierung von Malonsäuredinitril, gefolgt von Hydrierung oder durch Reduktion von (Phenylazo)malononitril (7) erhalten. Aminomalononitril reagiert mit Guanidin zu 2,4,5,6-Tetraaminopyrimidin (8).
2,4,6-Triaminopyrimidin (9) kann durch die Reaktion von Malonsäuredinitril und Guanidin hergestellt werden, während 2,4,6-Triaminopyrimidin aus Formamidin hergestellt wird.
3. Herstellung von Malonsäuredinitril
Bis in die 1970er Jahre wurde Malonsäuredinitril in einem Batch-Verfahren durch Dehydratisierung von Cyanacetamid unter Verwendung von Phosphorpentachlorid oder Phosphoroxychlorid hergestellt. Dieses Verfahren ist zwar erst kürzlich durch Patente dokumentiert, wird aber außer in einigen kleinen chinesischen Anlagen nicht mehr kommerziell eingesetzt.
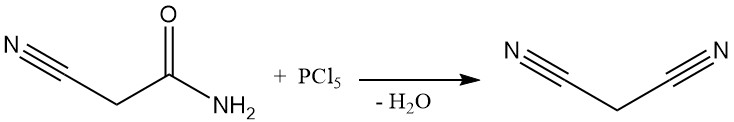
Die heute vorherrschende industrielle Methode zur Synthese von Malonsäuredinitril ist eine kontinuierliche Hochtemperaturreaktion zwischen Acetonitril und Chlorcyan. Bei diesem Verfahren wird ein Rohrreaktor verwendet, der bei über 700 °C betrieben wird und in einem einzigen Durchgang eine nahezu vollständige Umwandlung erreicht, wodurch Malononitril entsteht.
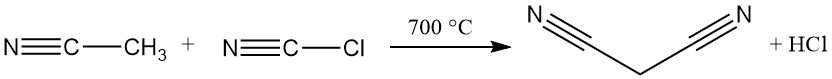
Überschüssiges Acetonitril, Salzsäure und Spuren von Maleinsäure, Bernsteinsäure und Fumarsäure sind als Verunreinigungen im gewünschten Produkt vorhanden.
Das aus dem Reaktor austretende Produkt wird schnell abgekühlt, um die Reaktion zu stoppen und gasförmigen Chlorwasserstoff abzutrennen, der dann durch Waschen zurückgewonnen wird. Überschüssiges Acetonitril wird durch eine Kombination aus Vakuumdestillation und Dünnschichtverdampfung entfernt, was ein Recycling mit minimaler Verunreinigung ermöglicht.
Die Trennung von Maleinsäure und Fumarsäure vom Rohmalononitril ist aufgrund ihrer ähnlichen Siedepunkte unpraktisch. Daher werden diese Verunreinigungen durch eine Diels-Alder-Reaktion in einem separaten Reaktor in höhersiedende Verbindungen umgewandelt. Schließlich werden diese Nebenprodukte durch zwei Vakuumdestillationen entfernt, was zu einer Ausbeute von 66 % Malonsäuredinitril auf der Grundlage beider Ausgangsstoffe führt.
Die erste Industrieanlage mit diesem Verfahren wurde 1973 von Lonza in Visp, Schweiz, betrieben.
Obwohl alternative Methoden zur Herstellung von Malonsäuredinitril vorgeschlagen wurden, wie etwa solche mit Cyanacetaten, Malonaten oder Reaktionen mit Ammoniak und verschiedenen Katalysatoren, wird derzeit keine dieser Methoden im industriellen Maßstab eingesetzt.
4. Verwendung von Malonsäuredinitril
Malonsäuredinitril wird häufig als Rohstoff bei der Herstellung von Vitaminen, Agrochemikalien, Arzneimitteln und Farbstoffen verwendet.
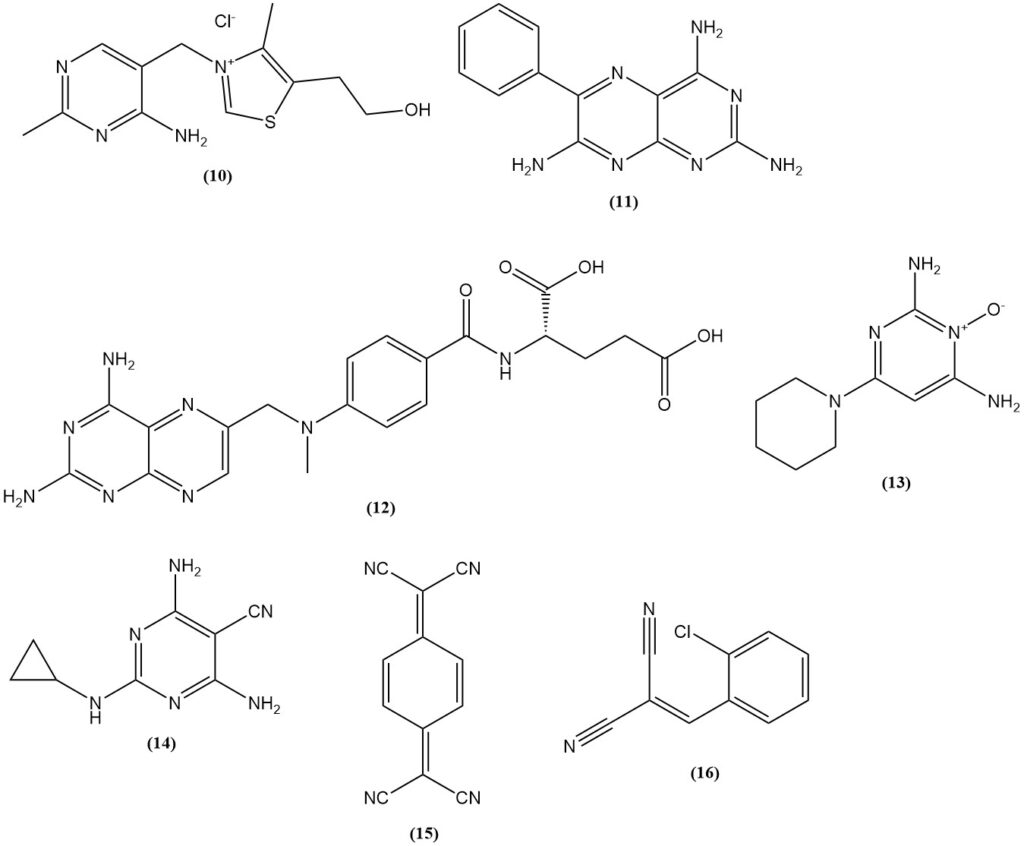
Malonsäuredinitril wird bei der Synthese von Thiamin (10) (Vitamin B1), Sulfonylharnstoff-Herbiziden auf Basis von 2-Amino-4,6-dimethoxypyrimidin wie Benzsulfuron-methyl und Halosulfuron-methyl sowie Pharmazeutika (das Diuretikum Triamteren (11), der Folsäureantagonist Methotrexat (12), das Antihypertensivum Minoxidil (13) und das Pestizid Dicyclanil (14)) verwendet.
Beispiele für aus Malonsäuredinitril hergestellte Farbstoffe und Pigmente sind gelbe Methinfarbstoffe mit einer N,N-Dialkylaminoarylgruppe (Aminoarylneutrocyanine) wie C.I. Disperse Yellow 90; blaue Aminoarylneutrocyaninfarbstoffe wie C.I. Disperse Blue 354; und 1,4,5,8-Naphthalintetracarbonsäure, die ein Vorläufer für Perinonpigmente ist.
Es wird auch bei der Herstellung von elektrischen Leitern wie Ladungstransfersalzen von 7,7,8,8-Tetracyanochinodimethan (15) (TCNQ) und dem Tränengas (o-Chlorbenzyliden)malonitril (16) verwendet, das aus der Kondensation von o-Chlorbenzaldehyd mit Malonsäuredinitril hergestellt werden kann.
5. Toxikologie von Malonsäuredinitril
Malonsäuredinitril kann bei Kaninchen bei Exposition gegenüber 5 mg für 24 Stunden schwere Augenreizungen verursachen.
Malonsäuredinitril ist auf verschiedenen Wegen hochgiftig, mit oralen LD50-Werten im Bereich von 14 mg/kg bis 69,8 mg/kg bei Ratten. Zu den häufigsten Auswirkungen zählen Krämpfe, Muskelschwäche, Atemdepression und Verhaltensänderungen.
Hautkontakt mit Malononitril kann bei Ratten in Dosen von 350 mg/kg ebenfalls tödlich sein. Die verfügbaren Daten deuten auf mögliche Auswirkungen auf verschiedene Organe hin, darunter Lunge, Blut und Nervensystem.
Wiederholte orale Exposition bei Ratten in niedrigeren Dosen (285 mg/kg/19 Wochen) kann zu Leber- und Gewichtsveränderungen führen.
Es gibt Arbeitsplatzgrenzwerte, um die Luftkonzentration von Malonsäuredinitril am Arbeitsplatz zu regulieren (z. B. empfohlener Expositionswert des NIOSH: 3 ppm).
Referenzen
- Malonic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a16_063.pub2
- https://pubchem.ncbi.nlm.nih.gov/compound/Malononitrile
- https://www.cdc.gov/niosh-rtecs/OO3010B0.html
