Hydrazin: Eigenschaften, Reaktionen und Verwendungen

Im Jahr 1875 machte EMIL FISCHER eine Vorhersage über das Vorhandensein von Hydrazin H2N–NH2;. Im Jahr 1887 gelang es CURTIUS, es zu isolieren. Dann, im Jahr 1893, gelang es DE BRUYN, wasserfreies Hydrazin zu isolieren.
RASCHIG erfand 1907 das erste kommerzielle Produktionsverfahren, das noch heute in Japan, Russland, China und Korea angewendet wird.
Der umfassende Einsatz von Hydrazin und seinen Derivaten als Treibmittel für Kunststoffschäume führte zur Entstehung verschiedener industrieller Anwendungen wie Kesselwasseraufbereitung, Polymerisationsinitiatoren, Pestizide, Pharmazeutika, Fotochemikalien und Farbstoffe.
Auch nach einem Jahrhundert seiner Entdeckung bleibt die Synthese von Hydrazin vor allem aufgrund thermodynamischer Einschränkungen eine Herausforderung. Der Großteil des Hydrazins wird mithilfe modifizierter Versionen des Raschig-Verfahrens hergestellt, bei dem Ammoniak durch Hypochlorit oxidiert wird.
Dennoch nutzen neuere Anlagen, die seit 1980 gebaut wurden, das PCUK-Verfahren, bei dem Wasserstoffperoxid als Oxidationsmittel verwendet wird.
Hydrazin wird überwiegend in Form einer wässrigen Lösung mit einer Konzentration von bis zu 64 % verkauft, was dem Hydrazinhydrat N2H4·H2O entspricht.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Hydrazin
Hydrazin ist eine farblose Flüssigkeit mit einem ammoniakartigen Geruch. Es ist vollständig mit Wasser mischbar und bildet stark alkalische wässrige Lösungen.
Insbesondere erreichen bestimmte Eigenschaften wie Viskosität und Dichte ihre Maximalwerte, wenn die Zusammensetzung 64 % beträgt, was auf das Vorhandensein der Monohydratform N2H4·H2O sowohl in der festen als auch in der flüssigen Phase hinweist.
Hydrazin bildet mit Wasser ein Azeotrop (Siedepunkt 120,5 °C), wobei das azeotrope Gemisch 58,5 Mol-% Hydrazin enthält.
Hydrazin ist eine endotherme Verbindung mit einer Bildungswärme von +50,6 kJ/mol. Seine Explosionsgrenzen in Luft liegen zwischen 4,7 % und 100 %. Die Obergrenze gibt an, dass wasserfreies Hydrazin zur Selbstexplosion fähig ist.
Allerdings schränkt die Verdünnung mit einem Inertgas wie Stickstoff oder Wasser den Zündbereich erheblich ein, indem die untere Explosionsgrenze erhöht wird. Folglich kann Hydrazinhydrat (mit 30,9 Vol.-% Hydrazin) bei Atmosphärendruck und 120 °C unter Ausschluss von Luft sicher gehandhabt werden.
Nachfolgend finden Sie einen Überblick über bestimmte physikalische Eigenschaften von Hydrazin:
- Molmasse = 32,05 g/mol
- Schmelzpunkt = 2 °C
- Siedepunkt = 113,5 °C
- Dichte = 1,0045 g/ml
- Brechungsindex = 1,4644 bei 25 °C
- Viskosität = 0,974 μPa.s
- pH-Wert (bei 65 %iger Wasserlösung) = 12,75
2. Chemische Reaktionen von Hydrazin
Die chemischen Eigenschaften von Hydrazin werden stark von den folgenden Eigenschaften beeinflusst: seiner endothermen Natur, seiner Alkalität und seinen starken Reduktionsmitteleigenschaften.
2.1. Thermische Zersetzung
Eine signifikante Zersetzung von Hydrazin erfordert eine relativ hohe Temperatur (250 °C) in Abwesenheit von Katalysatoren. Allerdings senkt die Anwesenheit bestimmter Katalysatoren wie Kupfer, Kobalt, Molybdän und deren Oxide die Zersetzungstemperatur. Daher ist ein vorsichtiger Umgang mit Hydrazin erforderlich.
2.2. Säure-Base-Reaktionen
Hydrazin wirkt als schwache Base und reagiert mit Wasser:

2.3. Reduktionsmittel
Hydrazin weist starke reduzierende Eigenschaften auf und reagiert exotherm mit Sauerstoff:
Viele Anwendungen von Hydrazin basieren auf dieser Reaktion. Die Oxidation von Hydrazin durch Luft in alkalischen Lösungen wird durch mehrere Metalle katalysiert. Daher sollten Hydrazinlösungen in Abwesenheit oder Desaktivierung von Kupfer, mehrwertigen Metallen oder deren Salzen destilliert werden. Die Oxide von Cadmium, Magnesium, Zink und Aluminium sorgen für eine Stabilisierung gegen Luftoxidation in Hydrazinlösungen.
In sauren Lösungen reagiert Hydrazin mit Halogenen:

Diese Reaktionen finden Anwendung bei der Bestimmung von N2H4 (mit Jod), der Reinigung roher Halogenwasserstoffe und der Entfernung von Spurenmengen an Halogenen im Abwasser. Das gleiche Verfahren kann zur Entfernung von Spuren von Hydrazin selbst angewendet werden. Natriumhypochlorit oder Wasserstoffperoxid in Gegenwart von Eisen(III)- oder Kupfer(II)-Salzen sind praktische Optionen für die Abfall- oder Verschüttungsbehandlung.
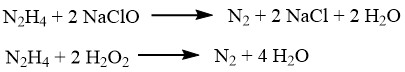
Hydrazin kann verschiedene Metallionen oder -oxide wie Kupfer, Silber, Gold, Quecksilber, Nickel und Platin reduzieren und sie in pulverförmige Metalle umwandeln.
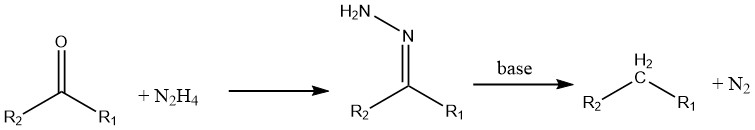
Ketone und Aldehyde werden in Gegenwart von Hydrazin reduziert (bekannt als Wolff-Kishner-Reaktion).
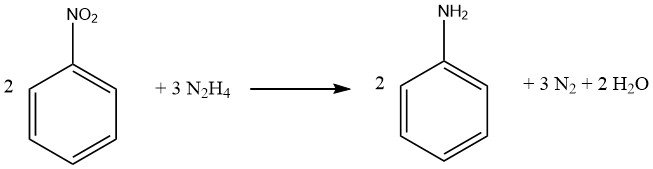
Aromatische Nitroverbindungen können mit Hydrazin und einem Hydrierungskatalysator wie Raney-Nickel zu ihren entsprechenden Aminen reduziert werden.
Hydrazin wird in Gegenwart von Wasserstoffperoxid zu Diimid oxidiert. Diimid reduziert dann Acetylene zu cis-Alkenen und hydriert verbleibende Doppelbindungen im Acrylnitril–Butadien-Kautschuk.

2.4. Diaminreaktionen
Hydrazin findet umfangreiche Verwendung bei der Synthese und Produktion verschiedener offenkettiger und heterozyklischer Stickstoffverbindungen, einschließlich Hydrazo- und Azoverbindungen, Pyrazolen, Triazolen, Urazolen, Tetrazolen, Pyridazinen und Triazinen.
3. Verwendung von Hydrazin
Der größte Teil des verfügbaren Hydrazins wird als Lösung in Wasser verkauft. Wasserfreies Hydrazin hingegen wird hauptsächlich als Raketentreibstoff oder als Mono- oder Bitreibstoff für Satelliten und Raumfahrzeuge verwendet.
Ungefähr 80–90 % der Hydrazinproduktion werden in organische Derivate umgewandelt. Seine anderen Anwendungen basieren auf seiner Rolle als Reduktionsmittel, einer energiereichen Verbindung oder seiner Wasserstoffspeicherkapazität.
Zu den bedeutenden Einsatzmöglichkeiten von Hydrazin und seinen Derivaten gehört die Verwendung als Polymerisationsinitiatoren und Treibmittel für Schaumstoffe sowie in der Pestizidproduktion. Sie werden auch als synthetische Bausteine, Arzneimittel, Treibstoffe und Airbags für Autos verwendet.
3.1. Treibmittel
Die industrielle Produktion von Treibmitteln auf Hydrazinbasis ist beträchtlich, wobei der Hydrazinhydratverbrauch für diesen Zweck 1998 50.000 Tonnen pro Jahr erreichte. Bei diesen Treibmitteln handelt es sich hauptsächlich um Hydrazo- oder Azoderivate, wobei letztere durch Oxidation der ersteren unter Verwendung von Chlor oder Wasserstoffperoxid gewonnen werden .
Beim Erhitzen zersetzen sich Treibmittel und setzen Stickstoff und andere Gase frei, die in Polymeren einen Schaumeffekt erzeugen, der zur Bildung von Poren oder Zellen führt. Es stehen verschiedene kommerziell hergestellte Treibmittel auf Hydrazinbasis zur Verfügung, deren Zersetzungstemperatur von Faktoren wie der Partikelgröße, dem pH-Wert und der Anwesenheit von Aktivierungsmitteln wie Barium-, Cadmium- oder Zinksalzen abhängt.
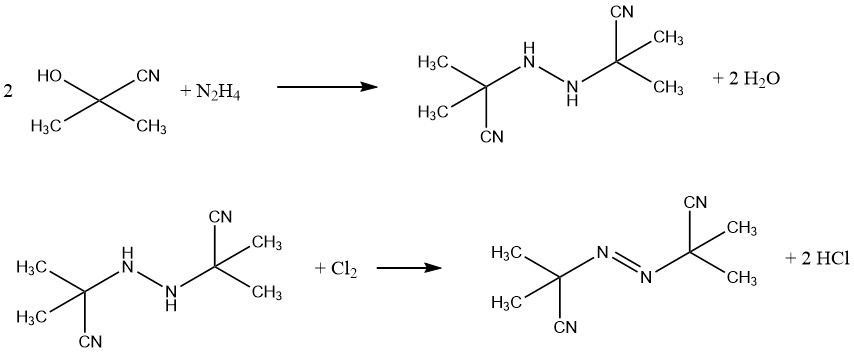
Ein Beispiel für ein kommerzielles Treibmittel ist Azobis(isobutyronitril) (AIBN), das für Moosgummiprodukte und PVC-Schaumstoffe verwendet wird. Es fungiert auch als Quelle freier Radikale bei der Polymerisationsinitiierung. AIBN wird aus Acetoncyanhydrin und Hydrazin synthetisiert und anschließend mit Chlor oxidiert.
Azodicarbonamid ist ein weiteres bedeutendes Treibmittel, das aus Harnstoff und Hydrazin hergestellt wird.

Das Zwischenprodukt Hydrazodicarbonamid kann direkt aus Harnstoff und Natriumhypochlorit oder durch Oxidation mit Chlor oder Wasserstoffperoxid in Gegenwart einer kleinen Menge Bromidionen in einem sauren Medium gewonnen werden.
Azodicarbonamid ist aufgrund seines großen Gasvolumens, das bei der Zersetzung entsteht, und seiner sicheren Eigenschaften das am häufigsten verwendete Treibmittel.
Um den Anforderungen bei der Herstellung neuer Gummi- oder poröser Kunststoffmaterialien gerecht zu werden, wurden in den 1950er Jahren Sulfonsäurehydrazide eingeführt.
Diese Hydrazide sind den bisher verwendeten anorganischen Treibmitteln (z. B. Ammoniumnitrit, Ammoniumbicarbonat, Natriumbicarbonat) hinsichtlich Dispersion, höherer Temperaturtoleranz und verbesserter Schaumzellstruktur überlegen.
Sie sind außerdem farblos, geruchlos und sicher und enthalten Zersetzungsprodukte, die die Verbrennung nicht unterstützen. Sulfonsäuremono- und -dihydrazide werden aus Hydrazinhydrat und dem entsprechenden Sulfonsäurechlorid hergestellt.
3.2. Airbags
Natriumazid wird häufig als Gasvorläufer in der Airbag-Technologie verwendet. Ein Herstellungsprozess für Natriumazid umfasst Hydrazin und ein Alkylnitrit. Für die gleiche Anwendung wird ein weiteres Hydrazin-Derivat, 5-Aminotetrazol, entwickelt, das aus Aminoguanidinsalzen gewonnen wird.
3.3. Radikalische Polymerisationsinitiatoren
Azoverbindungen, insbesondere symmetrische Azodinitrile, werden häufig als radikalische Polymerisationsinitiatoren verwendet.
Diese Azoverbindungen werden aus Hydrazin, einem Keton, und Cyanwasserstoff (HCN) synthetisiert. Das Hydrazo-Derivat wird mit Chlor oder Wasserstoffperoxid in Gegenwart eines Bromidkatalysators oxidiert.
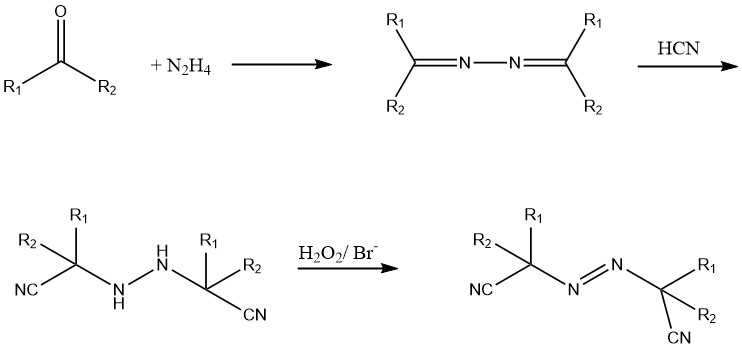
Wasserlösliche Verbindungen wie 2,2′-Azo-bis(2-aminopropan)-dihydrochlorid und flüssige Azoverbindungen wie Diethyl-2,2′-azobisisobutyrat befinden sich derzeit in der Entwicklung.
3.4. Pestizide
Pestizide auf Hydrazinbasis machen einen erheblichen Teil des Hydrazinverbrauchs aus. Das erste Beispiel ist Maleinsäurehydrazid, das durch Reaktion von Maleinsäureanhydrid mit Hydrazin synthetisiert wird.
Ein weiteres Allzweckherbizid ist 3-Amino-1,2,4-triazol, das aus Cyanamid, Hydrazinhydrat und Ameisensäure gewonnen wird. Dieses Herbizid wird selektiv in Wein- und Obstgärten eingesetzt, wobei der Verbrauch mehrere tausend Tonnen pro Jahr erreicht.
Für Pestizidanwendungen werden zahlreiche Verbindungen auf Hydrazinbasis kommerziell hergestellt, hauptsächlich heterozyklische Verbindungen wie Triazine, Oxadiazole, Pyrazole, Pyridazine und Thiadiazole.
3.5. Arzneimittel
Obwohl es nur einen kleinen Prozentsatz der gesamten Hydrazinproduktion ausmacht, ist die Verwendung von Hydrazin in Arzneimitteln von Bedeutung. Beispielsweise wurde Isoniazid, das Hydrazid der Isonikotinsäure, erstmals in den 1950er Jahren zur Behandlung von Tuberkulose eingesetzt.
In den 1980er und 1990er Jahren wurden andere Arzneimittel auf Hydrazinbasis eingeführt, die die 1,2,4-Triazol-Gruppe enthielten und als Antidepressiva, Antihypertensiva sowie antibakterielle oder antimykotische Mittel dienten.
Jüngste Entwicklungen konzentrierten sich auf Arzneimittel mit der 4-Amino-1,2,4-triazol-Gruppe, die eine verbesserte Wirksamkeit aufweisen.
3.6. Wasserversorgung
Hydrazin wird in der Wasseraufbereitung eingesetzt, um Stahl in Kesseln vor Korrosion zu schützen. Wenn Hydrazin mit Eisen(III)-oxid reagiert, bildet es Magnetit, das als Schutzschicht gegen Korrosion durch Wasser und Sauerstoff dient.
Restkonzentrationen von Hydrazin unter 0,1 ppm gewährleisten einen vollständigen Korrosionsschutz. Im Handel erhältliche katalysierte Hydrazinhydratformulierungen, sogenannte aktivierte Hydrazine, sind bereits bei Raumtemperatur wirksam.
3.7. Treibstoffe
Hydrazin wurde zunächst in großem Maßstab als Raketentreibstoff eingesetzt. Wasserfreies Hydrazin ist ein ausgezeichnetes Treibmittel, wobei nur Wasserstoff seinen spezifischen Impuls übertrifft.
Zu den aktuellen Raketentreibstoffen gehören wasserfreies Hydrazin, Monomethylhydrazin und unsymmetrisches Dimethylhydrazin, die vorwiegend als Doppeltreibstoffe in Raketen wie Titan oder Ariane verwendet werden.
Wasserfreies Hydrazin dient auch als Monotreibstoff für Satelliten und Raumfahrzeuge. Bei der Zersetzung an einem Katalysator entsteht ein Gasgemisch.
Katalysatoren, die häufig auf auf Aluminiumoxid abgeschiedenem Iridium oder Ruthenium basieren, werden in spontane (bei Raumtemperatur arbeitende) oder nicht spontane (bei über 100 °C arbeitende) Katalysatoren eingeteilt.
3.8. Brennstoffzellen
Es wurden umfangreiche Forschungsarbeiten zu Brennstoffzellen durchgeführt, die die Oxidation von Hydrazin mit Sauerstoff oder Wasserstoffperoxid nutzen. Allerdings ist ihr Einsatz aufgrund der Kosten für Hydrazinhydrat vor allem auf militärische Anwendungen beschränkt.
Referenz
- Hydrazine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_177
