Cyclohexylamin: Eigenschaften, Reaktionen, Herstellung und Verwendung
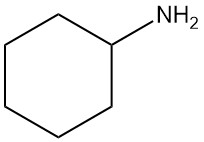
Was ist Cyclohexylamin?
Cyclohexylamin, auch bekannt als Aminocyclohexan, ist ein aliphatisches primäres Amin mit der chemischen Formel C6H13N. Es ist eine farblose Flüssigkeit, die mit Wasser und üblichen organischen Lösungsmitteln mischbar ist.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Cyclohexylamin
Cyclohexylamin ist eine farblose Flüssigkeit mit einem Ammoniak- oder Fischgeruch, die sehr gut in Ethanol, Ether, Aceton und üblichen organischen Lösungsmitteln löslich ist. Es bildet mit Wasser ein Azeotrop, das bei 96,4 °C siedet und 44,2 % Cyclohexylamin enthält.
Die physikalischen Eigenschaften von Cyclohexylamin sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [108-91-8] |
| Chemische Formel | C6H13N |
| Molekulargewicht | 99,18 g/mol |
| Schmelzpunkt | -17,8 °C |
| Siedepunkt | 134,5 °C |
| Dichte | 0,8647 g/cm3 |
| Brechungsindex | 1,4592 |
| Viskosität bei 20 °C | 2,10 Pa·s |
| pKa | 10,63 |
| Dampfdichte | 3,42 |
| Dampfdruck | 1,4 kPa bei 20 °C |
| Spezifische Wärmekapazität bei 20 °C | 2,366 J g-1K-1 |
| Verdampfungswärme | 399,86 J/g |
| Flammpunkt (geschlossene Tiegel) | 26,5 °C |
| Zündtemperatur | 265 °C |
| Zündbereich in Luft | 1,6–9,4 Vol.-% |
2. Chemische Reaktionen von Cyclohexylamin
Cyclohexylamin ist eine schwache Base mit einem pKb-Wert von 3,4, die eine ähnliche Reaktivität wie primäre aliphatische Amine aufweist. Es bildet Salze sowohl mit Brønsted- als auch mit Lewis-Säuren. Eine vollständige Alkylierung führt zur Bildung eines quartären Ammoniumkations.
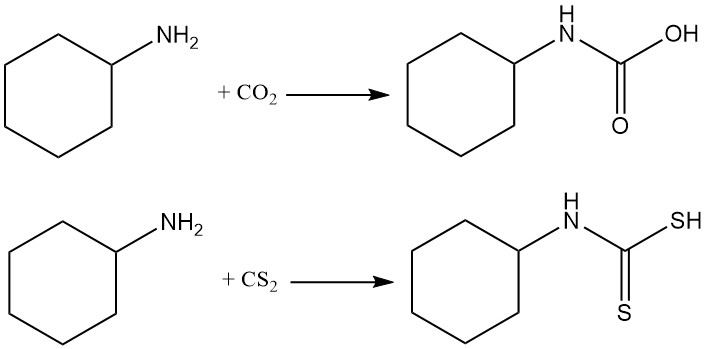
Cyclohexylamin reagiert mit Kohlendioxid und Kohlenstoffdisulfid zu Carbamaten bzw. Thiocarbamaten.
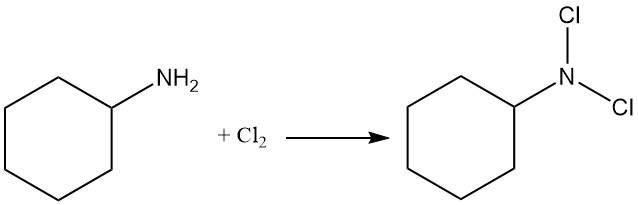
Durch die Reaktion von Cyclohexylamin mit Chlor entsteht N,N-Dichlorcyclohexylamin.
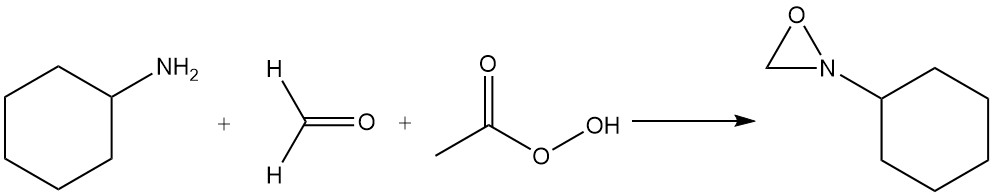
2-Cyclohexyloxaziridin wird durch Reaktion einer Mischung aus Cyclohexylamin, Formaldehyd und Peressigsäure hergestellt.
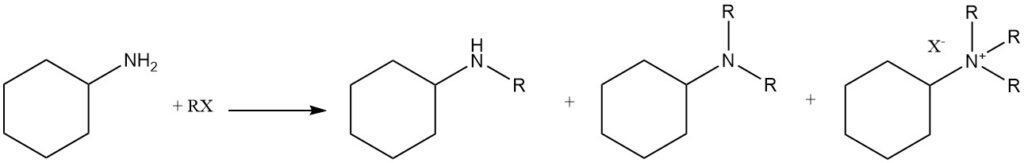
Die N-Alkylierung von Cyclohexylamin kann durch die Verwendung verschiedener Alkylierungsmittel, einschließlich Alkylhalogeniden, Sulfaten und Phosphaten, erreicht werden. Alternativ können Alkohole als Alkylierungsverbindungen in Gegenwart katalytischer Metalle (Aluminium, Kupfer, Nickel, Kobalt oder Platin) oder unter Leuckart-Wallach-Bedingungen verwendet werden.
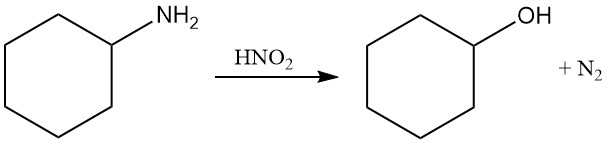
Cyclohexylamin wird mit salpetriger Säure diazotiert, wobei Stickstoffgas und Cyclohexanol entstehen.
Säurechloride reagieren mit Cyclohexylamin unter Schotten-Baumann-Bedingungen zu Cyclohexylamiden.
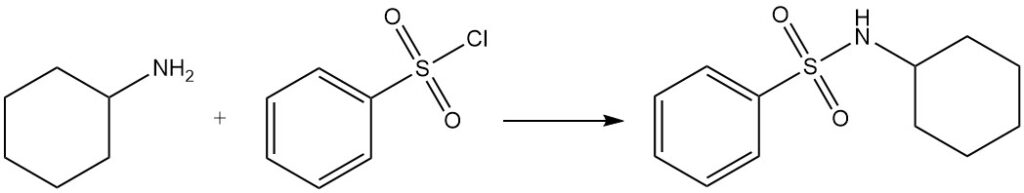
Benzolsulfonylchlorid reagiert mit Cyclohexylamin zu N-Cyclohexylbenzolsulfonamid, das in alkalischen Lösungen löslich ist (Hinsberg-Test).
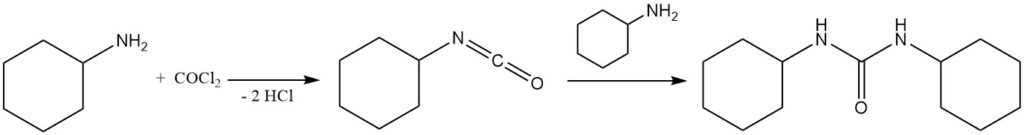
Phosgen reagiert mit Cyclohexylamin zu Isocyanatocyclohexan, das weiter mit Cyclohexylamin zu 1,3-Dicyclohexylharnstoff reagiert.
Aufgrund des nukleophilen Charakters von Cyclohexylamin reagiert es mit Epoxiden zu Hydroxyalkyl- und Dihydroxyalkylamin-Derivaten.
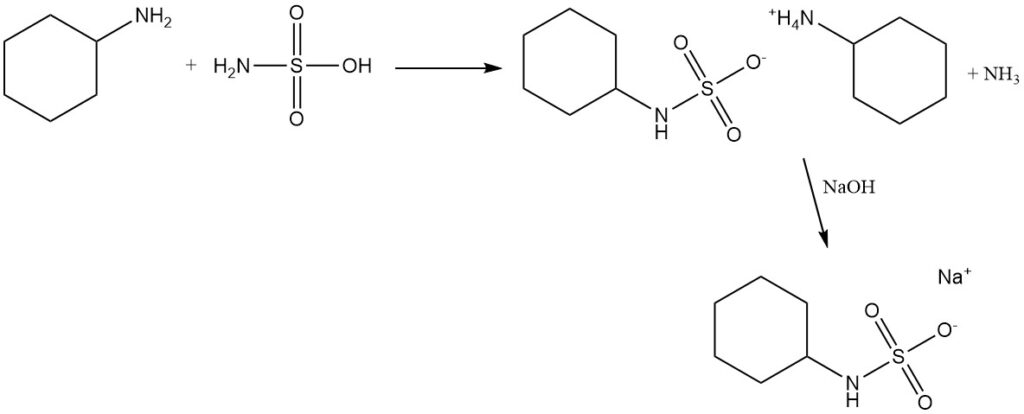
Hochreines Cyclohexylamin reagiert mit Sulfaminsäure und wird anschließend mit Natriumhydroxid oder Calciumhydroxid behandelt, um Natriumcyclohexylsulfamat oder Calciumcyclohexylsulfamat zu bilden, die früher als künstliche Süßstoffe verwendet wurden.
Die Kondensationsreaktion von Cyclohexylamin mit Mercaptobenzothiazol erzeugt N-Cyclohexyl-2-benzothiazolsulfenamid, das als moderierter Gummibeschleuniger verwendet wird.
3. Industrielle Produktion von Cyclohexylamin
Cyclohexylamin wird kommerziell durch die Reaktion von Cyclohexanol mit Ammoniak und Wasserstoff in der Dampfphase unter Verwendung von Metallkatalysatoren wie Ni oder Co hergestellt.
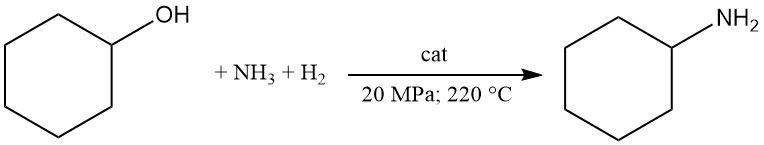
Bei diesem Verfahren reagiert Cyclohexanol bei 20 MPa und 220 °C mit mindestens 3 Mol Ammoniak in Gegenwart von zirkulierendem Wasserstoff über einem Festbettkatalysator.
Ein erhöhtes Ammoniak-zu-Cyclohexanol-Zufuhrverhältnis begünstigt die Bildung von Cyclohexylamin und verringert die Bildung des Nebenprodukts Dicyclohexylamin.
Die reduktive Aminierung von Cyclohexanon in einem kontinuierlichen Verfahren ist eine weitere Methode zur Herstellung von Cyclohexylamin. Bei diesem Verfahren reagieren unter Druck stehender Wasserstoff und Ammoniak mit Cyclohexanon über Nickel- oder Kobaltkatalysatoren bei 0,1–20 MPa und hohen Temperaturen bis zu 275 °C.

Es wurde ein Ammoniak-Cyclohexanon-Verhältnis von 3,3:1 und ein Wasserstoff-Cyclohexanon-Verhältnis von 6,5:1 angegeben.
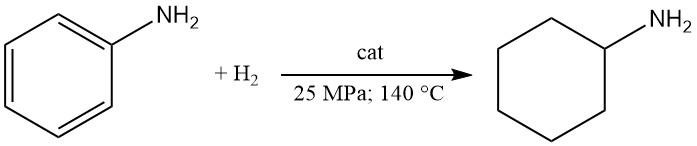
Cyclohexylamin wird durch Flüssigphasenhydrierung von Anilin über einem Kobalt-Aluminiumoxid-Katalysator bei 25 MPa und 140 °C mit einer Ausbeute von 80 % hergestellt. Die Dampfphasenhydrierung über Nickel-auf-Bimsstein begünstigt jedoch die Bildung von Dicyclohexylamin.
Die Wahl der Katalysatoren und Reaktionsbedingungen beeinflusst die Selektivität der Reaktion für Cyclohexylamin. Wenn beispielsweise Anilin bei 160–200 °C in Gegenwart eines Ruthenium-Palladium-Katalysators auf γ-Aluminiumoxid hydriert wird, enthält das Endproduktgemisch nur 19,3 % Cyclohexylamin und 80,3 % Dicyclohexylamin.
Eine hohe Selektivität für Cyclohexylamin wird durch Zugabe von Ammoniak während der Hydrierung von Anilin bei 160 bis 180 °C und 2 bis 5 MPa unter Verwendung eines Ruthenium-auf-Kohlenstoff-Katalysators erreicht.
Cyclohexylamin wird auch im kommerziellen Maßstab durch Hydrierung von Nitrobenzol ohne Zwischenabtrennung von Anilin hergestellt.
Die direkte Cyclohexylaminsynthese aus Phenol unter Verwendung von Rhodium- oder Nickelkatalysatoren wurde untersucht, jedoch mit geringerer Selektivität für Cyclohexylamin im Vergleich zu Dicyclohexylamin.
Cyclohexylamin wird durch Destillation unter reduziertem Druck von Nebenprodukten gereinigt.
4. Verwendung von Cyclohexylamin
Cyclohexylamin ist eine wassermischbare Verbindung, die mit Wasser ein Azeotrop bildet. Es wird als Korrosionsinhibitor in Niederdruckdampfsystemen verwendet, da es einen Schutzfilm bildet und ein säureneutralisierendes Mittel ist.
Im Jahr 2000 wurden etwa 55 % der US-amerikanischen Cyclohexylaminproduktion für diese Anwendung verwendet. Im Vergleich zu Morpholin bietet Cyclohexylamin eine überlegene chemische Stabilität in Hochdruckumgebungen und bildet kein Nitrosamin.
Es wird als Korrosionsinhibitor für Kühleralkohollösungen und auch in der Papier- und Metallbeschichtungsindustrie zum Schutz vor Feuchtigkeit und Oxidation verwendet.
Neben der Korrosionshemmung wird Cyclohexylamin als Vulkanisationsbeschleuniger, Korrosionsschutzadditiv und Vorläufer verschiedener Verbindungen verwendet, darunter Weichmacher, Emulgatoren, Koagulanzien und Epoxidhärter.
Seine Salze mit Fettsäuren verhindern die Schaumbildung in Mineralölen. Cyclohexylamin wird auch als Kettenabbrecher bei der Polyamidpolymerisation und als Vorläufer für Herbizide wie Hexazinon verwendet. Es fungiert auch als Härter für Epoxidharze und als Katalysator für Polyurethane.
Historisch wurde Cyclohexylamin bei der Herstellung von Cyclamat-Süßstoffen verwendet.
Zu den wichtigsten Herstellern von Cyclohexylamin gehören US Amines, Air Products, BASF, Borsodchem, Jintian Enterprises und New Japan Chemical Co.
5. Toxikologie von Cyclohexylamin
Cyclohexylamin ist eine alkalische Flüssigkeit, die leicht oral und über die Atemwege aufgenommen wird, obwohl die dermale Aufnahme langsamer ist. Die schnelle Ausscheidung über den Urin erfolgt mit minimaler Stoffwechselveränderung. Die Verbindung besitzt einen starken, fischähnlichen Geruch mit einer Geruchsschwelle von etwa 2,5 ml/m³.
Die Exposition des Menschen gegenüber Cyclohexylamin kann bei einer täglichen Dosis von 5 mg/kg sympathikomimetische Effekte hervorrufen. Aufgrund der Verbindung mit dem Süßstoff Saccharin wurden umfangreiche toxikologische Studien durchgeführt.
Langzeit-Fütterungsstudien an Nagetieren ergaben bei Dosen bis zu etwa 20 mg/kg pro Tag keine karzinogenen, mutagenen oder teratogenen Effekte. Fruchtbarkeitsstudien an Ratten zeigten trotz leichter Hodenatrophie bei höheren Dosen keine nachteiligen Effekte.
Zum Schutz der menschlichen Gesundheit wurden Grenzwerte für die Exposition am Arbeitsplatz festgelegt. Eine 4-stündige Inhalationsstudie an Menschen zeigte Reizungen bei 10 ml/m³, während eine zeitgewichtete Durchschnittskonzentration von 2 ml/m³ gut vertragen wurde.
Folglich wurde die maximale Konzentration am Arbeitsplatz (MAK-Wert) auf 2 mL/m³ mit einer Spitzenbegrenzungskategorie von I festgelegt.
Studien zur akuten Toxizität an Tieren weisen auf eine orale LD50 von 710 mg/kg bei Ratten und eine dermale LD50 von 320 mg/kg bei Kaninchen hin.
Referenzen
- Amines, Aliphatic, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
- Amines, Cycloaliphatic. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0325031203011905.a01.pub2
- Aniline and Its Derivatives. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0114091201130914.a01.pub2
- Cyclohexylamine [MAK Value Documentation, 2017]. – https://onlinelibrary.wiley.com/doi/10.1002/3527600418.mb10891e6218
