Cumol: Eigenschaften, Reaktionen, Produktion, Verwendung und Toxikologie
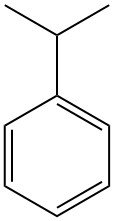
Was ist Cumol?
Cumol, auch bekannt als Isopropylbenzol oder 2-Phenylpropan, ist ein aromatischer Kohlenwasserstoff mit der chemischen Formel C9H12. Es ist eine farblose, brennbare Flüssigkeit mit einem charakteristischen benzinartigen Geruch.
Cumol kommt als Nebenbestandteil von Rohöl und aus Erdöl gewonnenen Kraftstoffen vor. Es wird hauptsächlich als Zwischenprodukt in der chemischen Industrie verwendet, insbesondere bei der Herstellung von Phenol und Aceton.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Cumol
Cumol ist eine farblose, flüchtige Flüssigkeit mit charakteristischem aromatischem Geruch. Es ist mit vielen organischen Lösungsmitteln mischbar, darunter Ethanol, Diethylether, Aceton, Benzol, Petrolether und Tetrachlorkohlenstoff. Die Wasserlöslichkeit ist gering und beträgt bei 25 °C etwa 61,3 mg/l.
Cumol bildet Azeotrope mit Wasser, aliphatischen Carbonsäuren, Ethylenglykolethern, Cyclohexanol und Cyclohexanon.
Cumol hat eine variable Geruchsschwelle mit Werten zwischen 0,008 und 0,13 ppm. Während einige Studien eine menschliche Geruchswahrnehmung von nur 0,0032 ppm angeben, liegen andere bei Werten um 0,012 ppm. Die Geruchserkennung ist keine zuverlässige Methode zur Beurteilung der gefährlichen Cumol-Exposition.
Die Explosionsgrenzen für Cumol-Luft-Gemische liegen zwischen 0,8 und 6,0 Vol.-%. Dies entspricht einer Cumolkonzentration von 40–300 g/m³.
Tabelle 1 listet alle wichtigen physikalischen Eigenschaften von Cumol auf.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | 98-82-8 |
| Chemische Formel | C9H12 |
| Molmasse | 120,2 |
| Gefrierpunkt, °C | −96,03 |
| Siedepunkt, °C | 152,39 |
| Dichte, g/cm3 (0 °C) | 0,8797 |
| Dichte, g/cm3 (20 °C) | 0,8633 |
| Dichte, g/cm3 (40 °C) | 0,8465 |
| Brechungsindex, n20D | 1,4915 |
| Wärmeleitfähigkeit bei 25 °C, W/(m·K) | 0,124 |
| Viskosität, mPa·s (0 °C) | 1,073 |
| Viskosität, mPa·s (20 °C) | 0,790 |
| Viskosität, mPa·s (40 °C) | 0,610 |
| Oberflächenspannung bei 20 °C, mN/m | 28,2 |
| Dampfdruck bei 35 °C, kPa | 1 |
| Dampfdruck bei 100 °C, kPa | 21 |
| Dampfdruck bei 120 °C, kPa | 40 |
| Dampfdruck bei 140 °C, kPa | 73 |
| Dampfdruck bei 180 °C, kPa | 196 |
| Flammpunkt, °C | 33 |
| Zündungstemperatur, °C | 425 |
| Entzündbarkeitsgrenzen in Luft, Vol.-% (untere) | 0,9 |
| Entzündbarkeitsgrenzen in Luft, Vol.-% (obere) | 6,5 |
| Kritische Temperatur, °C | 358,0 |
| Kritischer Druck, kPa | 3220 |
| Kritische Dichte, g/cm3 | 0,280 |
| Verdampfungswärme am Siedepunkt, J/g | 312 |
| Verdampfungswärme bei 25 °C, J/g | 367 |
| Bildungswärme (flüssig) bei 25 °C, J/mol | −44.150 |
| Freie Energie (Dampf) bei 25 °C, J/mol | 137.000 |
| Verbrennungswärme (brutto, Wasser flüssig), J/g | 43.370 |
| Verbrennungswärme (netto, Wasserdampf), J/g | 41.170 |
| Wärmekapazität (Flüssigkeit) bei 25 °C, J/(mol·K) | 197 |
| Wärmekapazität (idealer Dampf) bei 25 °C, J/(mol·K) | 153 |
2. Chemische Reaktionen von Cumol
Die Oxidation von Cumol zu Cumolhydroperoxid ist die wichtigste industrielle Reaktion von Cumol. Weitere Reaktionen sind typische aromatische Substitutionen (Nitrierung, Sulfonierung, Halogenierung, Alkylierung und Acylierung), Seitenkettenhalogenierung, Hydrierung und Verbrennung.
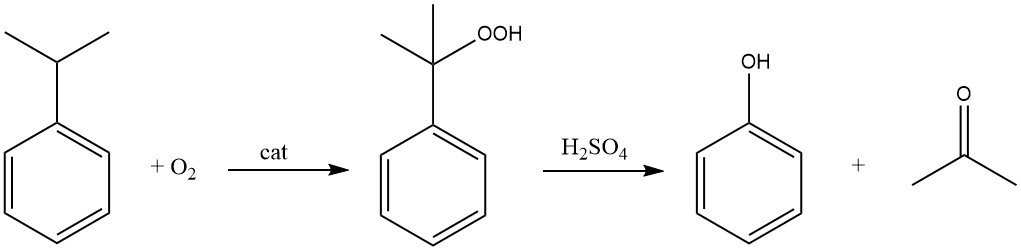
2.1. Das Cumolverfahren
Das Cumolverfahren, auch Hock-Verfahren genannt, beginnt mit der Synthese von Cumol selbst, gefolgt von einer zweistufigen Umwandlung zu Phenol und Aceton.
Das Cumol wird in Gegenwart eines Radikalinitiators durch Luft (Sauerstoff) zu Cumolhydroperoxid oxidiert. Diese Reaktion zielt auf das tertiäre Wasserstoffatom am Kohlenstoffatom des Benzolrings.
Mit einem Säurekatalysator wie Schwefelsäure wird das Cumolhydroperoxid anschließend gespalten, um Phenol und Aceton zu erzeugen.
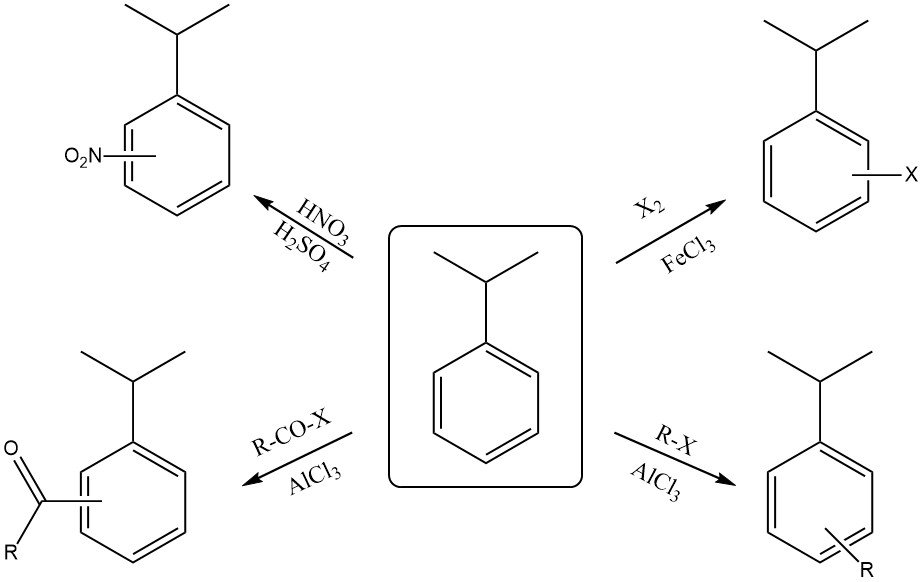
2.2. Reaktionen am aromatischen Ring
Cumol reagiert mit einer Mischung aus konzentrierter Salpetersäure und Schwefelsäure zu einem Gemisch aus ortho-Nitrocumol und para-Nitrocumol. Aufgrund der sterischen Hinderung durch die sperrige Isopropylgruppe ist das para-Isomer typischerweise das Hauptprodukt.
Die Halogenierung des Rings mit Reagenzien wie Chlor oder Brom in Gegenwart eines Lewis-Säure-Katalysators (FeCl3 oder FeBr3) führt ebenfalls zu ortho- und para-Substitution.
Die Reaktion mit rauchender Schwefelsäure ergibt Cumolsulfonsäure.
Cumol kann mit einem Alkylhalogenid und einem Lewis-Säure-Katalysator (AlCl3 ) zu Alkylcumol reagieren.
Die Reaktion von Cumol mit einem Acylhalogenid in Gegenwart eines Lewis-Säure-Katalysators (AlCl3 ) ergibt Ortho- und Para-Acylcumol.
2.3. Reaktionen an der Alkylseitenkette
Der benzylische Wasserstoff (der Wasserstoff am direkt an den Benzolring gebundenen Kohlenstoff) ist aufgrund der Stabilität des entstehenden Benzylradikals besonders anfällig für Radikalreaktionen.
Cumol kann durch starke Oxidationsmittel wie Kaliumpermanganat oder Chromsäure oxidiert werden. Dabei wird der benzylische Kohlenstoff vollständig zu einer Carbonsäuregruppe oxidiert, wodurch Benzoesäure und nicht Phenol entsteht.
Unter hohen Temperaturen, UV-Licht oder in Gegenwart von Radikalinitiatoren reagieren Halogene wie Chlor oder Brom ausschließlich an der benzylischen Position und ersetzen das Wasserstoffatom.
Die Hydrierung des aromatischen Rings mit Katalysatoren wie Ni, Pt oder Pd führt zu Isopropylcyclohexan.
Wie andere Kohlenwasserstoffe verbrennt Cumol in Gegenwart von Sauerstoff zu Kohlendioxid und Wasser.
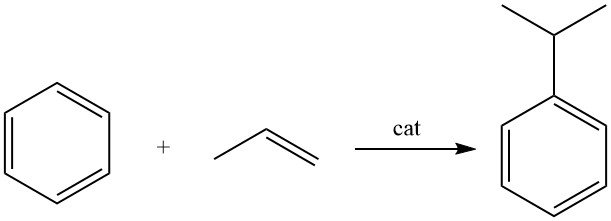
3. Industrielle Cumolproduktion
Cumol wird durch Alkylierung von Benzol mit Propen in Gegenwart eines sauren Katalysators hergestellt.
Cumol wurde während des Zweiten Weltkriegs in großen Mengen synthetisiert und als Bestandteil von Flugbenzin verwendet. Obwohl es einen hohen Heizwert und eine hohe Oktanzahl aufweist, ist es als Kraftstoff nicht mehr konkurrenzfähig. In modernem Benzin ist es als Nebenprodukt von Raffinerieprozessen wie katalytischem Reforming und Steamcracken enthalten.
Die Cumolproduktion hat durch die Entwicklung neuer Katalysatortechnologien, insbesondere zeolithbasierter Systeme, die ältere Verfahren mit fester Phosphorsäure und Aluminiumchlorid ersetzt haben, erhebliche Fortschritte erzielt. Dieser technologische Wandel, der Mitte der 1990er Jahre begann, hat die Branche revolutioniert.
Neben der synthetischen Produktion kommt Cumol natürlicherweise in Rohöl und raffinierten Erdölprodukten vor.
3.1. Alkylierungs- und Transalkylierungsreaktionen
Cumol wird durch die Alkylierung von Benzol mit Propylen in der Flüssigphase unter Verwendung eines sauren Katalysators hergestellt.
Diese Vorwärtsreaktion ist thermodynamisch günstig. Die Propylenumwandlung kann jedoch durch die Katalysatoraktivität und den Stofftransport begrenzt sein. Obwohl n-Propylbenzol thermodynamisch stabiler ist als Cumol, wird es nur in geringen Mengen produziert, da der sekundäre Kohlenstoff des Propylenmoleküls reaktiver ist.
Der sekundäre Kohlenstoff wird an der sauren Stelle des Katalysators zu einem Carbokation, das dann mit Benzol zu Cumol reagiert. Eine hohe Selektivität für Cumol gegenüber n-Propylbenzol (bis zu 10.000:1) ist wichtig, da sich diese Isomere durch Destillation nur schwer trennen lassen.
Auch eine weitere Alkylierung ist möglich, bei der Cumol mit weiterem Propylen reagiert und Polyisopropylbenzole, darunter Diisopropylbenzole, Triisopropylbenzole und Tetraisopropylbenzole, entstehen.
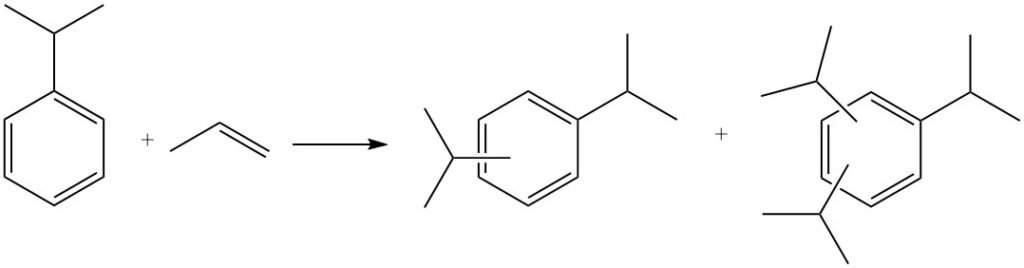
Polyisopropylbenzole können durch Reaktion mit Benzol in einem als Transalkylierung bezeichneten Prozess wieder zu Cumol zurückgeführt werden.
Die Alkylierung ist eine exotherme Reaktion, während die Transalkylierung im Wesentlichen isotherm verläuft. Bei der Alkylierung wird üblicherweise ein Überschuss an Benzol verwendet, um die Temperatur zu regulieren, die Bildung von Polyisopropylbenzolen zu minimieren und die Propylenoligomerisierung zu verhindern.
Ein hohes Benzol-Propylen-Verhältnis fördert zwar die Cumolselektivität, erhöht aber auch die Kosten und den Energieaufwand für die destillative Rückgewinnung des überschüssigen Benzols.
3.2. Herstellung von Cumol durch Festphosphorsäureverfahren (SPA)
Vor 1996 war das SPA-Verfahren die gängigste Methode zur Herstellung von Cumol und machte über 80 % der weltweiten Produktion aus. Bei diesem Verfahren wurde Phosphorsäure auf Aluminiumoxid als Katalysator verwendet.
Bei diesem von UOP weltweit lizenzierten Verfahren wurde eine Mischung aus flüssigem Propylen (häufig ein Propan-Propylen-Gemisch) und Benzol zusammen mit einer kleinen Menge Wasser zur Aufrechterhaltung der Katalysatoraktivität vorgewärmt und in einen Festbettreaktor bei 180–200 °C und ca. 350 bar (550 psig) geleitet.
Das typische Molverhältnis von Benzol zu Propylen lag zwischen 5:1 und 8:1. Die Reaktoren arbeiteten adiabatisch, und die freigesetzte Reaktionswärme wurde teilweise zur Verdampfung des recycelten Propans genutzt.
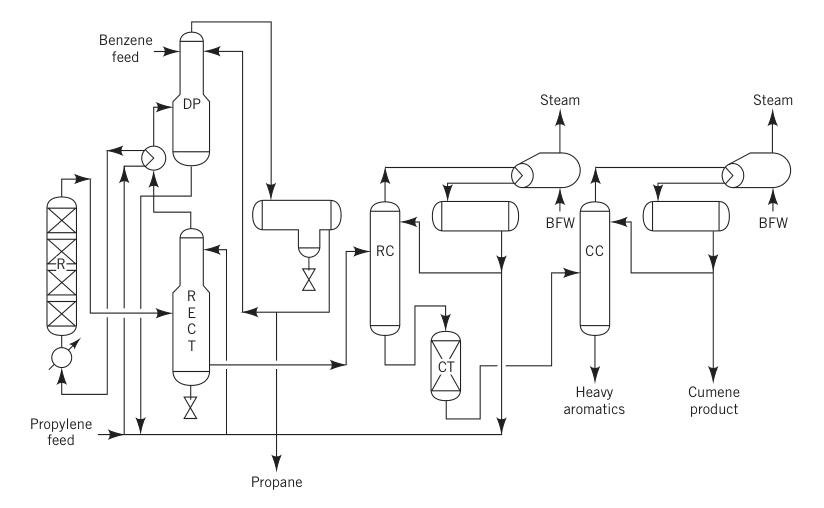
R = Reaktor; RECT = Gleichrichter; DP = Depropanisierer; RC = Recyclingsäule; CT = Tonbehandlungsanlage; CC = Cumolsäule; und BFW = Kesselspeisewasser.
Das SPA-Verfahren erfreute sich aufgrund seiner geringeren Anfangsinvestitionen und der Flexibilität bei den Rohstoffen großer Beliebtheit, da es Propylen in Raffineriequalität und Benzol geringer Reinheit verwenden konnte. Nebenprodukte wie schwere Aromaten konnten zur Benzinmischung verwendet werden, was ein entscheidender Vorteil für Raffinerien war.
Dieses Verfahren hatte jedoch eine relativ geringe Ausbeute (ca. 5 % Verlust) und produzierte Verunreinigungen. Bemühungen zur Rückgewinnung und Transalkylierung der schweren Aromaten blieben aufgrund hoher Konzentrationen von Verunreinigungen wie Hexylbenzolen erfolglos.
3.3. Herstellung von Cumol nach dem Aluminiumchloridverfahren
Ein anderes älteres Verfahren zur Herstellung von Cumol verwendete einen Aluminiumchloridkomplex als Katalysator und arbeitete bei Temperaturen unter 100 °C und niedrigem Druck. Dieses Verfahren erforderte hochreine Rohstoffe und eine sorgfältige Dehydratation des Benzols, um die Katalysatoraktivität aufrechtzuerhalten und Korrosion zu reduzieren.
Das Aluminiumchloridverfahren bot den Vorteil, Polyisopropylbenzole zu Cumol transalkylieren zu können, was zu höheren Ausbeuten führte. Es erforderte jedoch teure korrosionsbeständige Reaktoren, beispielsweise aus Hastelloy oder mit Emailauskleidung, eine aufwendige Abwasserwäsche und verursachte Umweltprobleme im Zusammenhang mit der Katalysatorentsorgung.
3.4. Herstellung von Cumol mit modernen zeolithbasierten Verfahren
Seit Mitte der 1990er Jahre hat die Cumolindustrie rasch auf zeolithbasierte Alkylierungstechnologien umgestellt. Diese Katalysatoren beseitigten die mit früheren Verfahren verbundenen Korrosions- und Entsorgungsprobleme und ermöglichten gleichzeitig hohe Ausbeuten, hohe Selektivität und sehr hohe Produktreinheit.
Moderne Zeolithkatalysatoren können wiederholt regeneriert werden, was Abfall und Betriebskosten senkt. Sie ermöglichen zudem niedrigere Benzol-Propylen-Zufuhrverhältnisse, was die Größe des Destillationssystems reduziert und den Energieverbrauch senkt.
Ein bemerkenswertes Beispiel ist das ExxonMobil/Badger-Verfahren, das einen proprietären MCM-22-Katalysator verwendet. In diesem Flüssigphasenverfahren werden Propylen und Benzol vorgemischt und einem Festbettalkylierungsreaktor zugeführt, in dem Propylen vollständig verbraucht wird. Der Ablauf wird anschließend über mehrere Destillationskolonnen gereinigt.
Überschüssiges Benzol wird recycelt, Polyisopropylbenzole werden zurückgewonnen und einem separaten Transalkylierungsreaktor zugeführt, wo sie mit Benzol zu weiterem Cumol reagieren.
Dieses Verfahren erzielt nahezu stöchiometrische Ausbeuten und ein hochreines Produkt. Bestehende SPA- oder Aluminiumchloridanlagen können mit relativ geringen Investitionen auf diese Technologie umgerüstet werden, wobei die Kapazität um 30 bis über 100 Prozent gesteigert werden kann.
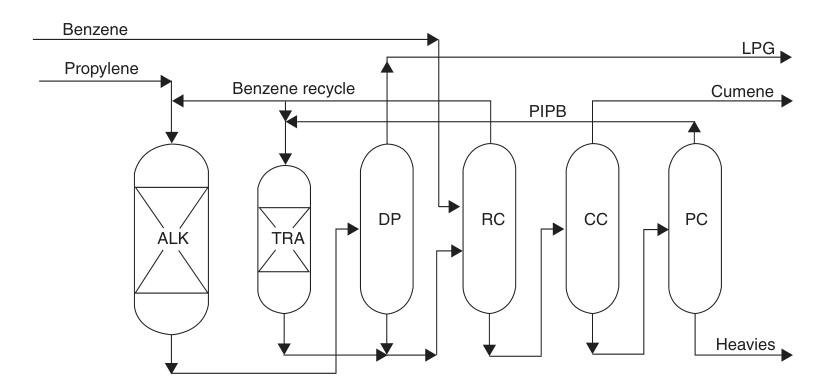
ALK = Alkylierungsreaktor; TRA = Transalkylierungsreaktor; DP = Propanisator; RC = Recyclingsäule; CC = Cumolsäule; und PC = Polyisopropylbenzolsäule.
Auch andere Unternehmen, darunter CDTech, Dow/Kellogg und UOP, haben eigene zeolithbasierte Technologien entwickelt. So nutzt beispielsweise das Q-Max-Verfahren von UOP eine neue Generation von Katalysatoren, die wiederholt regeneriert werden können, sodass keine Entsorgung mehr nötig ist.
Diese Technologie kann zudem die Kapazität bestehender Anlagen mit minimalem Kapitalaufwand erweitern. Die Umstellung auf diese fortschrittlichen Verfahren hat es vielen Cumolanlagen ermöglicht, ihre Produktionskapazität deutlich zu steigern.
4. Verwendung von Cumol
Cumol hat eine Oktanzahl von 109, vergleichbar mit der von Toluol. In den 1940er Jahren machte diese Eigenschaft es zu einem wertvollen Zusatzstoff für Flugbenzin.
Cumol wird heute fast ausschließlich (95 % der Gesamtproduktion) als Zwischenprodukt für die Herstellung von Phenol und Aceton verwendet. In Gegenwart von Sauerstoff oxidiert Cumol zu Cumolhydroperoxid, das nach säurekatalysierter Spaltung Phenol und Aceton liefert.
Die weltweite Cumolproduktion erreichte im Jahr 2020 rund 18 Millionen Tonnen und dürfte weiter steigen, vor allem aufgrund der steigenden Nachfrage nach Bisphenol A für die Herstellung von Polycarbonat und Epoxidharzen.
Zu den Nebenprodukten der Cumoloxidation zählen α-Methylstyrol, Acetophenon, Cumylalkohole und Diisopropylbenzol.
α-Methylstyrol wird zur Herstellung von Acrylnitril-Butadien-Styrol (ABS), p-Cumylphenol und anderen Zwischenprodukten verwendet.
Cumolhydroperoxid wird auch als Radikalinitiator bei der Copolymerisation von Styrol mit Butadien und Acrylaten sowie bei der Vernetzung ungesättigter Polyesterharze eingesetzt. Die Reaktion von Cumolhydroperoxid mit α-Methylstyrol ergibt Dicumylperoxid, einen Initiator für die radikalische Vernetzung von Polyolefinen.
Die Hydrierung von Cumol ergibt Isopropylcyclohexan (Hydrocumol), ein hochsiedendes (154,5 °C) und tiefkühlendes (–90 °C) cycloaliphatisches Lösungsmittel.
Cumol wird in kleineren Mengen auch als Verdünner für Farben, Emaille und Lacke sowie als Lösungsmittel für Fette und Harze verwendet und ersetzt in industriellen Anwendungen manchmal Benzol.
Laut der Consumer Product Information Database (2022) ist Cumol in über hundert Konsum- und Haushaltsprodukten enthalten, darunter Pestizide und Reinigungsmittel.
5. Toxikologie von Cumol
Die Exposition gegenüber Cumol erfolgt hauptsächlich durch das Einatmen kontaminierter Luft am Arbeitsplatz und durch die Verdunstung von Erdölprodukten. Weitere Quellen sind Zigarettenrauch, kontaminierte Lebensmittel und Wasser sowie versehentliche Einnahme oder dermale Aufnahme.
Die Inhalation ist der wichtigste Aufnahmeweg, da Cumol leicht über die Lunge aufgenommen, in der Leber zu wasserlöslichen Verbindungen metabolisiert und effizient, hauptsächlich über den Urin, ausgeschieden wird, ohne dass eine langfristige Akkumulation erkennbar ist.
Toxikokinetische Studien am Menschen bestätigen, dass Cumol und sein Metabolit 2-Phenyl-2-propanol innerhalb von 40 Stunden nach Exposition eliminiert werden.
Akute Exposition gegenüber hohen Cumolkonzentrationen führt zu einer Depression des zentralen Nervensystems, die sich in Kopfschmerzen, Schwindel, Narkose, Übelkeit und Bewusstlosigkeit bei Konzentrationen deutlich über den Arbeitsplatzgrenzwerten äußert.
Cumol ist zudem ein primärer Reizstoff für Haut, Augen und Atemwege. Wiederholter oder längerer Hautkontakt kann Dermatitis und Hautausschläge verursachen, während die Einnahme ein hohes Risiko einer Aspirationspneumonitis birgt.
In Tierversuchen führte die kurzfristige Inhalation von Konzentrationen über 1000 ppm zu reversiblen neurotoxischen Effekten, während die Exposition gegenüber sehr hohen Dosen zu schwerer Toxizität des zentralen Nervensystems und zum Tod führte.
Die orale LD50 bei Ratten beträgt etwa 1400 mg/kg, und die inhalativen LC50-Werte liegen je nach Tierart zwischen 2000 und 8000 ppm.
| Expositionsweg | Symptome | Erste-Hilfe-Maßnahmen |
|---|---|---|
| Einatmen und Riechen |
Schwindel Koordinationsstörungen Benommenheit Kopfschmerzen |
An die frische Luft bringen und ausruhen Bei Bedarf ärztliche Hilfe hinzuziehen |
| Hautkontakt |
Trockene Haut Ausschläge Juckreiz Rötung der Haut |
Kontaminierte Kleidung sofort ausziehen und die Haut mit Wasser waschen.
In einigen Quellen wird empfohlen, die Haut nach dem Abspülen mit Wasser und Seife zu waschen. Wenn die Reizung nach dem Waschen anhält, suchen Sie einen Arzt auf. |
| Augenkontakt |
Augenreizung Rötung |
Spülen Sie die Augen sofort mit viel Wasser aus und heben Sie gelegentlich die unteren und oberen Augenlider an, wenn die Chemikalie in die Augen gelangt. Suchen Sie sofort einen Arzt auf. |
| Verschlucken und Verschlucken |
Schwindel Koordinationsstörungen Benommenheit Kopfschmerzen |
Es besteht Aspirationsgefahr. Mundspülung und Mundspülung werden empfohlen. Erbrechen vermeiden. Sofort einen Arzt aufsuchen. |
Daten zur chronischen Exposition beim Menschen sind begrenzt, Tierstudien weisen jedoch auf leichte hämatologische und organische Auswirkungen nach subchronischer Inhalation hin, wie z. B. passive Stauung von Lunge, Leber, Nieren und Milz. Es wurden keine konsistenten immuntoxischen Wirkungen berichtet.
Die Belege für eine Reproduktions- und Entwicklungstoxizität sind schwach. Studien deuten auf eine schnelle Metabolisierung und Ausscheidung ohne signifikante Auswirkungen auf die Fruchtbarkeit oder die Entwicklung der Nachkommen hin.
Gentoxizitätstests in bakteriellen, In-vitro- und In-vivo-Systemen lieferten überwiegend negative Ergebnisse, obwohl einige Tierstudien mit hohen Dosen schwache zytogenetische Effekte berichteten.
Die Daten zur Karzinogenität beim Menschen sind unzureichend, aber Langzeit-Inhalationsstudien an Nagetieren zeigten eine erhöhte Inzidenz von Leber-, Nieren- und Lungentumoren. Dies veranlasste das US-amerikanische National Toxicology Program, Cumol als „mit hinreichender Wahrscheinlichkeit krebserregend für den Menschen“ einzustufen.
Die Internationale Agentur für Krebsforschung (IARC) hat Cumol ebenfalls als mögliches Karzinogen für den Menschen (Gruppe 2B) eingestuft.
Die Arbeitsschutzbehörde (OSHA) und die American Conference of Governmental Industrial Hygienists (ACGIH) haben einen 8-Stunden-zeitgewichteten durchschnittlichen zulässigen Expositionsgrenzwert und einen Grenzwert von 50 ppm (245 mg/m³) festgelegt.
Akute Effekte sind zwar im Allgemeinen reversibel, die langsame Einleitung und Eliminierung der dämpfenden Wirkung auf das zentrale Nervensystem deuten jedoch auf potenzielle kumulative Risiken hin.
Referenzen
1. Hwang, S.Y. and Chen, S.S. (2010). Cumene. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0321130519030821.a01.pub3
2. Abdolmaleki, G.; Bayrami, Z. Cumene. In Encyclopedia of Toxicology, 4th ed.; Wexler, P., Ed.; Academic Press, 2024; pp 337–343. DOI: 10.1016/B978-0-12-824315-2.00295-5
3. Dimian, A.C. and Bildea, C.S. (2008). Alkylation of Benzene by Propylene to Cumene. In Chemical Process Design (eds A.C. Dimian and C.S. Bildea). https://doi.org/10.1002/9783527621583.ch6
4. Gollapudi, B. B.; Williams, A. L.; Bus, J. S. „A review of the genotoxicity of the industrial chemical cumene.“ Mutat. Res./Rev. Mutat. Res., 2021, 787, 108364. DOI: 10.1016/j.mrrev.2021.108364
5. Schmidt, R., Griesbaum, K., Behr, A., Biedenkapp, D., Voges, H.-W., Garbe, D., Paetz, C., Collin, G., Mayer, D. and Höke, H. (2014). Hydrocarbons. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a13_227.pub3
