Carbazol: Eigenschaften, Herstellung und Verwendung

Carbazol ist ein heterozyklischer aromatischer Kohlenwasserstoff mit der chemischen Formel C12H9N. Es wurde erstmals 1872 von Graebe und Glaser aus Kohlenteer isoliert. Seine Struktur besteht aus einem Dibenzopyrrol, das aus einem fünfgliedrigen stickstoffhaltigen Ring besteht, der mit zwei Benzolringen verbunden ist.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Carbazol
Carbazol ist ein weißer bis hellgelber kristalliner Feststoff mit deutlichem Geruch. Zu seinen wichtigsten physikalischen Eigenschaften gehören:
- Molmasse: 167,21 g/mol
- Schmelzpunkt: 246 °C
- Siedepunkt: 354,8 °C bei 101,3 kPa
- Dichte: 1,1035 g/cm³ bei 18 °C
- Kristallmorphologie: Platten oder Tabellen; sublimierbar
- Löslichkeit:
- Gut löslich: Aceton, Pyridin
- Mäßig löslich: Diethylether, Ethanol
- Schwer löslich: Chloroform, Essigsäure, Kohlenstofftetrachlorid und Kohlenstoffdisulfid.
- Sehr gut löslich: konzentrierte Schwefelsäure
- Praktisch unlöslich: Wasser (≈ 1 mg/L bei 25 °C)
- Thermodynamische Eigenschaften:
- Schmelzwärme: 176,3 kJ/kg
- Verbrennungswärme: 3,719 × 10⁴ kJ/kg bei 25 °C
2. Chemische Reaktivität von Carbazol
Carbazol weist aufgrund seiner aromatischen Natur und des freien Elektronenpaars an seinem Stickstoffatom eine vielfältige Reaktivität auf. Hier ist eine Aufschlüsselung seiner wichtigsten chemischen Reaktionen:
1. N-Substitution und Alkylierung
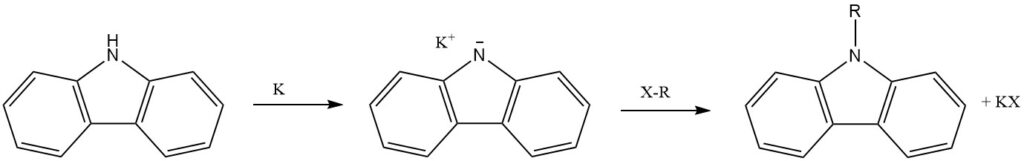
Der N-Wasserstoff von Carbazol, der als sekundäres Amin fungiert, lässt sich leicht durch Alkalimetalle (Li, Na und K) ersetzen. Dies führt durch weitere Reaktionen zur Einführung weiterer funktioneller Gruppen.
Das N-Atom von Carbazol kann alkyliert werden, wodurch N-Alkylsubstituenten mit unterschiedlichen Eigenschaften eingeführt werden.
2. Halogenierung, Nitrierung und Sulfonierung

Elektrophile Substitutionsreaktionen wie Halogenierung, Nitrierung und Sulfonierung zielen aufgrund ihrer höheren Elektronendichte bevorzugt auf die 3- und 6-Positionen am Carbazolring ab. Für die weitere Substitution an der 1-, 8- und anderen Positionen sind strenge Bedingungen erforderlich, was zu 1,3,6- und 1,3,6,8-Derivaten führt.
Es kann auch Alkylierungs– und Acylierungsreaktionen am aromatischen Ring eingehen.
3. Hydrierung
Carbazol lässt sich leicht hydrieren und ergibt teilweise oder vollständig gesättigte Derivate. Je nach Reaktionsbedingungen können 1,2,3,4-Tetrahydro-, Hexahydro- oder sogar Dodecahydrocarbazol entstehen.
4. Oxidation
Durch Oxidation mit starken Oxidationsmitteln wie Chromaten oder Permanganaten wird der aromatische Ring gespalten, wobei je nach Spaltstelle unterschiedliche Dicarbazylprodukte entstehen. 3,3′-Dicarbazyl wird durch Chromatoxidation gebildet, während 9,9′-Dicarbazyl durch Oxidation mit Permanganat erhalten wird.
5. Carboxylierung

Durch Behandlung mit Alkalimetallcarbonaten und Kohlendioxid können Carbonsäuregruppen in den Carbazolring eingeführt werden. Die Position der Carboxylgruppe (3- oder 1-) hängt von der Reaktionstemperatur ab.
3. Herstellung von Carbazol
Kernpunkte:
- Carbazol ist im Kohlenteer leicht verfügbar und kann mit verschiedenen Methoden vom Anthracen abgetrennt werden.
- Es gibt synthetische Wege, die jedoch derzeit weniger wettbewerbsfähig sind als die Steinkohlenteergewinnung.
- Die moderne Hochtemperatur-Schmelzkristallisation bietet einen vielversprechenden Ansatz für eine nachhaltige Carbazolproduktion
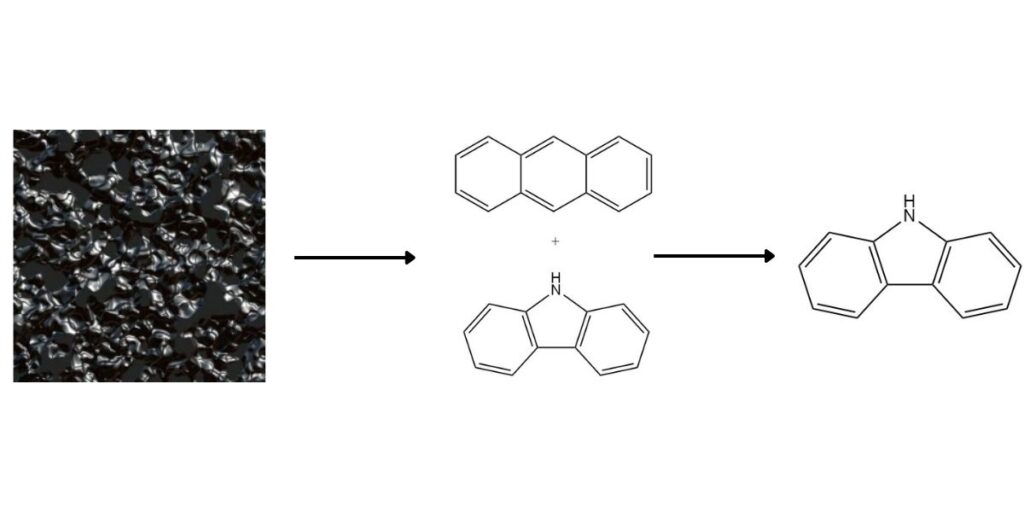
Carbazol ist als wertvolle heterozyklische aromatische Verbindung in Hochtemperatur-Kohlenteer in einer durchschnittlichen Konzentration von 0,9 % vorhanden. Während es traditionell als Nebenprodukt bei der Anthracenproduktion anfällt, gibt es mehrere Methoden, die eine spezielle Rückgewinnung von Carbazol ermöglichen.
1. Trennung von Anthracen:
Der höhere Siedepunkt und die unterschiedliche Löslichkeit von Carbazol erleichtern seine Trennung vom Anthracen. Zu den gängigen Methoden gehören:
- Extraktion oder Komplexierung: Verwendung von Lösungsmitteln wie Pyridin, Ketonen, Benzol/Methanol-Gemische oder spezifische Wirkstoffe wie N-Methylpyrrolidon, Dimethylacetamid, Dialkyl Sulfoxide oder Dialkylformamide.
- Azeotrope Destillation: Verwendung von Ethylenglykol, um die Bildung eines Azeotrops mit Carbazol auszunutzen und eine Trennung durch fraktionierte Destillation zu ermöglichen.
- Selektive Hydrierung: Umwandlung von Anthracen in hydrierte Derivate, ohne dass Carbazol beeinträchtigt wird.
2. Chemische Trennung:
In der Vergangenheit wurden zur Carbazol-Trennung Methoden wie Kaliumhydroxid oder konzentrierte Schwefelsäurefusion verwendet. Ihre wirtschaftliche Rentabilität hat jedoch abgenommen.
3. Reinigung aus Pyridin-Mutterlaugen:
Pyridin-Mutterlaugen, die bei der Anthracen-Reinigung erzeugt werden, können konzentriert und aus Chlorbenzol umkristallisiert werden, um reines Carbazol zu ergeben.
4. Synthesewege für Carbazol
Für die Carbazolproduktion gibt es mehrere synthetische Methoden, deren industrielle Bedeutung im Vergleich zur Kohlenteergewinnung jedoch begrenzt ist:
- Umwandlung von Cyclohexanonazin in Octahydrocarbazol, gefolgt von Dehydrierung.
- Reduktive Cyclisierung von 2-Nitrobiphenyl.
- Dehydrierung und Cyclisierung verschiedener Vorläufer wie Diphenylamin, o-Aminobiphenyl oder N-Cyclohexylidenanilin.
Eine moderne und effiziente Methode zur Carbazolrückgewinnung aus Kohlenteer ist die lösungsmittelfreie Hochtemperatur-Schmelzkristallisation. Dieses Verfahren bietet Vorteile hinsichtlich Umweltverträglichkeit und Wirtschaftlichkeit.
4. Verwendung von Carbazol
Obwohl Carbazol hauptsächlich aus Kohlenteer gewonnen wird (über 3.500 Tonnen pro Jahr), wird es in verschiedenen Branchen verwendet, darunter: Farbstoffe und Pigmente, Pestizide und Polymere, optische Materialien und Licht -Emittierende Dioden und im Bauwesen und in Klebstoffen.
Farbstoffe und Pigmente:
- Hydron Blue: die Kondensation von Carbazol mit p-nitrosophenol und anschließende schwefelung ergibt diesen kommerziell wichtigen blauen schwefelfarbstoff.
- Naphtol AS und Anthraquinon-Farbstoffe: Carbazol dient als Vorläufer für verschiedene Azo- und Anthrachinonfarbstoffe, die in Textil- und Industrieanwendungen verwendet werden.
- Styrylfarbstoffe: N-Ethylcarbazol ermöglicht die Synthese lebendiger Styrylfarbstoffe, die in verschiedenen Materialien und Produkten verwendet werden.
- Dioxazinfarbstoffe und -pigmente: N-Ethyl-3-aminocarbazol spielt eine Schlüsselrolle bei der Herstellung dieser wertvollen Farbstoffe für organische Pigmente und Azinfarbstoffe.
- Carbazol trägt zur Produktion der Reaktivfarbstoffe bei, die für ihre starke Bindung an synthetische Fasern bekannt sind.
Pestizide und Polymere:
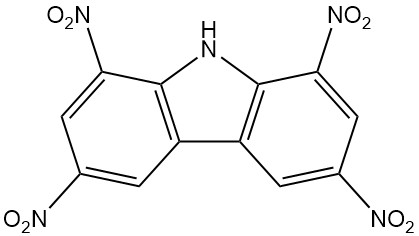
- Nirosan: 1,3,6,8-Tetranitrocarbazol, ein wirksames Insektizid, ist seit 1939 im Handel erhältlich.
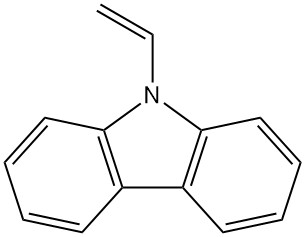
- Poly(vinylcarbazol): Durch die N-Vinylcarbazol-Polymerisation entsteht dieses thermisch und chemisch stabile Polymer (Luvican, Polectron), das für elektrische Anwendungen verwendet wird Sein geringer dielektrischer Verlust und seine Photoleitfähigkeit.
Optische Materialien und Leuchtdioden:
- Photorefraktive Materialien: Methacrylat-Carbazol-Polymere vereinen Photoleitfähigkeit und elektrooptische Eigenschaften und sind somit ideal für die Datenspeicherung mit hoher Dichte, Bildverarbeitung, und Informatik.
- Triplett-Emitter: Carbazolverbindungen finden als Wirtsmaterialien für Triplett-Emitter in organischen Leuchtdioden (OLEDs) Verwendung und steigern deren Effizienz Helligkeit.
Bauwesen und Klebstoffe:
- Novolakharze: Carbazol reagiert mit Phenolen und Formaldehyd unter Bildung dieser hitzebeständigen Polymere, die für Klebstoffe und Beschichtungen wertvoll sind.
- Betonweichmacher: Die Cokondensation von Carbazol mit Phenolen und Formaldehyd und die anschließende Sulfonierung ergeben wirksame Weichmacher für Beton.
Hochleistungspolymere:
- Polyamide: Durch thermische Kondensation von 3,6-Diaminocarbazol mit Dicarbonsäuren entstehen elastische und thermisch stabile Polyamide mit vielfältigen Einsatzmöglichkeiten.
5. Carbazol-Derivate

| Ableitung | CAS-Nummer | Formel | Molmasse (g/mol) | Schmelzpunkt (°C) | Synthese |
|---|---|---|---|---|---|
| N-Ethylcarbazol | 86-28-2 | C14H13N | 195,27 | 68 | Ethylierung von Carbazol mit Diethylsulfat |
| 1,3,6,8-Tetranitrocarbazol | 4543-33-3 | C12H5O8N5 | 347,20 | 312 | Nitrierung von Carbazol mit Salpeter- und Schwefelsäure |
| N-Vinylcarbazol | 1484-13-5 | C14H11N | 193,25 | 65 | Aus Carbazol-Kalium mit Ethylenoxid oder Vinylchlorid oder aus Carbazol und Acetylen |
6. Toxikologie von Carbazol
Carbazol weist eine geringe akute orale Toxizität auf, wobei die LD50-Werte bei Ratten 5000 mg/kg übersteigen. Die intraperitoneale Verabreichung an Mäuse zeigt jedoch eine deutlich niedrigere LD50 von 200 mg/kg, was auf eine routenabhängige Toxizität hindeutet.
Berufsbedingte Carbazol-Exposition wurde mit Follikulitis und Komedonen in Verbindung gebracht, obwohl Tierstudien ein minimales Potenzial für Haut- und Augenreizungen zeigen, selbst unter Photoaktivierung.
Carbazol wird bei Ratten und Kaninchen einer Glucuronidierung unterzogen und anschließend über den Urin ausgeschieden.
Die Fütterung mit hochdosiertem Carbazol (270–1050 mg/kg Körpergewicht/Tag) über 96 Wochen induzierte Leber- und Vormagenkarzinome bei B6C3F1-Mäusen, bei neugeborenen Mäusen wurde jedoch nach intraperitonealen Injektionen keine tumorerzeugende Aktivität beobachtet.
Basierend auf begrenzten Beweisen wird Carbazol von der Internationalen Agentur für Krebsforschung (IARC) in Gruppe 3 (nicht klassifizierbar hinsichtlich Karzinogenität für den Menschen) eingestuft. In verschiedenen Bakterientests zeigte es keine mutagene Aktivität.
9-Ethylcarbazol, ein Derivat, zeigte bei einem Bakterienstamm eine schwache mutagene Wirkung, war bei einem anderen jedoch inaktiv, was auf ein begrenztes mutagenes Potenzial schließen lässt.
Die dermale Anwendung von Carbazol in einer Dosis von bis zu 250 mg/kg Körpergewicht/Tag während der Trächtigkeit führte bei Ratten nicht zu Störungen in der fötalen Entwicklung.
Verweise
- Carbazole; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a05_059.pub2
- Carbazole; – https://www.sigmaaldrich.com/US/en/product/sigma/c5132
- https://en.wikipedia.org/wiki/Carbazole
