Benzotrichlorid: Reaktionen, Herstellung und Verwendung
Benzotrichlorid ist das Produkt, das bei der erschöpfenden Chlorierung der Seitenkette von Toluol entsteht, auch bekannt als (Trichlormethylbenzol, α,α,α-Trichlortoluol, Phenylchlorform).
Die Synthese von Benzotrichlorid wurde erstmals 1858 von L. SCHISCHKOFF und A. ROSING durchgeführt, indem sie die Reaktion zwischen PCl5 und Benzoylchlorid nutzten.
Aufgrund seiner bedeutenden Rolle als entscheidendes Zwischenprodukt bei der Synthese von Säurechloriden (insbesondere Benzoylchlorid), Farbstoffen, Herbiziden, Pestiziden und verschiedenen anderen Produkten wird Benzotrichlorid heute in großem Maßstab hergestellt.
Inhaltsverzeichnis
Physikalische Eigenschaften von Benzotrichlorid
Benzotrichlorid, eine farblose Flüssigkeit mit stechendem Geruch, die Augen und Schleimhäute reizt. Es erzeugt Dämpfe, wenn es feuchter Luft ausgesetzt wird.
Ethanol, Diethylether und Chloroform sind gute Lösungsmittel für Benzotrichlorid. Allerdings ist seine Löslichkeit in Wasser begrenzt und liegt bei nur 0,05 g pro Liter bei 5 °C und 0,25 g pro Liter bei 39 °C. Insbesondere kommt es während des Auflösungsprozesses in Wasser zu einer Hydrolyse.
Die Menge an Chlor, die in 100 Gramm Benzotrichlorid gelöst werden kann, ist temperaturabhängig. Bei 30 °C beträgt die Löslichkeit 5,1 Gramm, bei 50 °C sinkt sie auf 3,4 Gramm und bei 100 °C sinkt sie weiter auf 1,3 Gramm.
Die physikalischen Eigenschaften von Benzotrichlorid sind folgende:
- Molmasse = 195,48 g/mol
- Siedepunkt = 220,7 °C
- Schmelzpunkt = -4,5 °C
- Dichte = 1,373 bei 20 °C
- Brechungsindex = 1,558 bei 20 °C
- Flammpunkt = 108 °C
- Zündtemperatur = 420 °C
Chemische Reaktionen von Benzotrichlorid
Benzoesäure wird entweder durch saure oder alkalische Hydrolyse von Benzotrichlorid hergestellt, während durch teilweise Hydrolyse Benzoylchlorid entsteht.
Wenn Benzotrichlorid mit Carbonsäuren reagiert, entstehen die entsprechenden Säurechloride sowie Benzoylchlorid.
Die Kondensation von Benzotrichlorid mit Benzol in Gegenwart von Katalysatoren wie FeCl3, AlCl3 oder ZnCl2 führt zur Bildung von Diphenyl- und Triphenylmethan.
Durch die Behandlung von Benzotrichlorid mit Flusssäure oder Fluoriden können alle drei Chloratome durch Fluor ersetzt werden.
Durch die Reaktion von Benzotrichlorid mit wasserfreien Alkoholen können Orthoester der Benzoesäure hergestellt werden.
Die Hydrolyse von Benzotrichlorid kann durch Reaktion mit Wasser erreicht werden.
Herstellung von Benzotrichlorid
Für die vollständige Chlorierung der Seitenkette von Toluol kann eine dem Verfahren für Benzylchlorid ähnliche Methode verwendet werden, was die Herstellung von Benzotrichlorid erleichtert. Hierzu wird vor allem die photochemische Chlorierung eingesetzt.
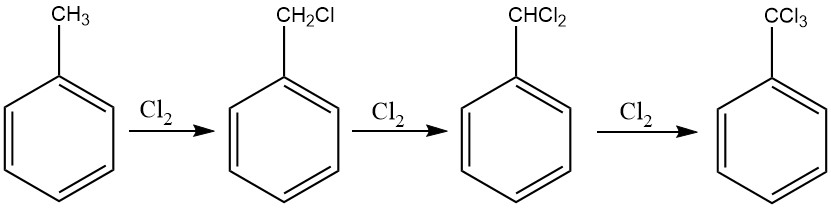
Bei kontinuierlichen Prozessen empfiehlt sich der Einsatz einer Kaskade von sechs bis zehn Reaktoren, um die Bildung kernchlorierter Derivate zu verhindern. Dieser Ansatz ermöglicht die Kontrolle der Chlorzufuhr und stellt sicher, dass Benzotrichlorid mit minimalen Mengen an Benzalchlorid erhalten wird.
Abbildung 1 zeigt eine kontinuierlich betriebene Anlage zur Herstellung von Benzotrichlorid. Frisches Toluol wird durch den Vorchlorierer (R0) geleitet und gelangt anschließend in den ersten Reaktor der Kaskade aus acht Reaktoren. Die Reaktoren werden mit abnehmenden Chlormengen beschickt.
Typischerweise wird der letzte Reaktor in der Kaskade mit reinem Stickstoff gespült, um restliches Chlorgas zu entfernen. Zum Zweck der Abgasentfernung (durch gestrichelte Linien angedeutet) können die Reaktoren in drei Gruppen eingeteilt werden.
Die Reaktoren R1-R3 erhalten eine präzise Chlordosierung, wobei der größte Teil davon während der Reaktion verbraucht wird. Das Abgas aus den Reaktoren R4–R8 enthält aufgrund der fortgeschrittenen Chlorierung des Materials in diesen Reaktoren eine höhere Konzentration an Chlor. Folglich wird dieses Gas in die Reaktoren R1 und R2 zurückgeführt.
Ebenso wird das Abgas aus den Reaktoren R1-R4 in den Vorchlorierer (R0) eingeleitet, der den höchsten Anteil an Toluol enthält, um verbleibende Chlorspuren zu entfernen. Das Abgas aus Reaktor R0 ist somit chlorfrei und wird zum Wäschersystem zur Entfernung von HCl geleitet.
Durch die genaue Steuerung der Zufuhr von Chlor und Toluol erreicht diese Technik eine nahezu vollständige Umwandlung von Toluol in Benzotrichlorid, wodurch Abgase entstehen, die überwiegend aus Chlorwasserstoff und Stickstoff bestehen und kein Chlor enthalten.

Um die Ausbeute und Reaktionsgeschwindigkeit zu steigern, ist der Ausschluss von Sauerstoff zwingend erforderlich und es können katalytische Mengen Brom, Ammoniumchlorid oder eine Kombination aus Phosphortrichlorid und Bis(dimethylthiocarbamoyl)disulfid zugesetzt werden.
Die Chlorierung von Methylbenzolen in den entsprechenden Trichloriden als Lösungsmittel soll eine hohe Ausbeute an hochreinen Produkten liefern und stellt eine alternative Methode zur Herstellung von Benzotrichlorid dar.
Ein weiteres Herstellungsverfahren für Benzotrichlorid beinhaltet die Chlorierung von Dibenzylether, einem Nebenprodukt, das bei der Umwandlung von Benzylchlorid in Benzylalkohol anfällt. Bei diesem Chlorierungsprozess entsteht ein Gemisch aus Benzotrichlorid und Benzoylchlorid, das anschließend zu reinem Benzoylchlorid verarbeitet werden kann.
Dieser Ansatz verbessert indirekt die Wirtschaftlichkeit der Benzylalkoholproduktion.
Verwendung von Benzotrichlorid
Die Hauptanwendung von Benzotrichlorid liegt in seiner Verwendung zur Herstellung von Benzoylchlorid durch teilweise Hydrolyse mit Wasser oder Reaktion mit Benzoesäure.
Benzotrichlorid findet auch kleinere Anwendungen in verschiedenen Industrien. Es wird bei der Herstellung von Pharmazeutika und Agrochemikalien eingesetzt, insbesondere nach einer Umwandlung in Benzotrifluorid. Darüber hinaus dient es als Vorstufe für die Synthese von UV-Stabilisatoren und Farbstoffen vom Benzophenon-Typ.
Referenz
- Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.o04_o01.pub2
