4-Nitrophenol: Herstellung, Reaktionen und Verwendung
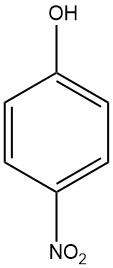
4-Nitrophenol (auch bekannt als p-Nitrophenol oder 4-Hydroxynitrobenzol) ist eine aromatische Verbindung mit der chemischen Formel C6H5NO3. Es ist ein Nitrophenol, was bedeutet, dass es sowohl eine Nitrogruppe (-NO2) als auch eine Hydroxylgruppe (-OH) enthält, die an einen Benzolring gebunden sind.
4-Nitrophenol ist ein gelber bis farbloser kristalliner Feststoff mit süßem, phenolischem Geruch. Es ist in Wasser, Ethanol und anderen organischen Lösungsmitteln löslich.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von 4-Nitrophenol
P-Nitrophenol hat eine metastabile α-Form, die in kristalliner Form beobachtet werden kann, wenn Toluol auf über 63 °C erhitzt wird. Die stabilere β-Form wird erhalten, wenn Toluol unter 63 °C abgekühlt wird. P-Nitrophenol ist mit Wasserdampf nicht leicht flüchtig, aber in Wasser löslicher als sein Ortho-Isomer.
Einige der physikalischen Eigenschaften von 4-Nitrophenol sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| Chemische Formel | C6H5NO3 |
| Molmasse | 139,11 g/mol |
| Aussehen | Gelber, nadelartiger kristalliner Feststoff |
| Schmelzpunkt | 114°C |
| Siedepunkt | 216°C |
| Löslichkeit in Wasser (100°C) | 30 % |
| Löslichkeit in Wasser (25°C) | 16 g/L |
| Dichte | 1,48 g/cm³ |
| pKa | 7.15 |
| Flammpunkt | 105°C |
| Natriumsalz-Zersetzungstemperatur | 156°C |
2. Chemische Reaktionen von 4-Nitrophenol
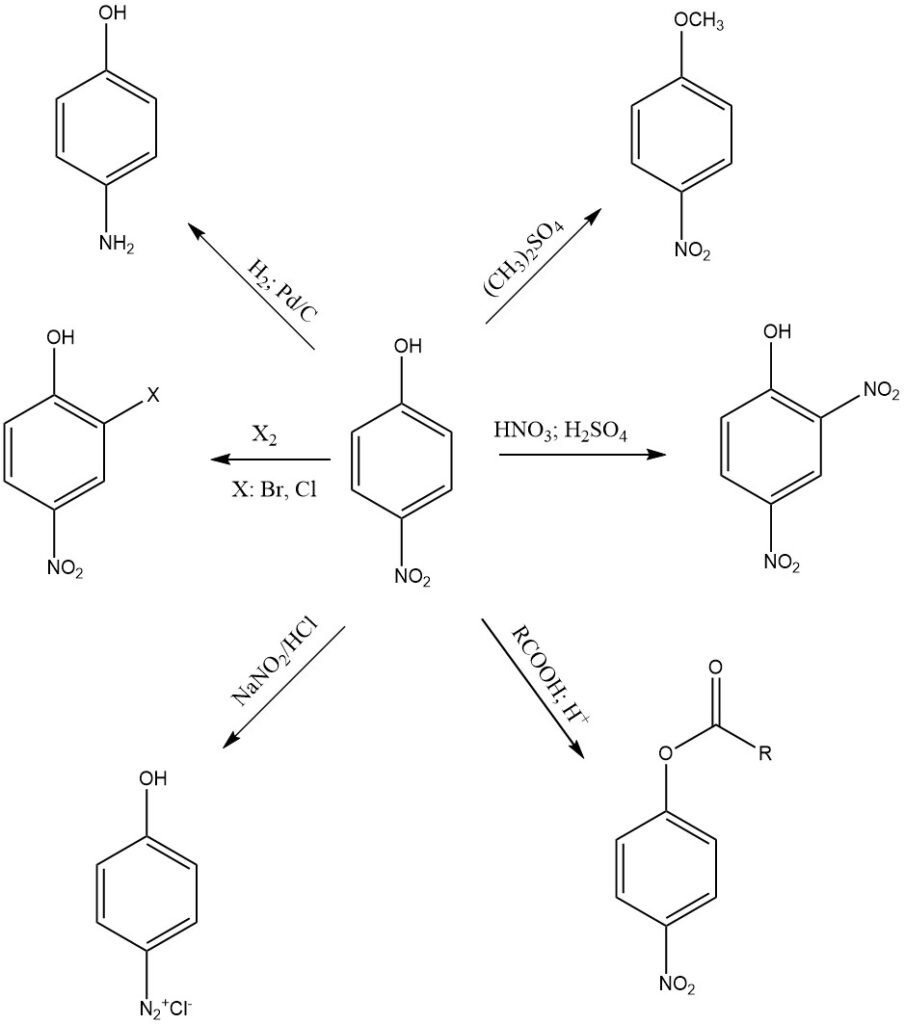
4-Nitrophenol ist eine relativ stabile Verbindung. Zu seiner Reaktivität trägt das Vorhandensein von Nitro- und Hydroxylgruppen am aromatischen Ring bei, so dass es eine Vielzahl chemischer Reaktionen eingehen kann, wie folgt:
Die Ermäßigung
Eine der häufigsten Reaktionen von 4-Nitrophenol ist die Reduktion der Nitrogruppe zu Amin. 4-Nitrophenol kann unter verschiedenen Bedingungen zu 4-Aminophenol reduziert werden. Zu den üblichen Reduktionsmitteln gehören Natriumdithionit, Zink und Eisen in konzentrierter HCl oder Wasserstoffgas.
Alkylierung
4-Nitrophenol kann zu verschiedenen Derivaten alkyliert werden. Zu den üblichen Alkylierungsmitteln gehören Dimethylsulfat und Methyliodid. Alkylierte 4-Nitrophenol-Derivate werden häufig als Zwischenprodukte bei der Synthese anderer organischer Verbindungen verwendet.
Veresterung
4-Nitrophenol kann verestert werden, wobei es mit Carbonsäuren unter Bildung von Estern reagiert. Diese Reaktion wird typischerweise durch Säure wie Schwefelsäure (H2SO4) katalysiert.
4-Nitrophenol wird in Gegenwart von Salpetersäure und Schwefelsäure zu 2,4-Dinitrophenol nitriert. Durch weitere Nitrierung entsteht Pikrinsäure, die ein stärkerer Sprengstoff als 2,4-Dinitrophenol ist und in einer Vielzahl von industriellen und militärischen Anwendungen eingesetzt wird.
Diazotierung
4-Nitrophenol kann auch an Diazotierungsreaktionen teilnehmen, einem Prozess, der die Aminogruppe (-NH2) von 4-Aminophenol in ein Diazoniumsalz (-N2+X-) umwandelt. Diese Reaktion wird bei der Synthese verschiedener Farbstoffe und aromatischer Verbindungen mit Diazogruppen verwendet.
Säure-Base-Reaktionen
4-Nitrophenol ist aufgrund seiner Hydroxylgruppe sauer. Es reagiert mit starken Basen wie Natriumhydroxid unter Bildung von 4-Nitrophenolat-Ionen.
4-Nitrophenol unterliegt auch aromatischen Ringreaktionen wie Halogenierung, Sulfonierung, Acylierung und Alkylierung, insbesondere in der ortho-Position der (-OH)-Gruppe.
3. Herstellung von 4-Nitrophenol
3.1. Hydrolyse von 4-Chlornitrobenzol
4-Chlornitrobenzol wird in einem Autoklaven mit 8,5 %iger Natronlauge erhitzt. Die exotherme Reaktion erreicht 170 °C und hält 8 Stunden lang an. Die Lösung wird dann abgekühlt und angesäuert, um 4-Nitrophenol in einer Ausbeute von 95 % zu ergeben.

Der Prozess produziert hochreines 4-Nitrophenol und umfasst die folgenden Schritte:
- Basische Hydrolyse des 4-Chlornitrobenzols
- Konzentration des Reaktionsmediums
- Durch Ansäuern erhält man aus seinem Salz die 4-Nitrophenol-Verbindung
- Flüssig/Flüssig-Dekantierung zur Entfernung der nach der Ansäuerung erhaltenen wässrigen Phase
- Kristallisation der 4-Nitrophenol-Verbindung
- Trennung des Produkts
Der Konzentrationsschritt entfernt flüchtige Verunreinigungen und der Dekantierungsschritt entfernt wasserlösliche Verunreinigungen. Der Kristallisationsschritt reinigt das 4-Nitrophenol weiter, indem alle verbleibenden Verunreinigungen entfernt werden.
Bei diesem Verfahren entsteht ein 4-Nitrophenol mit einem geringen Gehalt an fettlöslichen Verunreinigungen (wie 4-Chlornitrobenzol) und wasserlöslichen Verunreinigungen (wie Natriumchlorid und Natriumsulfat). 4-Nitrophenol ist außerdem frei von schwefelhaltigen Verunreinigungen, was für nachfolgende katalytische Hydrierungsreaktionen von Vorteil ist.
3.2. Nitrierung von Phenol
Phenol wird mit Salpetersäure in Gegenwart von Schwefelsäure umgesetzt, um eine Mischung aus 2-Nitrophenol und 4-Nitrophenol zu erzeugen. Anschließend wird die Mischung destilliert, um die beiden Isomere zu trennen. Das aus dem Destillationsschritt erhaltene 4-Nitrophenol wird durch Kristallisation oder Umkristallisation weiter gereinigt.

Ein effizienterer Prozess zur Herstellung von 4-Nitrophenol aus Phenol in einem Salpetersäuremedium ist ein Verfahren, das zwei Schritte umfasst: Nitrosierung und Nitrierung. Im Nitrosierungsschritt wird Phenol mit salpetriger Säure zu p-Nitrosophenol umgesetzt.
Im Nitrierungsschritt wird p-Nitrosophenol mit Salpetersäure zu 4-Nitrophenol umgesetzt. Das Verfahren wird in einem Salpetersäuremedium mit einer Konzentration im Bereich von 5 bis 30 Gew.-% durchgeführt und die Temperatur wird während der Nitrosierung im Bereich von 0–10 °C und während der Nitrierung im Bereich von 15–30 °C gehalten.
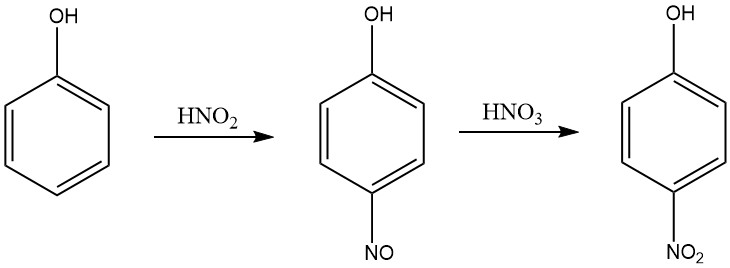
Die salpetrige Säure entsteht in der wässrigen Salpetersäure durch Zugabe von Stickoxiden wie Stickoxid, Stickstofftetroxid oder Stickstofftrioxid. Das 4-Nitrophenol wird durch Kristallisation aus dem Reaktionsgemisch abgetrennt.
Dieses Verfahren ist vorteilhaft, da es 4-Nitrophenol mit einem geringen Gehalt an ortho-Isomeren produziert.
4. Verwendung von 4-Nitrophenol
Die Reduktion von 4-Nitrophenol zu 4-Aminophenol wird seltener eingesetzt, da Verfahren zur direkten Reduktion von Nitrobenzol häufiger vorkommen.
4-Nitrophenol reagiert mit Dialkylthiophosphorsäurechloriden bei 125 °C in Chlorbenzol und bildet eine Gruppe von Insektiziden, einschließlich Parathion. Diese Verbindung wurde jedoch durch weniger toxische Alternativen wie Methylparathion und verwandte Substanzen ersetzt.
4-Nitrophenol reagiert mit 4-Chlor-3-nitrobenzotrifluorid unter Bildung von Fluordifen, das mit Nitrofen verwandt ist. Dieses Herbizid wird zur Behandlung von gebohrten Reisernten eingesetzt.
4-Nitrophenol wird in anderen Anwendungen verwendet, darunter:
- Pharmazeutika: 4-Nitrophenol wird als Zwischenprodukt bei der Synthese von Paracetamol (auch bekannt als Paracetamol) verwendet, einem weit verbreiteten rezeptfreien Schmerzmittel und Fiebersenker.
- Fungizide: 4-Nitrophenol ist eine Vorstufe für einige Fungizide wie Dinocap und Binapacryl.
- Farbstoffe: 4-Nitrophenol wird zur Herstellung einer Vielzahl von Farbstoffen verwendet, darunter gelbe, orange und rote Farbstoffe.
- Ledergerbung: 4-Nitrophenol wird zum Abdunkeln von Leder verwendet.
5. Toxikologie von 4-Nitrophenol
| Belichtung | LD50 |
|---|---|
| Dermal, Meerschweinchen | >1 g/kg |
| Oral, Maus | 282 mg/kg |
| Mündlich, Ratte | 202 mg/kg |
| Haut, Ratte | 1024 mg/kg |
| Inhalation, Ratte | > 4,7 mg/l/4H |
| Hautsensibilisierung, Meerschweinchen | Keine sensibilisiert |
- Akute Auswirkungen: Das Einatmen oder Verschlucken von 4-Nitrophenol kann Kopfschmerzen, Schläfrigkeit, Übelkeit und Zyanose (blaue Farbe in Lippen, Ohren und Fingernägeln) verursachen. Kontakt mit den Augen kann zu Reizungen führen.
- Chronische Wirkungen: Über die chronischen Wirkungen von 4-Nitrophenol bei Menschen oder Tieren durch Inhalation oder orale Exposition liegen keine Informationen vor.
- Auswirkungen auf die Fortpflanzung/Entwicklung: Über die Auswirkungen von 4-Nitrophenol auf die Fortpflanzung oder Entwicklung beim Menschen liegen keine Informationen vor.
- Krebsrisiko: Über die krebserzeugende Wirkung von 4-Nitrophenol beim Menschen liegen keine Informationen vor. In einer Studie des National Toxicology Program (NTP) gab es keine Hinweise auf eine krebserzeugende Wirkung bei Mäusen, die 18 Monate lang dermal 4-Nitrophenol ausgesetzt waren.
Verweise
- Nitro Compounds, Aromatic, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
- Process for preparation of a nitrophenol. – https://patents.google.com/patent/US20080045756A1/en
- Preparation of p-nitrophenols. – https://patents.google.com/patent/US3510527A/en
- https://www.epa.gov/sites/default/files/2016-09/documents/4-nitrophenol.pdf
- https://fscimage.fishersci.com/msds/96371.htm
