Le peroxyde de méthyléthylcétone (PMEC) est un composé chimique liquide de la famille des peroxydes de cétone utilisé pour initier la polymérisation des résines polyester insaturé et vinylester à différentes températures de durcissement.
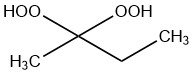
C’est le produit de condensation de la réaction du peroxyde d’hydrogène et de la 2-butanone et est disponible sous forme de structure à chaîne ouverte et cyclique.
1. Propriétés physiques du peroxyde de méthyléthylcétone (PMEC)
Le peroxyde de méthyléthylcétone pur est un produit liquide avec une énergie de dissociation d’env. 100 kJ/mol. C’est un peroxyde soluble dans l’eau.
La formulation commerciale est une solution à ≈ 30 % dans du 1-isopropyl-2,2-diméthyltriméthylène-diisobutyrate.
Densité = 1,01
Indice de réfraction (20 °C) = 1,437
Teneur en oxygène actif = 9,3 %
2. Propriétés chimiques du peroxyde de méthyléthylcétone (PMEC)
La thermolyse du peroxyde de méthyléthylcétone donne un mélange complexe de produits, parmi lesquels la cétone, l’eau, le dioxyde de carbone, des acides, d’alcool et d’alcane.
La décomposition du peroxyde de méthyléthylcétone en acide carboxylique est accélérée par la catalyse acide. De plus, ce peroxyde est sensible aux métaux. La décomposition est induite par des promoteurs de métaux de transition tels que les ions cobalt.
En présence de sels de fer ou de cuivre, le peroxyde de méthyléthylcétone cyclique subit une réaction d’ouverture de cycle pour donner des acides carboxyliques.
La réaction du peroxyde d’hydrogène avec la méthyléthylcétone entraîne la formation d’hydroperoxydes d’α-hydroxyalkyle, qui réagissent facilement formant autres produits de condensation. Ainsi, les peroxydes de cétone sont toujours obtenus sous la forme d’un mélange de différentes espèces peroxydiques.
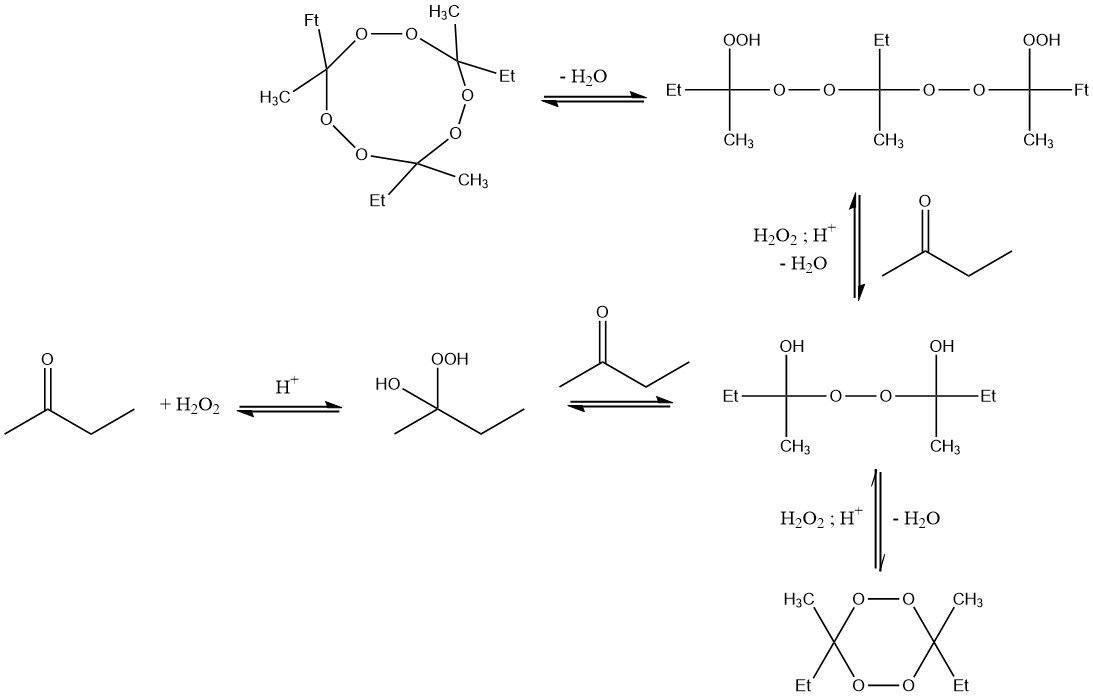
Le degré de condensation dépend des conditions de réaction, en particulier de la concentration de peroxyde d’hydrogène et de butanone, de la température de réaction, du temps et de la quantité d’acide.
Les composés les plus stables et les plus répandus sont les espèces monomères et dimères. Les dérivés hautement condensés constituent généralement une petite fraction.
De plus, des produits de condensation cycliques trimères peuvent se former au cours de la réaction. Ces composés sont sensibles à la température et potentiellement explosifs lorsqu’ils sont à l’état solide.
Pour assurer la stabilité, les formulations commerciales de peroxyde de méthyléthylcétone peuvent inclure des bases amines pour l’ajustement du pH, empêchant efficacement la condensation en substances potentiellement dangereuses.
3. Production de peroxyde de méthyléthylcétone (PMEC)
Le peroxyde de méthyléthylcétone peut être préparé soit par réaction du peroxyde d’hydrogène avec la méthyléthylcétone, soit par auto-oxydation.
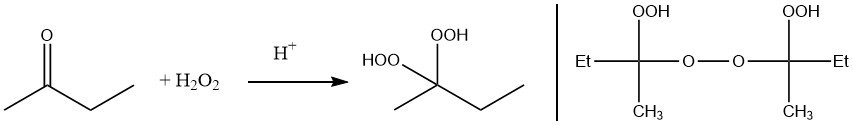
Selon les données de 2016, l’utilisation des peroxydes de cétone dans le secteur des plastiques a atteint environ 60 000 tonnes métriques dans le monde. Cela implique que les peroxydes de cétone représentaient 25% de la consommation totale de peroxydes dans l’industrie des plastiques à l’échelle mondiale.
Il convient de noter que ces peroxydes particuliers trouvent une application presque exclusive dans le processus de durcissement des matériaux en polyester insaturé (UP).
En raison de ses caractéristiques potentiellement détonantes, le PMEC n’est disponible que sous forme de solutions hautement flegmatisées avec une teneur en peroxyde d’environ 30 %.
Le procédé de production consiste à ajouter 70 % de peroxyde d’hydrogène à une solution contenant du phtalate de dibutyle, de la méthyléthylcétone et de HNO3 65 % à une température de 30°C pendant une durée de 1 heure. La solution réactionnelle est encore agitée pendant 30 minutes supplémentaires à la même température.
Après l’étape de séparation des phases, la matière première résultante est combinée avec de l’alcool diacétonique, de la collidine et du peroxyde d’hydrogène à 70 %.
Le procédé de synthèse traditionnel pour produire le peroxyde de cétone cyclique trimérique de butanone implique la pyrolyse de peroxydes de tricycloalkylidène. Dans cette méthode, la 2-butanone, le peroxyde d’hydrogène et l’acide réagissent pour former le peroxyde de 1-hydroxyperoxy-1´-hydroxy-dicycloalkylidène, qui subit ensuite une condensation en présence d’un acide fort, donnant un composé cyclique avec un rendement approximatif de 60 %.
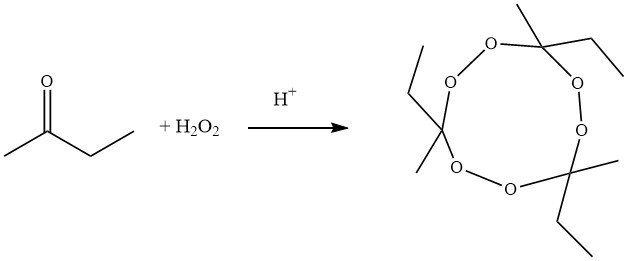
Les méthodes modernes, d’autre part, utilisent la conversion de la 2-butanone avec du peroxyde d’hydrogène en présence d’acide nitrique, d’isoalcanes et d’acide acétique comme agent solubilisant. Après la synthèse, le peroxyde d’hydrogène et les hydroperoxydes restants sont réduits à l’aide de sulfite de sodium. Le peroxyde de cétone trimère est obtenu avec un rendement de 90% et le rapport trimère sur dimère est d’environ 94:6.
4. Utilisations du peroxyde de méthyléthylcétone (PMEC)
En 2016, une quantité estimée d’environ 250 à 260 millions de tonnes métriques de plastiques a été produite, dont environ 75 % du volume est entré en contact avec des peroxydes organiques au cours du processus de fabrication. Les applications du peroxyde de méthyléthylcétone peuvent être classées en trois segments : la fabrication de polymères, la modification de polymères et les applications non polymères.
La fabrication de polymères implique l’utilisation de peroxydes organiques dans divers procédés de polymérisation industrielle tels que la masse, la suspension et la solution. Les principaux polymères de cette catégorie comprennent le PVC, le LDPE, le PS, le PP et le PMMA. La consommation totale de peroxydes pour la fabrication de polymères a été estimée à environ 100 000 tonnes métriques.
4.1. Fabrication de polymères
Le PVC, largement utilisé dans la construction, est un polymère thermoplastique important. Différentes techniques de polymérisation sont utilisées pour la production de PVC, y compris la suspension (S-PVC), la microsuspension (MS-PVC), la masse (M-PVC) et l’émulsion (E-PVC).
Le peroxyde de méthyléthylcétone sert d’initiateur dans tous ces procédés à l’exception du E-PVC, avec un facteur d’entrée allant d’environ 0,05% à 0,1%.
Le LDPE, un autre thermoplastique important, nécessite du peroxyde organique pour la polymérisation radicalaire de l’éthylène gazeux. Le processus se déroule en continu à des pressions allant jusqu’à 3 000 bars, ce qui entraîne des taux de conversion compris entre 10 % et 30 %.
Le polypropylène, le deuxième plus grand thermoplastique au monde, subit une dégradation de la chaîne polymère au cours du processus final d’extrusion/granulation lorsque le PMEC est ajouté. Ce procédé, connu sous le nom de PP à rhéologie contrôlée (cr-PP), conduit à des indices de fluidité (MFI) plus élevés en raison d’une réduction de la masse moléculaire.
Le polystyrène (PS) présente une polyvalence et peut facilement être copolymérisé avec d’autres monomères. Les peroxydes organiques sont couramment utilisés comme initiateurs dans la plupart des qualités de PS, tandis que les procédés thermiques initiés par l’oxygène sont moins fréquents.
Les poly(méth)acrylates (PMMA) et autres esters d’acide (méth)acrylique trouvent des applications dans des industries telles que l’optoélectronique, l’automobile et la construction. Les peroxydes de cétone sont utilisés dans les procédés de polymérisation en masse et en solution, allant généralement de 0,03 % à 0,3 % de la composition totale.
4.2. Traitement des polymères
Le traitement des polymères représente plus de 50 % de la consommation mondiale de peroxyde organique et implique des activités telles que le durcissement des résines de polyester insaturé (UP) et la réticulation des polymères (XL).
4.2.1. UP Durcissement
Les polyesters insaturés utilisent des acides dicarboxyliques insaturés, tels que l’acide fumarique et maléique, pendant l’étape de polycondensation. Le peroxyde de méthyléthylcétone génère des radicaux qui copolymérisent ces polyesters insaturés avec des monomères réactifs comme le styrène ou le méthacrylate de méthyle.
Le durcissement à froid, où des accélérateurs (systèmes redox) sont ajoutés à la résine, permet la décomposition du peroxyde à température ambiante. Deux combinaisons courantes de peroxyde organique/accélérateur sont les sels PMEC/Co2+ et le peroxyde de dibenzoyle/amines aromatiques (diméthylaniline), avec des facteurs d’entrée allant de 2 % à 4 %.
4.2.2. Réticulation des polymères (XL)
La réticulation des polymères est la deuxième application la plus importante après le durcissement UP et représente environ 40 % des peroxydes organiques utilisés dans le traitement des polymères.
Ce procédé trouve des applications dans la fabrication d’élastomères (caoutchoucs) et la réticulation du polyéthylène (PE). Les peroxydes organiques, avec leurs radicaux hautement énergétiques, conviennent aussi bien aux polymères saturés qu’aux élastomères insaturés.
4.3. Applications non polymères
En plus des utilisations liées aux polymères, environ 5 à 6 % du peroxyde de méthyléthylcétone sont utilisés dans diverses applications non polymères, notamment les cosmétiques, la synthèse chimique (production du catéchol), les réactions d’époxydation, les arômes et les parfums.
5. Risques pour la sécurité du peroxyde de méthyléthylcétone
Le peroxyde de méthyléthylcétone (PMEC) possède le potentiel de décomposition spontanée et explosive lorsqu’il est exposé à des stress thermiques ou mécaniques.
Des facteurs tels que les chocs, les impacts, les frottements et la présence d’impuretés telles que des métaux lourds ou des accélérateurs peuvent catalyser ce processus de décomposition. Par conséquent, le PMEC relève du cadre réglementaire des substances explosives.
Il est important de noter que le PMEC est sensible à la température et peut subir une décomposition exothermique. En l’absence de mécanismes de refroidissement efficaces, la température peut augmenter, accélérant ainsi la réaction de décomposition.
À des températures élevées, la décomposition du PMEC peut se produire spontanément et entraîner des risques d’incendie. De plus, si le processus de décomposition a lieu dans un espace confiné, le gaz résultant peut entraîner une augmentation de la pression, entraînant potentiellement des explosions dans les réacteurs, les cuves ou d’autres conteneurs.
De plus, les produits de décomposition volatils du PMEC peuvent contribuer à la formation d’explosions en phase vapeur. Pour garantir un stockage sûr, il est essentiel de limiter la température maximale de stockage en dessous de 30 °C.
Références
- Peroxy Compounds, Organic, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a19_199.pub2
- Production of salt-free and low-water-content methyl ethyl ketone peroxide. – https://patents.google.com/patent/EP0788477B1/en