o-Crésol : propriétés, réactions, production et utilisations

Qu’est-ce que l’o-crésol ?
L’o-crésol, également connu sous le nom de 2-méthylphénol, est un composé organique de formule chimique C7H8O. C’est un solide cristallin incolore à température ambiante, à l’odeur phénolique, et très soluble dans la plupart des solvants organiques.
Table des matières
1. Propriétés physiques de l’o-crésol
L’o-crésol pur est un solide cristallin incolore à température ambiante ; cependant, il vire au jaune ou au brun après un certain temps de stockage. L’o-crésol a une odeur phénolique et absorbe l’humidité de l’air.
L’o-crésol est très soluble dans le phénol et dans de nombreux solvants organiques tels que les alcools aliphatiques, les éthers, le chloroforme et le glycérol. Il est moins soluble dans l’eau que le phénol.
L’o-crésol peut être distillé à la vapeur et forme des azéotropes avec plusieurs composés, par exemple le décane, le 1-décène, le 1-undécène, le dodécane, le 1,2,4,5-tétraméthylbenzène, le divinylbenzène, l’éthylène glycol, le méthyldiéthylène glycol et l’éther éthylique.
Les principales propriétés physiques de l’o-crésol sont résumées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Numéro CAS | [95-48-7] |
| Formule chimique | C7H8O |
| Poids moléculaire | 108,14 g/mol |
| Point de fusion à 101,3 kPa | 30,99 °C |
| Point d'ébullition à 101,3 kPa | 191,00 °C |
| Densité à 25 °C | 1,135 g/cm3 |
| Densité à 50 °C | 1,0222 g/cm3 |
| Viscosité à 50 °C | 3,06 mPa·s |
| Indice de réfraction à 50 °C | 1,5310 |
| Constante diélectrique à 50 °C | 6,00 |
| Conductance spécifique à 50 °C | 0,43 × 10-10 S/cm |
| Tension superficielle à 50 °C | 34,4 × 10-6 N/m |
| Constante de dissociation à 25 °C | 4,8 × 10-11 |
| Température critique | 424,4 °C |
| Pression Critique | 5,01 MPa |
| Densité critique | 384 kg/m3 |
| Capacité thermique cp à 25 °C (gaz) | 127,3 J mol-1 K-1 |
| Capacité thermique cp à 25 °C (solide) | 154,7 J mol-1 K-1 |
| Capacité thermique cp à 50 °C (liquide) | 237,9 J mol-1 K-1 |
| Enthalpie de fusion ΔHm au point de fusion, 101,3 kPa | 15,830 kJ/mol |
| Enthalpie de sublimation ΔHsub à 25 °C, 101,3 kPa | 76,07 kJ/mol |
| Enthalpie de vaporisation ΔHv au point d'ébullition, 101,3 kPa | 45,222 kJ/mol |
| Enthalpie de combustion ΔH°c à 25 °C, 101,3 kPa | - 3696 kJ/mol |
| Enthalpie de formation ΔH°f à 25 °C, 101,3 kPa | -204,8 kJ/mol |
| ΔH°f à 25 °C (gaz), 101,3 kPa | - 128,7 kJ/mol |
| Énergie libre de formation ΔG°f à 25 °C, 101,3 kPa | - 55,7 kJ/mol |
| ΔG°f à 25 °C (gaz) et 101,3 kPa | - 33,0 kJ/mol |
| Entropie S à 25 °C et 101,3 kPa | 165,5 J mol-1 K-1 |
| Entropie S° à 25 °C (gaz) et 101,3 kPa | 352,8 J mol-1 K-1 |
| Solubilité dans l'eau à 25 °C | 2,6 % en poids |
| Solubilité dans l'eau à 100 °C | 4,8 % en poids |
| Coefficient de distribution log P octanol/eau à 25 °C | 1,95 |
| Densité de vapeur (air = 1) | 3,72 |
| Point d'éclair (vase clos) | 81 °C |
| Température d'inflammation | 555 °C |
| Limite inférieure d'inflammabilité dans l'air à 20 °C, 101,3 kPa | 1,3 % vol. |
2. Réactions chimiques de l’o-crésol
L’o-crésol est chimiquement similaire au phénol. C’est un acide faible qui se dissout dans une solution alcaline aqueuse pour former des sels stables à l’eau appelés o-crésolates. Par conséquent, ils peuvent être extraits dans une solution d’hydroxyde de sodium à partir de solvants non miscibles à l’eau.
Le groupe hydroxyle de l’o-crésol peut être éthérifié avec des halogénures d’alkyle, des sulfates de dialkyle, des carbonates de dialkyle et des esters d’acide toluènesulfonique, puis réagir avec des anhydrides d’acyle ou des chlorures d’acyle pour former les esters tolyliques correspondants, généralement appelés esters « o-crésyliques ».
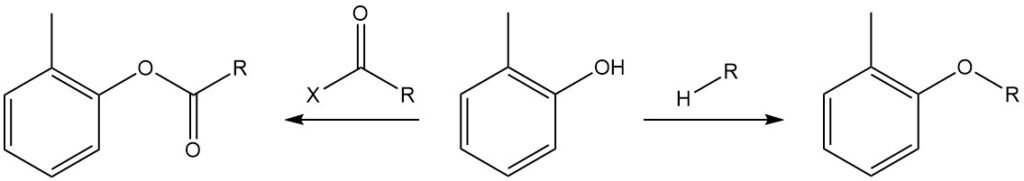
Le groupe OH de l’o-crésol réagit avec les isocyanates pour former des uréthanes.
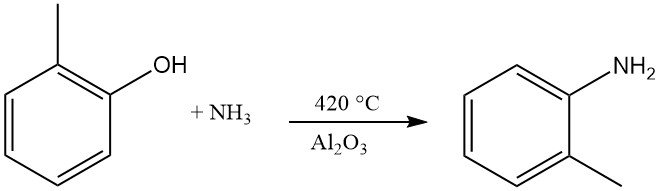
L’o-toluidine est formée par réaction de l’o-crésol avec l’ammoniac à une température de 420 °C et en présence d’Al2O3.
Différents 2-halogénotoluènes peuvent être obtenus en remplaçant le groupe hydroxyle de l’o-crésol. Par exemple, la réaction avec l’oxytétrafluorure de soufre à 150 °C, avec le trichlorure de diphénylphosphine à 220 °C ou avec le tribromure de phosphore à 280 °C produit respectivement le 2-fluoro-, le 2-chloro- ou le 2-bromotoluène correspondants.
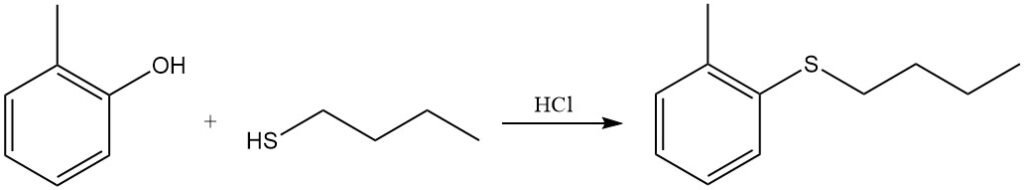
Le groupe OH phénolique de l’o-crésol peut être remplacé par un groupe thiobutyle par réaction avec le butanethiol dans l’acide chlorhydrique.
Le toluène est produit par distillation du crésol avec de la poudre de zinc et peut également être formé par hydrogénation en phase vapeur à 300-400 °C sous pression (jusqu’à 8 MPa) en présence de catalyseurs (métaux de transition et oxyde d’aluminium).
L’hydrodésalkylation de l’o-crésol en phénol peut être réalisée à l’aide de catalyseurs à 400-500 °C ou par voie purement thermique à 500-700 °C.
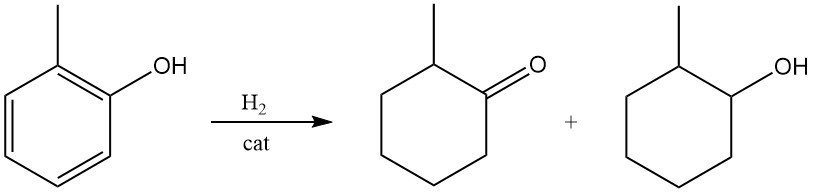
La 2-méthylcyclohexanone ou le 2-méthylcyclohexanol peuvent être formés dans des conditions douces par hydrogénation de l’o-crésol sur des catalyseurs au nickel de Raney ou à un métal noble.
L’o-crésol est sensible à l’oxydation et, selon l’agent oxydant et les conditions de réaction, il produit un grand nombre de composés tels que les hydroquinones, les quinols, les quinones, les cétones cycliques, les furanes, les crésols dimères et trimères et les éthers tolyliques.
Si le groupe hydroxyle de l’o-crésol est protégé par estérification ou éthérification, le groupe méthyle peut être sélectivement mono-, di- ou trichloré, ou oxydé sélectivement en groupe formyle (par exemple, avec du dioxyde de manganèse ou de l’oxygène) ou en groupe carboxyle (acide salicylique) avec une solution de permanganate d’acide.
L’o-crésol peut être directement oxydé par l’oxygène pour donner du 2-hydroxybenzaldéhyde, par exemple dans de l’hydroxyde de sodium méthanolique en présence de quantités catalytiques de tétraarylporphines de fer.
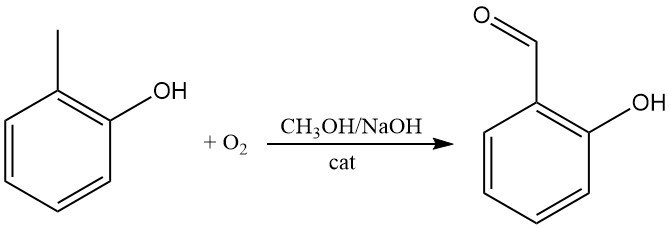
La fusion alcaline de l’o-crésol en présence d’oxyde de plomb ou de dioxyde de manganèse produit directement de l’acide 2-hydroxybenzoïque.
Comme le phénol, l’o-crésol subit facilement une substitution électrophile, principalement en positions o et p par rapport au groupe hydroxyle. Il peut donc être nitré même avec de l’acide nitrique dilué.
La nitrosation, l’halogénation, la sulfonation, l’alkylation et l’acylation se produisent facilement. Lorsque l’o-crésol est chauffé avec des catalyseurs de Friedel-Crafts, tels que AlCl3, il s’isomérise en m-crésol, l’isomère le plus stable thermodynamiquement.
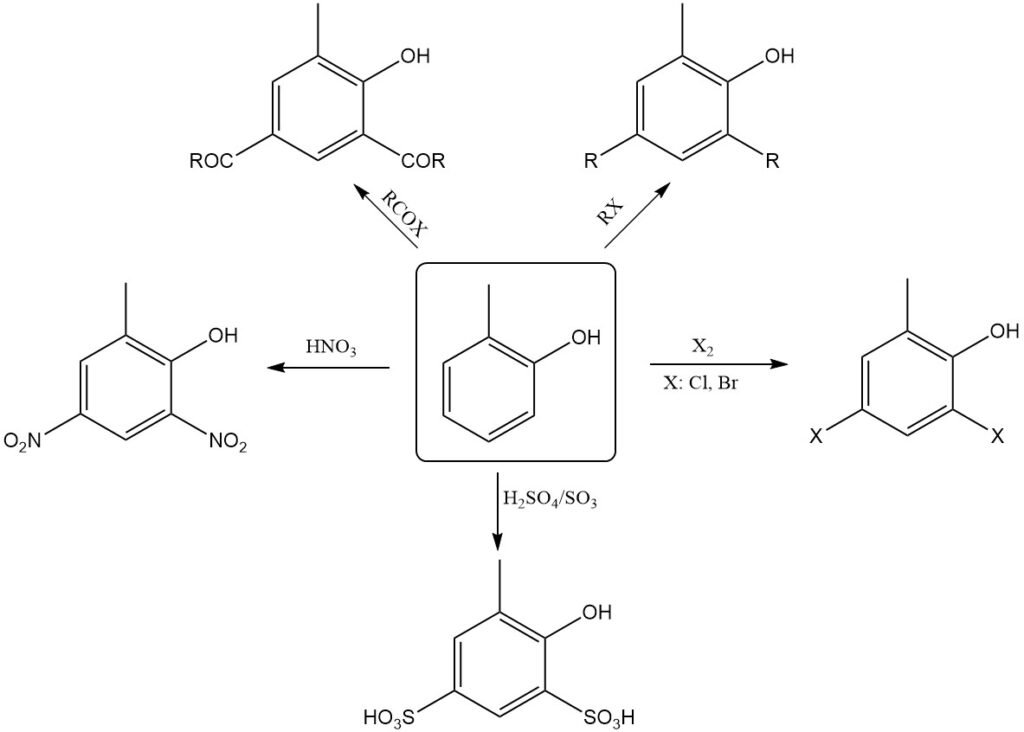
Le chauffage d’o-crésolates de métaux alcalins secs avec du CO2 sous pression produit des acides hydroxy(méthyl)benzoïques (réaction de Kolbe-Schmitt).
La réaction du formaldéhyde avec l’o-crésol en présence d’un alcali à température ambiante produit des alcools hydroxy(méthyl)benzyliques qui, en conditions acides ou à température élevée, se condensent pour former des résines de haut poids moléculaire.
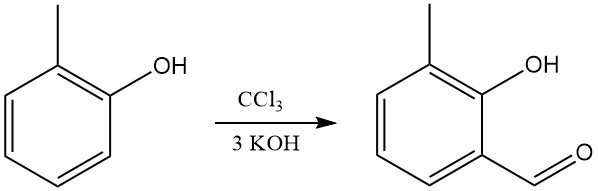
L’o-crésol réagit avec le chloroforme et les alcalis pour former principalement des o-hydroxy(méthyl)benzaldéhydes (synthèse de Reimer-Tiemann).
L’o-crésol présente des propriétés corrosives agressives envers divers métaux, notamment à haute température. L’ampleur de la corrosion est influencée par la présence d’eau dans la solution de crésol.
Les aciers inoxydables au chrome-nickel et les aciers au chrome offrent une résistance limitée à la corrosion par l’o-crésol. Le nickel présente une résistance supérieure à la corrosion, tandis que le tantale est considéré comme totalement résistant.
L’aluminium et ses alliages sont sensibles à une corrosion sévère, surtout à faible teneur en eau. Les alliages de cuivre et de laiton sont à éviter en raison de leur sensibilité à la corrosion.
3. Formation et isolement du crésol
Les crésols (un mélange d’isomères ortho, méta et para) étaient traditionnellement obtenus exclusivement à partir du goudron de houille. Après la Seconde Guerre mondiale, les caustiques usagés de raffinerie sont apparus comme une source supplémentaire. Depuis le milieu des années 1960, la production synthétique de crésols a connu une croissance significative.
Actuellement, le « crésol synthétique » représente environ 60 % de la demande aux États-Unis, en Europe et au Japon, tandis que le « crésol naturel », dérivé du goudron de houille et des caustiques usagées des raffineries, n’en représente qu’environ 40 %.
Un mélange de crésols, de xylénols et de divers autres composés phénoliques est présent dans les eaux usées issues des procédés de craquage, les goudrons et les produits goudronneux issus du craquage thermique, du craquage thermique oxydant et du craquage thermique hydrogénant de matériaux naturels tels que le charbon bitumineux, le lignite, les schistes bitumineux, la tourbe, le bois, la lignine et d’autres biomatériaux.
Les rendements et les quantités relatives de crésols, de xylénols et d’autres phénols produits dépendent non seulement du matériau de départ, mais aussi des conditions du procédé, notamment la température, le temps de séjour, le type de réacteur et le mode opératoire.
Pour le charbon bitumineux, l’hydrogénation produit les quantités les plus élevées, suivie de la carbonisation à basse température, tandis que la cokéfaction à haute température produit les rendements les plus faibles. La gazéification du lignite produit significativement plus de phénols, de crésols et de xylénols que le charbon bitumineux.
De faibles quantités de crésols, de xylénols et d’autres dérivés phénoliques sont également formées lors du craquage catalytique et thermique des fractions pétrolières, en particulier le craquage thermique par cokéfaction.
Actuellement, les crésols et les xylénols sont principalement isolés des goudrons de houille obtenus par cokéfaction à haute température, carbonisation à basse température, gazéification du charbon sous pression Lurgi et caustiques usagées de raffinerie.
3.1. Isolation du crésol des goudrons de houille

Historiquement, le goudron de houille a été une source importante de crésols et de xylénols. Cependant, sa production a régulièrement diminué au cours des quatre dernières décennies, avec une production annuelle estimée entre 30 000 et 40 000 tonnes.
Le goudron de cokerie à haute température, un sous-produit de la production de coke métallurgique, contient environ 0,4 à 0,6 % de phénol, 0,8 à 1 % de crésols et 0,2 à 0,5 % de xylénols.
Au Royaume-Uni, des crésols étaient également produits à partir de goudrons de houille à basse température obtenus lors de la production de combustibles sans fumée. Cependant, la disponibilité de ces goudrons a considérablement diminué dans les années 1990.
Actuellement, la principale source de crésols « naturels » est constituée par les sous-produits liquides issus de la gazéification du charbon bitumineux selon le procédé Lurgi. Ce procédé est principalement utilisé en Afrique du Sud pour la production de gaz de synthèse destiné aux usines Fischer-Tropsch.
Les sous-produits liquides issus de ce procédé, dont la composition est similaire à celle des goudrons à basse température, produisent environ 35 000 à 55 000 tonnes de crésols et de xylénols par an.
Aux États-Unis, les coproduits liquides des gazéificateurs Lurgi de la Dakota Gasification Company, qui gazéifie le lignite pour produire du gaz naturel synthétique, constituent une source importante de crésols « naturels ». La production annuelle estimée de cette source est d’environ 5 000 tonnes d’o-crésol et 11 000 tonnes de m/p-crésol.
Pour isoler les crésols et les xylénols du goudron de houille, l’extraction à la soude caustique est couramment utilisée. Dans le procédé Lurgi à la phénoraffine, l’huile phénique, dont le point d’ébullition est compris entre 180 et 210 °C, et le filtrat d’huile de naphtalène sont extraits pour obtenir les phénols.
Les hydrocarbures et les bases pyridiniques présents dans la soude caustique phénolate brute sont éliminés par distillation à la vapeur, puis le phénol brut est libéré par le dioxyde de carbone.
Les soudes caustiques phénolates issues des effluents des cokeries, qui contiennent principalement du phénol et du crésol, avec des quantités minimes de xylénols, sont souvent incorporées au procédé d’extraction. Ceci peut entraîner une grande variation de la composition du phénol brut obtenu.
Par exemple, le phénol brut obtenu à partir de goudron de houille allemand à haute température peut contenir 15 % d’eau, 30 % de phénol, 12 % d’o-crésol, 18 % de m-crésol, 12 % de p-crésol, 8 % de xylénols et 5 % de triméthylphénols, ainsi que des phénols à point d’ébullition plus élevé.
Afin de purifier davantage les fractions d’acide crésylique des huiles neutres, des bases de goudron, des composés soufrés et des substances phénoliques indésirables, une distillation extractive au diéthylène glycol a été développée par Dakota Gasification Co.
Des entreprises telles que Sasol Phenolics, Merichem Co., Coalite Chemicals, Rütgers-VfT AG, DEZA Corporation et plusieurs sociétés japonaises utilisent ce procédé pour isoler les crésols et les xylénols du goudron de houille.
3.2. Récupération du crésol à partir des caustiques usagées des raffineries
Aux États-Unis, les crésols et les xylénols sont obtenus à partir de fractions de naphta produites lors du craquage catalytique et thermique dans l’industrie pétrolière. Ces fractions contiennent environ 0,1 % de phénols C6-C8. Lors du processus de lavage visant à éliminer les composés soufrés de ces fractions, les crésols et les xylénols sont également extraits à l’aide de solutions alcalines concentrées.
La composition des caustiques de crésylate usagées obtenues par ce procédé est très variable : elles contiennent généralement 20 à 25 % de phénols C6-C8 et 10 à 15 % de composés soufrés.
Jusqu’au début des années 1990, ces caustiques étaient collectées et retraitées par des entreprises spécialisées. Cependant, en raison de la concurrence accrue des producteurs d’o-crésols synthétiques, du durcissement des réglementations environnementales et de la pénurie de matières premières, nombre de ces entreprises ont fermé leurs portes.
Merichem est actuellement le seul grand transformateur de caustiques de raffinerie usagées aux États-Unis.
Chez Northwest Petrochemical, un ancien transformateur, les thiols de la solution alcaline étaient oxydés à l’air pour produire des disulfures, qui étaient ensuite décantés. Les phénols restants étaient précipités au dioxyde de carbone, puis décantés. Les phénols restants étaient extraits avec un solvant organique, puis réextraits avec une phase alcaline aqueuse.
Ce procédé a permis d’obtenir un mélange de phénols contenant environ 20 % de phénol, 18 % d’o-crésol, 22 % de m-crésol, 9 % de p-crésol, 28 % de xylénol et 3 % de phénols supérieurs. Ce mélange a ensuite été séparé par distillation.
La société Merichem utilise du sulfure d’hydrogène, un déchet des raffineries, pour précipiter les phénols au lieu du dioxyde de carbone. La solution de sulfure obtenue est concentrée pour produire du sulfure de sodium destiné à l’industrie papetière et au traitement des minerais.
Le condensat de vapeur d’eau formé au cours de ce processus est épuré au gaz naturel pour éliminer les composés odorants, puis acheminé vers une tour de refroidissement. Le gaz naturel est utilisé comme combustible dans l’incinérateur d’air de traitement final.
L’eau de l’usine est recyclée dans un système intégré, la majeure partie de l’eau étant rejetée dans l’environnement sous forme de vapeur d’eau provenant des tours de refroidissement.
La Pittsburgh Consolidated Chemical Company utilisait auparavant un procédé impliquant le traitement direct des caustiques usagées de raffinerie par des gaz de combustion contenant du dioxyde de carbone. Le phénol brut précipité était ensuite distillé et extrait avec une solution aqueuse de méthanol-naphta léger.
Après élimination des résidus de thiol et de base à l’aide d’une résine échangeuse d’ions, les acides crésyliques étaient récupérés par distillation fractionnée.
La capacité de production de crésyliques de Merichem était d’environ 55 000 tonnes par an en 1996. Ce chiffre inclut toutefois le phénol, les xylénols et autres alkylphénols. Merichem a étendu ses activités au traitement des crésyliques provenant de diverses sources, notamment des usines de gazéification du charbon.
La récupération des crésols et des xylénols à partir de caustiques usagées de raffinerie s’est principalement limitée aux États-Unis. En Allemagne, différentes techniques de raffinage et la production de caustiques usagées contenant du crésol pourraient ne pas convenir à un retraitement économique. De plus, l’évolution vers l’hydrotraitement et le procédé Merox dans les raffineries a réduit la production de caustiques usagées et la récupération des crésols.
4. Production industrielle d’o-crésol
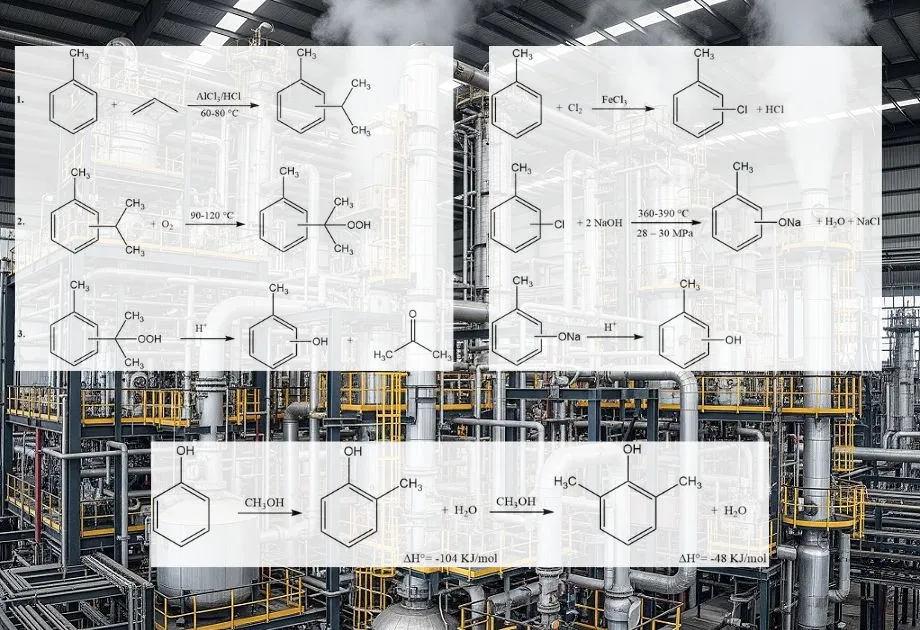
L’ortho-crésol (o-crésol) est principalement produit par des méthodes de synthèse, car la récupération traditionnelle à partir du goudron de houille et des caustiques de raffinerie est insuffisante pour répondre à la demande mondiale. Ces procédés produisent un mélange d’isomères de crésol. De ces mélanges, seul l’o-crésol peut être séparé sous forme de produit pur par distillation.
Plusieurs procédés industriels sont utilisés, souvent à partir du toluène ou du phénol :
- Méthylation en phase vapeur du phénol : Il s’agit d’une méthode industrielle largement répandue. Le phénol réagit avec le méthanol en phase gazeuse sur un catalyseur acide solide, tel que l’alumine, l’oxyde de magnésium ou l’oxyde de gallium. La réaction se produit généralement à des températures élevées (par exemple, 200-400 °C). Ce procédé produit sélectivement de l’o-crésol et du 2,6-xylénol.
- Hydrolyse alcaline du chlorotoluène : Cette méthode consiste à hydrolyser le 2-chlorotoluène en milieu alcalin. L’atome de chlore est remplacé par un groupe hydroxyle, ce qui conduit à la formation d’o-crésol. Ce procédé permet de produire un mélange d’isomères de crésol, dont les proportions varient selon les conditions spécifiques et les catalyseurs utilisés.
- Fusion alcaline des toluènesulfonates : Ce procédé utilise le toluène comme matière première, qui est d’abord sulfoné pour former de l’acide toluènesulfonique. Le sel de sodium de l’acide toluènesulfonique subit ensuite une fusion alcaline (réaction avec de l’hydroxyde de sodium fondu) pour produire du crésoxyde de sodium, qui est ensuite acidifié pour donner du crésol.
- Décomposition de l’hydroperoxyde de cymène : Ce processus, également à partir du toluène, implique la formation de cymène (isopropyltoluène), qui est ensuite oxydé en hydroperoxyde de cymène. La décomposition acide-catalysée (décomposition) de l’hydroperoxyde de cymène produit du crésol et de l’acétone.
Pour un article complet et détaillé sur la production de crésol, consultez l’article suivant..
5. Utilisations de l’o-crésol
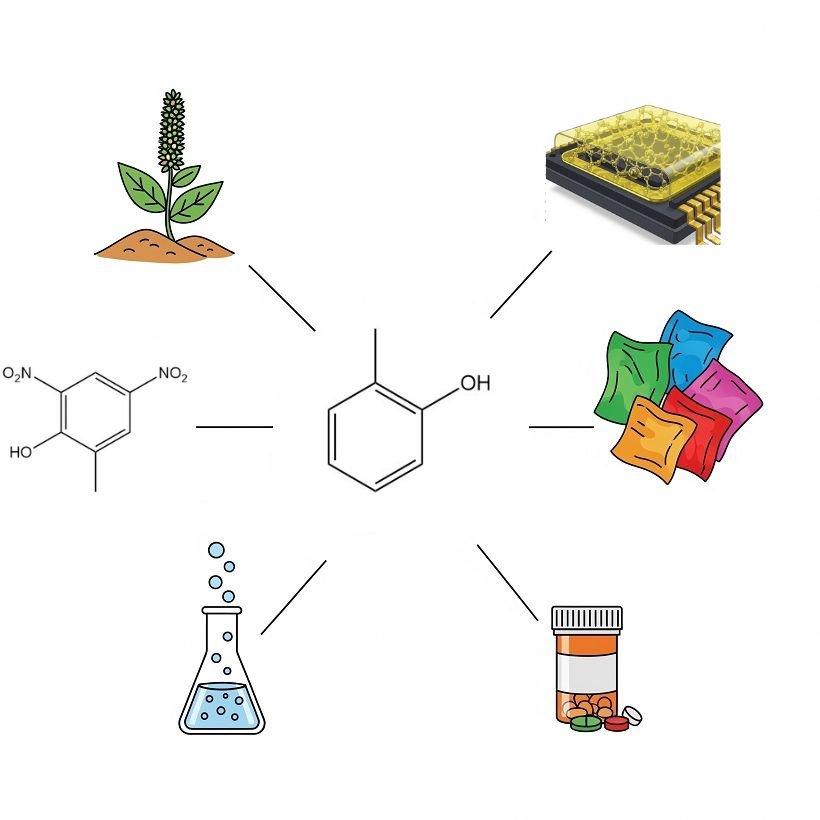
L’o-crésol est un intermédiaire chimique polyvalent et un solvant dans diverses industries.
En Europe, l’une de ses principales applications est sa chloration en 4-chloro-o-crésol, utilisé comme précurseur des acides chlorophénoxyalcanoïques, notamment l’acide 4-chloro-2-méthylphénoxyacétique, l’acide 2-(4-chloro-2-méthylphénoxy)propionique et l’acide γ-(4-chloro-2-méthylphénoxy)butyrique, tous connus comme herbicides sélectifs.
Une plus petite quantité d’o-crésol subit une nitration pour produire le 4,6-dinitro-o-crésol. Ce dérivé présente des propriétés herbicides et insecticides. Il est également utilisé comme inhibiteur de polymérisation lors de la production et de la distillation du styrène.
L’o-crésol de haute pureté est de plus en plus utilisé, notamment au Japon, dans la fabrication de résines novolaques époxy-o-crésol (résines ECN). Ces résines sont utilisées comme matériaux d’étanchéité pour les circuits intégrés. L’o-crésol de qualité standard est utilisé dans la modification des résines phénol-formaldéhyde conventionnelles.
L’o-crésol est également un précurseur important de divers intermédiaires colorants. Quantitativement, l’acide o-crésotinique (acide o-hydroxyméthylbenzoïque), synthétisé par la réaction de Kolbe, est le plus important. Cet acide est ensuite utilisé dans la production pharmaceutique, tandis que ses esters méthyliques sont utilisés comme auxiliaires de teinture.
Une quantité considérable d’o-crésol est utilisée comme solvant, soit directement, soit après hydrogénation en 2-méthylcyclohexanol ou en 2-méthylcyclohexanone. Sa forme ester carbonate sert de matière première pour la synthèse de la coumarine.
L’alkylation de l’o-crésol par le propène produit du carvacrol (3-isopropyl-6-méthylphénol), utilisé comme antiseptique et dans les parfums.
De faibles quantités d’o-crésol sont alkylées par l’isobutène, servant de matière première à divers antioxydants, composants pour matériaux d’enregistrement thermique et produits pharmaceutiques, comme le relaxant musculaire méphénésine.
Références
- Cresols and Xylenols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a08_025
- Cresols; Encyclopedia of Toxicology, Volume 1. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543002967
