Acido perclorico: proprietà, produzione e usi
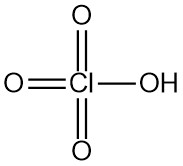
L’acido perclorico è un acido minerale forte con formula chimica HClO4. È un liquido incolore e inodore che si trova solitamente in soluzioni acquose. L’acido perclorico è uno degli acidi di Brønsted-Lowry più forti.
Sommario
1. Proprietà dell’acido perclorico
1.1. Proprietà fisiche dell’acido perclorico
L’acido perclorico anidro può essere prodotto per distillazione a pressione ridotta da una miscela contenente 1 parte di 20% HClO4 e 4 parti di 20% oleum.
È un liquido incolore, fortemente igroscopico con una massa molecolare di 100,5 g/mol. Fonde a -102 °C e si decompone a 75 °C a pressione atmosferica.
La densità e la pressione di vapore dell’acido perclorico a diverse temperature sono descritte in dettaglio nella Tabella 1.
| Temperatura, °C | Densità, g/cm3 | Pressione di vapore, kPa |
|---|---|---|
| 0 | 1,808 | 1,546 |
| 10 | 1,789 | 2,506 |
| 20 | 1,770 | 3,913 |
| 25 | 1,761 | 4,826 |
L’acido perclorico è miscibile con acqua in tutte le proporzioni e forma diversi idrati (HClO4·n H2O, con n = 1, 2, 2,5, 3 e 3,5).
I punti di ebollizione e le densità delle soluzioni acquose sono presentati nella Tabella 2.
| Concentrazione di HClO4, % in peso | Punto di ebollizione, °C | Densità a 25 °C, g/cm3 |
|---|---|---|
| 24,34 | 105,8 | 1,154 |
| 38,9 | 114,8 | 1,280 |
| 50,67 | 132,4 | 1,4058 |
| 56,65 | 148,0 | 1,4799 |
| 61,2 | 162,3 | 1,5413 |
| 65,20 | 189,2 | 1,5993 |
| 70,06 | 198,7 | 1,6748 |
| 72,5 | 203 | 1,7150 |
1.2. Proprietà chimiche dell’acido perclorico
L’acido perclorico anidro è un agente ossidante molto forte. Mentre alcuni metalli (nichel, rame, argento e oro) mostrano un’ossidazione minima a temperatura ambiente, il platino rimane inalterato ma catalizza la decomposizione acida. L’acido perclorico reagisce violentemente con materiali combustibili come carta, carbone, etanolo, anidride acetica e gelatina, formando miscele esplosive.
Le soluzioni acquose offrono una maggiore stabilità rispetto alla forma anidra. La miscela azeotropica (72,5% in peso di HClO4) si decompone solo al di sopra del suo punto di ebollizione in assenza di materiali ossidabili.
Le soluzioni concentrate di acido perclorico sono forti agenti ossidanti, in particolare a temperature elevate. Queste soluzioni formano miscele esplosive con composti organici che possono detonare per riscaldamento, percussione o esposizione a scintille o fiamme.
L’acido perclorico è un forte acido di Brønsted-Lowry, che reagisce in soluzioni acquose con metalli, ossidi/idrossidi metallici e sali di acidi volatili per formare perclorati corrispondenti.
Alcuni ossidi (ad esempio, CuO) possono catalizzare la decomposizione dell’acido perclorico attraverso una serie di reazioni che producono cloro, ossigeno e acqua come prodotti finali.
2. Produzione di acido perclorico
L’acido perclorico viene prodotto con metodi chimici ed elettrochimici, sia in laboratorio che commercialmente.
2.1. Metodi chimici
Nel 1816, Von Stadion fece reagire il perclorato di potassio con l’acido solforico sotto distillazione sotto vuoto per produrre acido perclorico.
Nel 1830, Serullas ottenne l’acido perclorico decomponendo l’acido clorico acquoso con il riscaldamento e, nel 1831, produsse con successo fluorosilicato di potassio insolubile e acido perclorico facendo reagire il perclorato di potassio con l’acido idrofluosilicico.
2 KClO4 + H2SiF6 → K2SiF6 + 2 HClO4
Nel 1839, Henry trasformò il perclorato di bario in solfato di bario e soluzione di acido perclorico usando acido solforico. Un metodo simile utilizza l’acido cloridrico invece dell’acido solforico.
Più avanti nel XIX secolo, Willard ossì il perclorato di ammonio con una miscela di acido nitrico e acido cloridrico, per produrre acido perclorico, cloro, protossido di azoto e acqua. La soluzione diluita di acido perclorico viene concentrata tramite ebollizione.
34 NH4ClO4 + 36 HNO3 + 8 HCl → 34 HClO4 + 4 Cl2 + 35 N2O + 73 H2O
Nel moderno metodo chimico, Pernert, basato sul lavoro di Kreider & Mathers ha prodotto acido perclorico facendo reagire perclorato di sodio con acido cloridrico concentrato. Questo processo è stato commercializzato con successo.
NaClO4 + HCl → NaCl + HClO4
2.2. Metodi elettrochimici
Un processo continuo sviluppato in Germania per produrre acido perclorico utilizza l’ossidazione anodica del gas cloro disciolto in acido perclorico concentrato raffreddato (40%).
Cl2 + 8 H2O + 14 e– → 2 HClO4 + 14 H+
Diversi studi hanno esplorato la preparazione elettrochimica dell’acido perclorico mediante ossidazione anodica dell’acido cloridrico a basse temperature (da 20 a -20 °C) utilizzando elettrodi di platino e concentrazioni specifiche di HCl (0,1-0,5 M) per ottenere una soluzione di acido perclorico pari a circa il 60%.
È stata sviluppata una cella a tre compartimenti con un anodo di platino e un catodo di ferro per la produzione elettrochimica di acido perclorico da clorato di sodio. Il processo prevede l’ossidazione del clorato all’anodo per formare acido perclorico, seguita da fasi di concentrazione e distillazione per la purificazione. Le condizioni ottimali sono basse temperature inferiori a 35 °C e una densità di corrente anodica di 3,5 A/dm².
Il processo commerciale per la produzione di acido perclorico ad alta purezza utilizza una cella da 5000 ampere con anodi di platino e catodi in fogli d’argento disposti orizzontalmente all’interno di telai in PVC. Questo processo impiega una densità di corrente di 20-25 A/dm² e una tensione di cella di 4,4 V a temperature comprese tra -5 e 3 °C.
La concentrazione di cloro al punto di ingresso è di 3 g/L. L’acido perclorico prodotto viene sottoposto a distillazione per rimuovere cloro residuo e HCl e ottenere un’elevata purezza. Il consumo di platino è minimo e il consumo di energia per tonnellata di HClO4 al 70% è di 9600 kWh.
Questo processo consente la produzione diretta di diversi perclorati mediante la conversione diretta dell’acido perclorico senza la necessità del processo del clorato di sodio.
L’acido perclorico anidro viene prodotto tramite distillazione sotto vuoto di una miscela di acido perclorico concentrato (72%) e acido solforico fumante (20%) in un rapporto 1:4. Il prodotto viene quindi recuperato raffreddandolo a una bassa temperatura di -78 °C utilizzando ghiaccio secco.
3. Usi dell’acido perclorico
L’acido perclorico disponibile in commercio è principalmente una soluzione acquosa azeotropica contenente il 72,5% in peso di HClO4, che offre un equilibrio tra stabilità chimica e potere ossidante, consentendo ossidazioni controllate ad alta energia.
L’acido perclorico è utilizzato principalmente come precursore per la produzione di perclorato di ammonio ad alta purezza, un componente chiave negli esplosivi e nei propellenti solidi per razzi e missili, che ha portato a un aumento della produzione di acido perclorico negli ultimi tempi.
Trova applicazione nella chimica analitica per la determinazione degli elementi metallici presenti nei materiali ossidabili, in particolare nei composti organici.
Altre applicazioni dell’acido perclorico includono:
- Come catalizzatore per l’acetilazione di cellulosa e glucosio, utilizzato nella preparazione della cellulosa fibre.
- Nella polimerizzazione di fenoli e stirene.
- Nella lavorazione dei metalli, l’acido perclorico viene utilizzato per l’elettrolucidatura, la lavorazione e l’assottigliamento di parti metalliche, pellicole e leghe, nonché per il decapaggio e la passivazione di ferro, acciaio e altri metalli.
- Come elettrolita nell’anodizzazione dei metalli, che crea uno strato protettivo di ossido.
- Come molecola di disidratazione.
- Nelle reazioni di ossidazione, in particolare per la determinazione del cromo nei campioni di acciaio.
Riferimento
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2
