Salicylzuur: eigenschappen, productie, toepassingen en derivaten
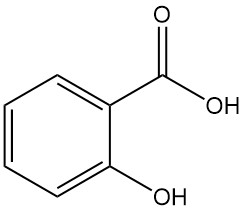
Wat is salicylzuur?
Salicylzuur, ook bekend als 2-hydroxybenzoëzuur of o-hydroxybenzoëzuur, is een aromatische verbinding met de formule C7H6O3. Het is een kleurloze, geurloze, kristallijne vaste stof die van nature voorkomt in veel planten, voornamelijk als esters.
Bewijs van het medicinale gebruik ervan dateert uit het oude Griekenland. Ongeveer 2400 jaar geleden schreef Hippocrates wilgenbastafkooksels voor om koorts en pijn te behandelen. Dit therapeutische effect kan worden toegeschreven aan salicylzuur, het actieve ingrediënt in wilgenbast.
De biosynthese van salicylzuur in planten vindt plaats door de deaminering van fenylalanine tot trans-kaneelzuur, dat verder wordt gehydrolyseerd en geoxideerd op de bètakoolstof om salicylzuur te verkrijgen.
Salicylaatesters zijn overvloedig aanwezig in verschillende plantengeslachten, waaronder Salix (wilg), Spiraea (moerasspirea) en Gaultheria (wintergroen). Methylsalicylaat, een derivaat van salicylzuur, is bijvoorbeeld in hoge concentraties aanwezig als glucoside in berkenbast, bepaalde Spiraea-soorten en wintergroene bladeren.
Salicylzuur werd voor het eerst geïsoleerd in 1838 door R. Piria door salicylaldehyde (afgeleid van moerasspirea) te behandelen met kaliumhydroxide. Zes jaar later verkreeg C. Cahours, een Franse chemicus, salicylzuur door methylsalicylaat te hydrolyseren.
De productie van salicylzuur werd in 1874 bereikt door H. Kolbe, een Duitse chemicus, door carboxylering van natriumfenoxide, een proces dat nog steeds wordt toegepast.
Salicylzuur en zijn derivaten zijn belangrijk in verschillende industrieën. Ze dienen voornamelijk als voorlopers voor de synthese van farmaceutische producten, kleurstoffen, agrochemicaliën en parfumproducten.
Inhoudsopgave
1. Fysieke eigenschappen van salicylzuur
Salicylzuur is een aromatisch o-hydroxycarbonzuur dat intramoleculaire waterstofbindingen vertoont. Dit, in tegenstelling tot zijn meta- en para-isomeren, verbetert zijn stoomvluchtigheid en sublimatieneiging. Bovendien is de zuurgraad van salicylzuur aanzienlijk hoger vergeleken met 3-hydroxybenzoëzuur (meta-isomeer) en 4-hydroxybenzoëzuur (para-isomeer).
De belangrijke fysieke eigenschappen van salicylzuur staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | 69-72-7 |
| Formule | C7H6O3 |
| Molaire massa | 138,12 g/mol |
| Kristalstructuur | Kleurloze naalden (water) of monokliene prisma's (ethanol) |
| Smelten Punt | 159 °C |
| Sublimatie | Begint bij 76 °C |
| Vlampunt (gesloten beker) | 157 °C |
| Sublimatiewarmte | 81,8 kJ/mol |
| Dichtheid | 1,443 |
| Dissociatieconstanten | K₁ = 1,05 × 10-3 K₂ = 4,0 × 10-14 (19 °C) |
| Dampspanning | 1,66 mbar (110 °C) 19,3 mbar (150 °C) |
| Oplosbaarheid | |
| Oplosmiddel | Oplosbaarheid |
| Methanol | 38,46 g/100 g (21 °C) |
| Ethanol | 34,87 g/100 g (21 °C) |
| Chloroform | 1,55 g/100 g (30 °C) |
| Benzeen | 1,00 g/100 g (30 °C) |
| Di-ethylether | 23,4 g/100 ml (17 °C) |
| Aceton | 31,3 g/100 ml (23 °C) |
| Ammoniak | Extreem oplosbaar |
| Vloeibaar zwaveldioxide | Onoplosbaar |
De oplosbaarheid van salicylzuur in water is afhankelijk van de temperatuur, zoals weergegeven in Tabel 2.
| Temperatuur (°C) | Oplosbaarheid (g/L) |
|---|---|
| 0 | 0,8 |
| 10 | 1,2 |
| 20 | 1,8 |
| 40 | 3,7 |
| 60 | 8,2 |
| 80 | 20,5 |
2. Chemische reacties van salicylzuur
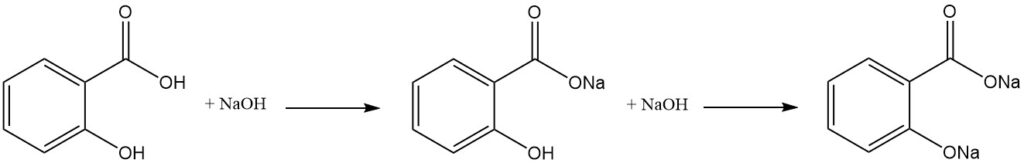
Salicylzuur is een difunctioneel molecuul met eigenschappen die kenmerkend zijn voor zowel fenolen als aromatische carbonzuren. Vanwege het verschil in zuurgraad tussen de hydroxyl- en carbonzuurgroepen neutraliseert één equivalent van een sterke base selectief de carboxylgroep.
De vorming van het dialkalizout vereist een overmaat aan base, terwijl daaropvolgende blootstelling aan koolstofdioxide resulteert in de reformatie van de vrije hydroxylgroep.
Chelatie met bepaalde metaalionen, zoals Fe(III), vormt violetkleurige complexen. Deze eigenschap maakt het mogelijk om salicylzuur te gebruiken als indicator in EDTA-titraties voor Fe(III).
De reactie van salicylzuur met alcoholen met behulp van sterke zuren als katalysatoren produceert esters met minimale ethervorming als bijproduct. Verestering kan ook worden bereikt met acylhalogeniden of zuuranhydriden.
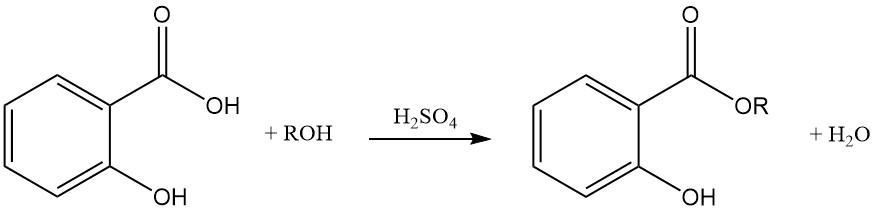
Dialkali salicylaat reageert met alkylhaliden om gecombineerde etheresters te produceren. Behandeling van deze producten met een base hydrolyseert ze tot de overeenkomstige alkoxybenzoëzuren.
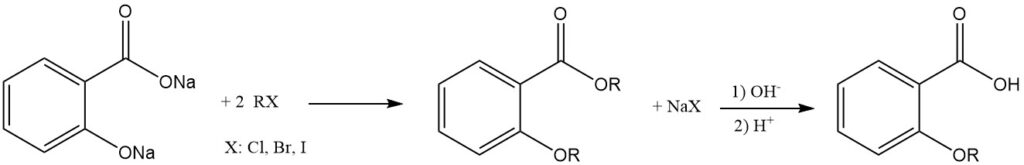
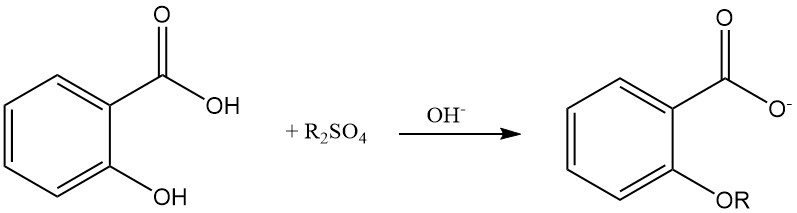
Etherificatie van de fenolische hydroxylgroep van salicylzuur is mogelijk met behulp van dialkylsulfaat in een alkalische waterige oplossing.
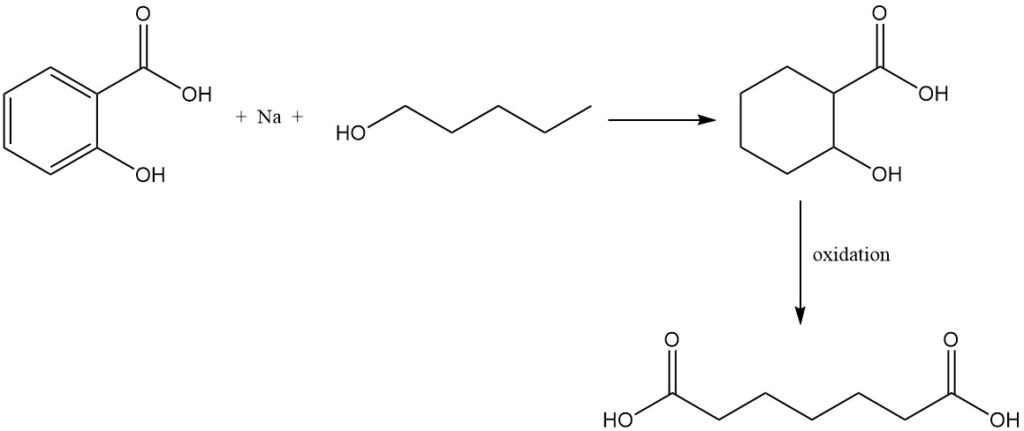
Reductie van salicylzuur met natrium en amylalcohol vormt tetrahydrosalicylzuur, dat bij oxidatie pimelinezuur oplevert.
Katalytische hydrogenering van salicylzuuresters met behulp van Raney-nikkel produceert esters van cis-trans-2-hydroxycyclohexaancarbonzuur.
Elektrofiele substitutiereacties begunstigen de minder gehinderde 5-positie van de aromatische ring. Deze regioselectiviteit maakt de directe synthese van 5-gesubstitueerde of 3,5-digesubstitueerde salicylzuurderivaten mogelijk.
Voorbeelden van elektrofiele substitutie van salicylzuur zijn nitrering, sulfonering, halogenering, alkylering, acylering en koppeling met diazoniumzouten, wat doorgaans 5-gesubstitueerde producten oplevert.
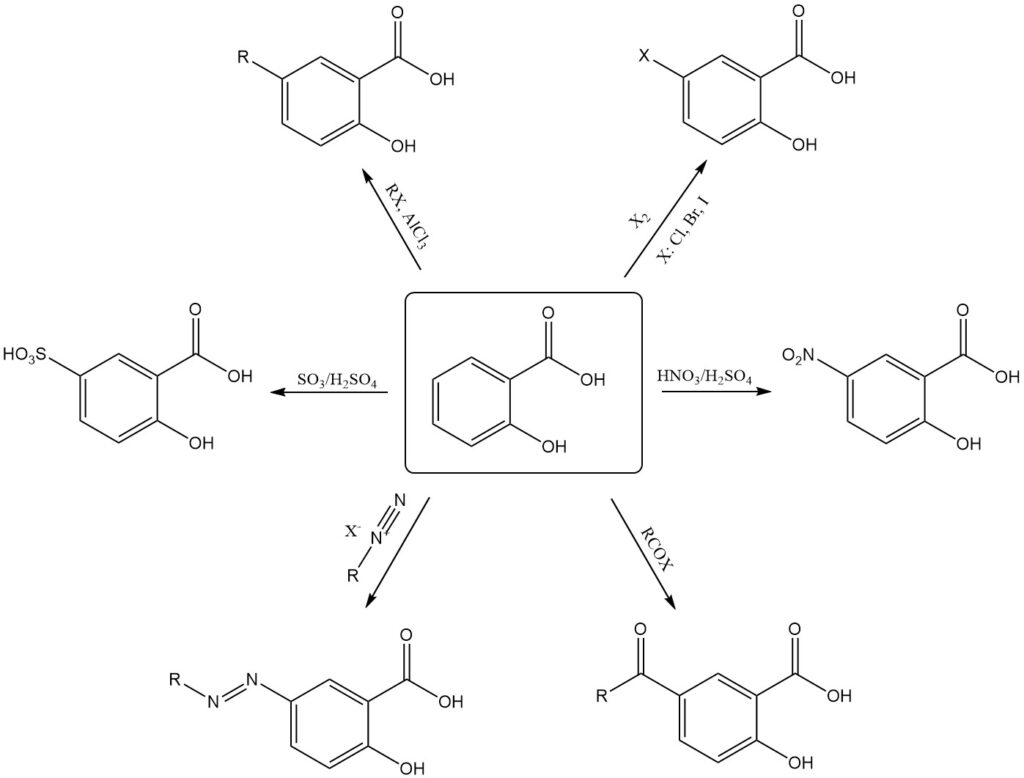
Gesubstitueerde salicylzuurderivaten op de 3-positie vereisen indirecte methoden zoals de substitutie van sulfosalicylzuur op de 5-positie, gevolgd door de eliminatie van de sulfonzuurgroep. Echter, hardere reactieomstandigheden kunnen leiden tot decarboxylatie.
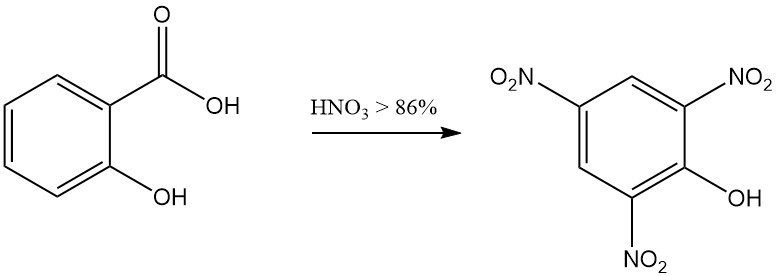
Bijvoorbeeld, de reactie van salicylzuur met rokend salpeterzuur resulteert in de vorming van 2,4,6-trinitrofenol (picrinezuur), en de reactie met broom in aanwezigheid van water levert tribroomfenol op.
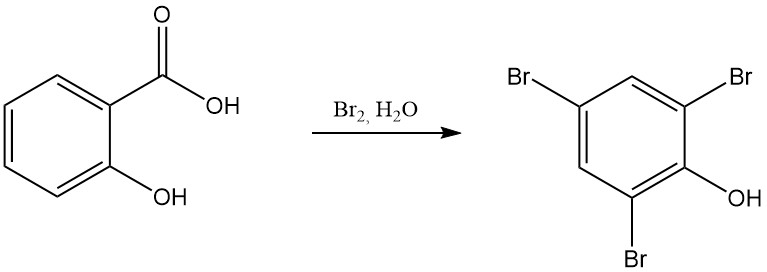
De thermische ontleding van salicylzuur bij of boven het smeltpunt geeft fenol en koolstofdioxide. Onder een koolstofdioxide-atmosfeer bij 230 °C is het primaire product fenylsalicylaat. Bij hogere temperaturen (250 °C) wordt xanthon gevormd naast fenol.
3. Productie van salicylzuur
3.1. Productie van salicylzuur door Kolbe-Schmitt-synthese
Salicylzuur wordt commercieel bereid via de Kolbe-Schmitt-reactie. Dit proces omvat het laten reageren van droog natriumfenoxide met koolstofdioxide onder druk (5 bar) en bij temperaturen variërend van 150 tot 160 °C.
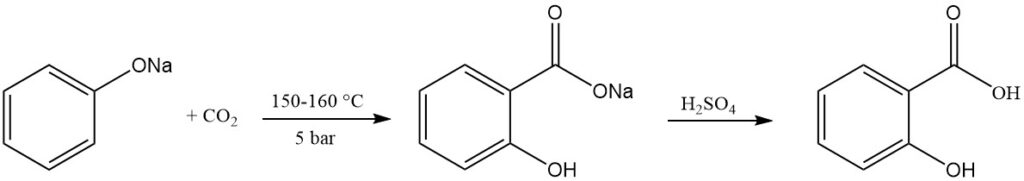
In 1884 ontdekte Schmitt dat het gebruik van druk de opbrengst verbeterde tot ongeveer 90% vergeleken met de oorspronkelijke reactie van Kolbe in 1874, die slechts ongeveer 50% opleverde bij normale druk. Zonder druk vormen dinatriumsalicylaat en fenol zich in gelijke hoeveelheden.
Het exacte mechanisme van de Kolbe-Schmitt-reactie blijft onderwerp van discussie. Er zijn veel suggesties gedaan in de literatuur, zoals:
- 4-Hydroxyisoftaalzuur kan fungeren als een tussenproduct, waarbij CO2 wordt vrijgegeven of carboxylering van fenolaat ondergaat om salicylzuur te vormen.
- Complexvorming tussen fenol, CO2 en een alkalimetaal kan elektrofiele substitutie bij het fenoxide vergemakkelijken.
Temperatuur, het type alkalimetaal dat wordt gebruikt en CO2-druk hebben allemaal een aanzienlijke invloed op de reactiviteit en selectiviteit van het fenoxide-anion.
Een vereenvoudigd overzicht van de industriële synthese van salicylzuur wordt gegeven in Figuur 1.
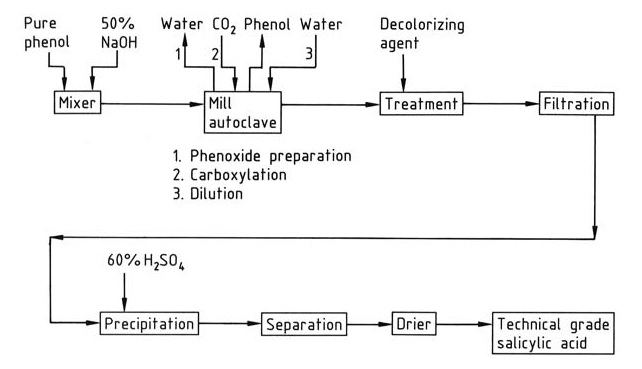
Carboxylering vindt plaats in autoclaven die zijn uitgerust met roerders of maalapparaten. Het reactiemengsel moet fijngemalen en rigoureus vrij van water zijn om een optimale opbrengst te garanderen. Water verlaagt de opbrengst door fenoxide om te zetten in fenol en de vorming van carbonaat te bevorderen.
Een lichte molaire overmaat (1-2%) van natriumhydroxide wordt gebruikt om natriumfenoxide te bereiden. Grotere hoeveelheden natronloog leiden tot watervorming. Het watervrije natriumfenoxide wordt bereid door de verdamping van een waterige natriumfenoxide-oplossing in de autoclaafmenger zelf, door een vacuüm aan te brengen na het bereiken van normale druk, of door speciale droogapparatuur te gebruiken.
Het koolstofdioxide dat in de reactie wordt gebruikt, moet een minimaal zuurstofgehalte hebben (<0,1%) om verkleuring en teervorming te voorkomen.
De exotherme carboxyleringsreactie zet natriumfenoxide om in salicylzuur. Het resulterende ruwe natriumsalicylaat wordt opgelost in water, behandeld met een ontkleuringsmiddel (bijv. actieve kool, aluminium of zinkpoeder) en vervolgens neergeslagen met zwavelzuur.
Niet-gereageerde fenol wordt uit het ruwe natriumsalicylaatmengsel gewonnen door destillatie.
Als alternatief gebruikt het continue proces een oplossing van watervrij fenoxide in een geschikt oplosmiddel, zoals fenol zelf, hogere alcoholen, dialkylketonen of nitrobenzeen.
3.2. Productie van salicylzuur door andere processen
Er zijn andere alternatieve methoden voor de productie van salicylzuur onderzocht:
- Luchtoxidatie van o-cresolaat bij 230 °C met een koperkatalysator of koperbenzoaat bij 175-215 °C.
- Het direct verhitten van alkalisch koperbenzoaat kan salicylaat opleveren.
- De hydrolyse van 2-benzoyloxybenzoëzuur, een tussenproduct in het Dow-proces voor fenolproductie, leidt tot de vorming van salicylzuur.
- Fermentatie van polycyclische aromatische verbindingen zoals naftaleen door bepaalde micro-organismen kan salicylzuur produceren.
4. Toepassingen van salicylzuur
Salicylzuur wordt voornamelijk gebruikt als voorloper voor acetylsalicylzuur (aspirine), het meest verstrekte farmaceutische middel ter wereld. Daarnaast zijn salicylzuuresters, amiden en zouten uitgangsmaterialen voor andere farmaceutische producten.
Technisch salicylzuur wordt gebruikt als tussenproduct bij de productie van agrochemicaliën, kleurstoffen en verfstoffen, rubberproducten en fenolharsen.
Salicylzuur zelf heeft therapeutische effecten bij de behandeling van reumatische aandoeningen. Het wordt voor dit doel meestal toegediend als de zeer oplosbare natriumzoutvorm.
Vanwege de keratolytische eigenschappen (het vermogen om keratine af te breken) wordt salicylzuur gebruikt in verschillende huidverzorgingsproducten voor het reinigen en verwijderen van schilfers.
Salicylzuur is een bactericide dat wordt gebruikt in sommige ontsmettingsmiddelen of conserveermiddelen. Het gebruik ervan in voedingsproducten is echter verboden.
Recentelijk wordt het gebruikt als regulator van plantengroei en -bloei en tegen verschillende abiotische en biotische stressfactoren.
Acetylsalicylzuur is goed voor ongeveer 55% van de totale salicylzuurmarkt, gevolgd door esters en zouten (18%), harsen (10%) en kleurstoffen en kleurstoffen (10%).
De introductie van nieuwere pijnstillers die rechtstreeks concurreren met aspirine heeft de salicylzuurmarkt beïnvloed, wat heeft geleid tot een daling van de aspirineconsumptie. De potentiële ontdekking van nieuwe toepassingen voor salicylzuur zou de markt in de toekomst echter kunnen stabiliseren.
5. Salicylzuurderivaten
Salicylzuur vormt gemakkelijk zouten bij reactie met metaalcarbonaten. Om verkleuring te voorkomen, wordt aanbevolen om waterige zoutoplossingen licht zuur te houden. Zouten worden verkregen als vaste stoffen door hun oplossingen te concentreren.
5.1. Natriumsalicylaat
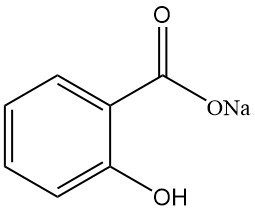
- Formule: NaC7H5O3
- CAS-nummer: 54-21-7
- Molaire massa: 160,11 g/mol
- Uiterlijk: Witte, geurloze, glanzende kristallijne vlokken
- Oplosbaarheid:
- Water: 125 g/100 ml (25 °C)
- Ethanol: 17 g/100 ml (15 °C)
Technische kwaliteit natriumsalicylaat wordt geproduceerd door de verdamping van een natriumsalicylaatoplossing, en farmaceutische kwaliteit natriumsalicylaat wordt bereid door de dubbele kristallisatie van natriumsalicylaathexahydraat uit een 45% waterige oplossing bij 10 °C.
Het wordt gebruikt als een pijnstiller, koortswerend en antineuralgisch middel.
Er bestaan tal van andere salicylaatzouten, waaronder die van ammonium, magnesium, calcium en aluminium, evenals morfolinesalicylaat. Veel van deze zouten zijn verkrijgbaar onder verschillende handelsnamen.
5.2. Methylsalicylaat
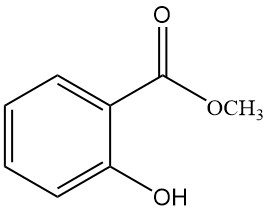
- Formule: C8H8O3
- CAS-nummer: 119-36-8
- Molaire massa: 152,15 g/mol
- Uiterlijk: Kleurloze, olieachtige vloeistof met een karakteristieke geur
- Smeltpunt: -9 °C
- Kookpunt: 222 °C
- Dichtheid: 1,184 g/ml
Methylsalicylaat wordt geproduceerd door een mengsel van salicylzuur en methanol te verhitten met zwavelzuur.
Het wordt gebruikt bij de behandeling van neuralgie en reuma, door de capillaire bloedcirculatie te stimuleren, als insecticide, zonnebrandcrème, als geurstof en synthetisch tussenproduct.
5.3. Benzylsalicylaat
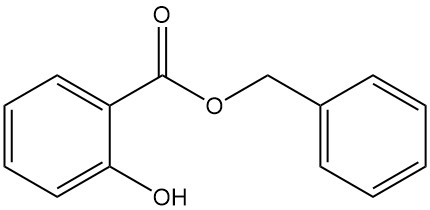
- Formule: C14H12O3
- CAS-nummer: 118-58-1
- Molaire massa: 228,25 g/mol
- Uiterlijk: Heldere vloeistof of kleurloze tot ondoorzichtige kristallijne massa met een karakteristieke geur
- Smeltpunt: 24 °C
- Kookpunt: 318 °C
- Dichtheid: 1,180 g/ml (bij 15 °C)
Benzylsalicylaat wordt geproduceerd door de reactie tussen natriumsalicylaat en benzylchloride of door de transesterificatie van methylsalicylaat met benzylalcohol.
Het wordt aangetroffen in ylang-ylang- en anjerolie en wordt gebruikt als additief in zepen, detergenten en parfums.
5.4. Isoamylsalicylaat
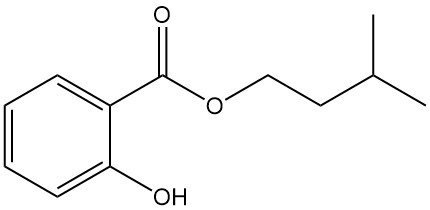
- Formule: C12H16O3
- CAS-nummer: 87-20-7
- Molaire massa: 208,26 g/mol
- Uiterlijk: Kleurloze vloeistof met de geur van orchideeën
- Kookpunt: 270 °C
- Dichtheid: 1,050 g/ml (bij 20 °C)
Isoamylsalicylaat wordt gebruikt als geurstabilisator in de parfumerie en als een actueel antireumatisch middel.
5.5. Fenylsalicylaat
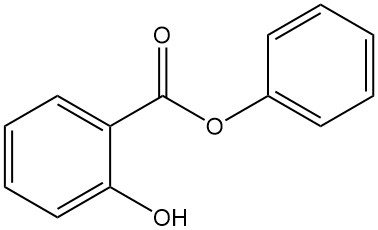
- Formule: C13H10O3
- CAS-nummer: 118-55-8
- Molaire massa: 241,22 g/mol
- Uiterlijk: Kleurloos, kristallijn poeder
- Smeltpunt: 43 °C
- Kookpunt: 172 °C (bij 16 mbar)
Fenylsalicylaat wordt bereid door de reactie tussen salicylzuur en fenol met zwavelzuur of door de transesterificatie van methylsalicylaat met natriumfenoxide.
Het wordt gebruikt als antisepticum, conserveermiddel, in zonnebrandcrème, als algemeen fotobeschermend middel voor synthetische producten en als verzachtend middel.
5.6. Acetylsalicylzuur (aspirine)
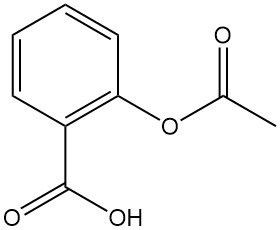
Acetylsalicylzuur, ook wel bekend onder de merknaam Aspirine, is een belangrijk derivaat van salicylzuur. Hier is een overzicht van de eigenschappen en toepassingen:
Fysische eigenschappen:
- Formule: C9H8O4
- Molaire massa: 180,15 g/mol
- Uiterlijk: Kleurloze naalden of kristallijn poeder (afhankelijk van het kristallisatieoplosmiddel)
- Smeltpunt: 143–144 °C
- Oplosbaarheid: Laag in water (0,25 g/100 ml bij 15 °C), maar beter oplosbaar in ethanol (20 g/100 ml bij 25 °C)
- Dissociatieconstante (K): 2,8 x 10-4 (bij 25 °C)
Acetylsalicylzuur wordt gesynthetiseerd door azijnzuuranhydride te laten reageren met salicylzuur bij temperaturen onder de 90 °C. Verschillende oplosmiddelen en katalysatoren (zuren of tertiaire aminen) kunnen in het proces worden gebruikt.
Acetylsalicylzuur is een bekend antipyreticum (koortsverlager), pijnstillend, ontstekingsremmend en antireumatisch middel. Het bezit ook antitrombotische en anticoagulerende eigenschappen, die de vorming van bloedstolsels verminderen.
6. Toxicologie van salicylzuur
Salicylzuur en zijn derivaten worden gemakkelijk opgenomen door de huid en slijmvliezen. Estervormen van salicylzuur ondergaan hydrolyse in het lichaam door de werking van enzymen die esterasen worden genoemd.
De eliminatieroute voor salicylzuur is afhankelijk van de pH van de urine:
- Zure urine: Salicylzuur wordt geoxideerd tot gentisinezuur.
- Alkalische urine: Salicylzuur wordt door de nieren geëlimineerd als salicyluretisch zuur of glucuronide salicylaat.
Aangezien de absorptie sneller kan zijn dan de eliminatie, kan er onder bepaalde omstandigheden salicylzuuraccumulatie in het lichaam optreden voorwaarden.
Biologische effecten
Salicylzuur heeft keratolytische activiteit, wat betekent dat het de afstoting van de buitenste huidlaag bevordert. Het kan ook huidweefsels irriteren, met name in de maag, waar het slijmproducerende cellen aantast. Langdurig gebruik van salicylaten kan de bloedstolling vertragen door de bloedplaatjesaggregatie te verminderen.
Salicylzuur en zijn derivaten remmen de prostaglandinesynthese, wat bijdraagt aan hun ontstekingsremmende eigenschappen. Deze verbindingen vertonen pijnstillende en koortswerende effecten.
Salicylzuur en zijn derivaten kunnen fungiciden en bacteriostatische middelen zijn.
Overgevoeligheidsreacties van de huid en de longen op salicylaten zijn bekend, hoewel dit niet altijd echte allergieën zijn. Verminderde prostaglandinesynthese kan hierbij een rol spelen. Kruisgevoeligheid tussen verschillende salicylaatvormen, zoals methylsalicylaat en aspirine, is waargenomen.
Toxiciteit
Enkele doses salicylzuur van meer dan 10 gram kunnen dodelijk zijn. De voornaamste zorg is verstoring van de zuur-basebalans van het lichaam. Symptomen zijn onder meer delirium, tremoren, ademhalingsproblemen, zweten, uitdroging, koorts en coma.
Minder ernstige intoxicatie presenteert zich met hyperventilatie, oorsuizen, misselijkheid, braken, zicht- of gehoorproblemen, duizeligheid en stoornissen van het zenuwstelsel.
Chronisch gebruik kan leiden tot spijsverteringsproblemen, maag- en darmpijn en soms ernstige, verborgen bloedingen. Salicylaat-geïnduceerde bloedarmoede, als gevolg van ijzertekort door verborgen bloedingen, kan ook voorkomen. Bij oudere patiënten kan chronische intoxicatie zich uiten als verwardheid en agitatie.
Ondanks mogelijke weefselschade is chronische toediening van zuiver salicylzuur niet in verband gebracht met lever- of nierproblemen.
Dierstudies suggereren dat hoge doses salicylzuur en zijn derivaten een risico op geboorteafwijkingen kunnen vormen. Dit is echter niet bevestigd bij mensen en goede hygiëne en werkomstandigheden zouden deze zorgen moeten verminderen.
Referenties
- Salicylic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a23_477
- Analgesics (N02); Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/9783527306732.a02_269.pub4
- Salicylic Acid: A Regulator of Plant Growth and Development
- Salicylic Acid. – https://www.sciencedirect.com/science/article/abs/pii/B9780080552323625759
