Aminofenolo: proprietà, produzione, reazioni e usi

Gli amminofenoli hanno acquisito una notevole importanza commerciale, sia come sostanze autonome che come componenti cruciali nei settori chimico e dei coloranti.
Questi composti possiedono proprietà anfotere che mostrano caratteristiche di acidi deboli o basi deboli, con la natura basica che prevale tipicamente.
In particolare, il 2-amminofenolo e il 4-amminofenolo possono facilmente subire ossidazione, una caratteristica che contribuisce alle loro applicazioni primarie come sviluppatori fotografici. Tuttavia, il 3-amminofenolo rimane relativamente stabile quando esposto all’aria e non si ossida.
Sommario
1. Proprietà fisiche degli amminofenoli
Le strutture di base degli amminofenoli esistono in tre distinte configurazioni isomeriche, determinate dalla disposizione spaziale dei gruppi idrossilici e amminici adiacenti all’anello benzenico. Questi composti in genere solidificano in strutture cristalline a temperatura ambiente normale.
I composti amminofenoli disponibili sul mercato sono comunemente impuri a causa della potenziale contaminazione da sottoprodotti di ossidazione. Di conseguenza, potrebbero presentare tonalità che vanno dal giallo-marrone al rosa-viola, con il 2- e il 4-amminofenolo più vulnerabili a questa alterazione del colore rispetto al 3-isomero.
1.1. Proprietà fisiche del 2-amminofenolo
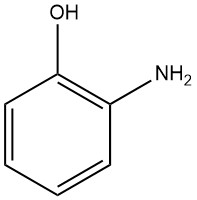
Il 2-amminofenolo, noto anche come 2-idrossianilina o 2-ammino-1-idrossibenzene, ha la formula chimica C6H7NO, una massa molare di 109,13 g/mol. Quando viene cristallizzato da acqua o benzene, forma aghi bianchi ortorombici bipiramidali.
Il punto di fusione di questi cristalli è 174 °C e la loro densità è di circa 1,328 g/cm³ (1,29 g/cm³ è anche menzionato in alcune fonti). A pressione ridotta (1,47 kPa), il 2-amminofenolo sublima rapidamente a 153 °C senza decomposizione.
Per quanto riguarda le sue proprietà acido-base, le costanti di dissociazione sono le seguenti: pK1 è 4,72 a 21 °C in acqua e 4,66 a 25 °C in una soluzione di etanolo all’1% in acqua; pK2 è 9,66 a 15 °C e 9,71 a 22 °C in acqua.
Il composto può formare vari sali, tra cui il sale cloridrato, che appare come aghi e ha un punto di fusione di 207 °C; il sale formiato, che fonde a 120 °C; il sale ossalato, che si decompone a 167,5 °C; e il sale acetato, che fonde a 150 °C.
Il 2-amminofenolo è molto solubile in acetone, acetonitrile, dimetilsolfossido, etanolo e acetato di etile, solubile in acqua calda ed etere dietilico e leggermente solubile in cloroformio, benzene, toluene e acqua fredda.
1.2. Proprietà fisiche del 3-amminofenolo

Il 3-amminofenolo, noto anche come 3-idrossianilina o 3-ammino-1-idrossibenzene, ha la formula chimica C6H7NO con una massa molare di 109,13 g/mol. Questo composto forma prismi bianchi dopo la cristallizzazione da acqua o toluene e il suo punto di fusione varia tra 122 e 123 °C.
I cristalli ortorombici presentano una disposizione tetramolecolare e possiedono una densità di circa 1,195 g/cm³ (sono stati riportati anche valori alternativi di 1,206 e 1,269). Quando sottoposto a pressione ridotta (1,47 kPa), il 3-amminofenolo bolle a 164 °C con una leggera decomposizione.
Per quanto riguarda le sue proprietà acido-base, le costanti di dissociazione sono le seguenti: pK1 è 4,17 a 21 °C in acqua e 4,31 a 25 °C in una soluzione contenente 1% di etanolo acquoso; pK2 è 9,87 a 22 °C in acqua.
Il 3-amminofenolo può formare vari sali, tra cui il sale cloridrato, che assume la forma di prismi e fonde a 229 °C; il sale bromidrato, anch’esso prismatico, con un punto di fusione di 224 °C; il sale iodiduro, anch’esso prismatico, con un punto di fusione di 209 °C; il sale solfato che si presenta come piastre o aghi e fonde a 152 °C; e il sale ossalato, con un punto di fusione di 275 °C.
Il 3-amminofenolo è molto solubile in acetone, acetonitrile, dimetilsolfossido, etanolo, acetato di etile e acqua calda, solubile in acqua fredda ed etere dietilico e leggermente solubile in cloroformio, benzene e toluene.
1.3. Proprietà fisiche del 4-amminofenolo
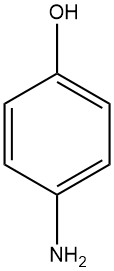
Il 4-amminofenolo, noto come 4-idrossianilina o 4-ammino-1-idrossibenzene, ha una formula chimica di C6H7NO con un peso molecolare di 109,13 g/mol. Assume la forma di placche bianche dopo la cristallizzazione dall’acqua e ha un intervallo di fusione di 189-190 °C (si verifica la decomposizione).
I cristalli esistono in due forme distinte. La forma “α” più stabile (ottenuta da alcol, acqua o acetato di etile) ha una struttura piramidale ortorombica con quattro molecole all’interno di ogni cella unitaria. Ha una densità di circa 1,290 g/cm³ (in alternativa, viene riportato 1,305 g/cm³).
La forma “β” meno stabile (cristallizzazione dall’acetone) si presenta come cristalli aciculari, che si convertono nella forma “α” nel tempo. I cristalli della forma “β” sono bipiramidali ortorombici o piramidali e presentano una disposizione esamelecolare.
A pressione ridotta (40 Pa), il 4-amminofenolo sublima a 110 °C con leggera decomposizione. I punti di ebollizione a varie pressioni sono i seguenti: 284 °C (101,3 kPa), 174 °C (1,47 kPa), 167 °C (1,07 kPa), 150 °C (0,4 kPa) e 130,2 °C (0,04 kPa), con decomposizione che solitamente si verifica.
Le costanti di dissociazione acido-base per questo composto sono le seguenti: pK1 è 5,50 a 21 °C in acqua, 4,86 a 30 °C in acqua e 5,48 in una soluzione contenente etanolo acquoso all’1% a 25 °C; pK2 è 10,30 a 22 °C in acqua e 10,60 a 30 °C in acqua.
Possono essere formati vari sali di 4-amminofenolo, tra cui il sale cloridrato, che si presenta come prismi e subisce una decomposizione al raggiungimento di 306 °C; il sale idrosolfato, che appare come aghi con un punto di fusione di 272 °C; il sale ossalato, che fonde a 183 °C; il sale acetato, che fonde a 183 °C; il sale cloroacetato forma aghi con un punto di fusione di 148 °C; e il sale tricloroacetato, sotto forma di aghi con un punto di fusione di 166 °C.
Il 4-amminofenolo è molto solubile in dimetilsolfossido, solubile in acetone, acetonitrile, acetato di etile e acqua calda ed etere dietilico, leggermente solubile in etanolo, etere dietilico, toluene e acqua fredda e insolubile in benzene e cloroformio.
2. Reazioni chimiche degli amminofenoli
Discussioni dettagliate riguardanti gli attributi chimici e le risposte degli amminofenoli sono ampiamente documentate nei riferimenti stabiliti del campo. Qui viene fornita una panoramica concisa.
La presenza di un gruppo amminico nell’anello benzenico sopprime l’acidità dei fenoli, con il 4-amminofenolo che mostra l’effetto più pronunciato. Gli amminofenoli agiscono come basi deboli, formando sali con acidi sia organici che inorganici.
Gli amminofenoli sono anfoliti senza struttura zwitterionica. Esistono come molecole neutre, cationi ammonio o anioni fenolato, a seconda del pH della soluzione.

Tuttavia, le deviazioni dalle curve di titolazione acido-base teoriche hanno portato all’ipotesi di cationi complessi semi-sale B2+, formati associando un catione ammonio, B+, con una molecola neutra, B. Questo fenomeno è particolarmente evidente nel 4-amminofenolo ed è dimostrato anche da altri isomeri.
Gli amminofenoli sono chimicamente reattivi, partecipano a reazioni che coinvolgono sia il gruppo amminico aromatico che la frazione idrossilica fenolica, così come la sostituzione dell’anello benzenico.
L’ossidazione porta allo sviluppo di strutture chinoidi polimeriche dai colori vivaci. Il 2-amminofenolo subisce una serie di reazioni di ciclizzazione.
2.1. Alchilazione degli amminofenoli
Si possono formare tutti gli amminofenoli mono-, di- e trimetilati. La monoalchilazione avviene riscaldando l’amminofenolo con un alogenuro alchilico appropriato, un alcol in presenza di nichel Raney o aldeidi e chetoni come alternative all’alcol.
L’alchilazione diretta del gruppo idrossilico per produrre metossianiline (anisidine) o etossianiline (fenetidine) è complessa a causa della reattività del gruppo amminico, che spesso produce prodotti alchilati misti.
La metilazione del 3-amminofenolo in condizioni alcaline produce 3-metossianilina, sebbene un approccio più comune comporti la protezione del gruppo amminico seguita dalla metilazione delle 3-acetilaniline e successiva idrolisi.
Altre anisidine e fenetidine sono tipicamente prodotte indirettamente mediante riduzione di nitroanaloghi:

2.2. Acilazione degli amminofenoli
L’acilazione degli amminofenoli, impiegando anidride acetica in alcali o piridina, cloruro di acetile e piridina in toluene o chetene in etanolo, generalmente produce prodotti N-acilati. L’uso eccessivo di reagenti, in particolare con 2-amminofenolo, porta a prodotti O,N-diacilati.
Gli amminofenilcarbossilati (amminofenoli O-acilati) sono in genere prodotti tramite la riduzione dei corrispondenti nitrofenilcarbossilati, un processo di particolare importanza per i derivati del 4-amminofenolo.
La migrazione del gruppo acile dalle posizioni O a N è osservata sia nei prodotti acilati del 2- che del 4-amminofenolo.
Un esempio di riarrangiamento è la formazione di 2-idrossifenil carbammato trattando lentamente il 2-amminofenil etil carbonato in acido diluito. I para derivati non mostrano alcuna trasformazione.

2.3. Formazione di sali di diazonio
I gruppi amminici aromatici degli amminofenoli possono essere convertiti in sali di diazonio mediante trattamento con nitrito di sodio in condizioni acquose acide. Possono sorgere delle difficoltà con amminofenoli facilmente ossidabili o scarsamente solubili.
I sali di diazonio cristallini vengono isolati utilizzando forme cloridrato o solfato dell’amminofenolo pertinente in condizioni anidre. Questi derivati diazoici trovano largo impiego nell’industria dei coloranti.
2.4. Reazioni di ciclizzazione degli amminofenoli
A causa della stretta vicinanza dei gruppi amminico e idrossilico nel 2-amminofenolo, questo isomero è particolarmente suscettibile alle reazioni di ciclizzazione e condensazione. L’ossidazione mediante cloruro di ferro (III), enzimi, luce o autoossidazione su piastre sottili di silice produce 2-amminofenossazin-3-one (4).
La successiva ossidazione con cianuro di ferro (III) o il riscaldamento con idrossido di potassio in etanolo genera una struttura a cinque anelli, trifenossidiossazina (benzoxazinofenoxazina) (5).

Il 2-amminofenolo e i suoi derivati servono come preziosi materiali di partenza per la sintesi di fenossazoni, fenossazine, benzossazoli e tiobenzoxazoli, con la maggior parte di queste reazioni che comportano il riscaldamento a 200-300 °C con un catalizzatore appropriato.
2.5. Reazioni di condensazione
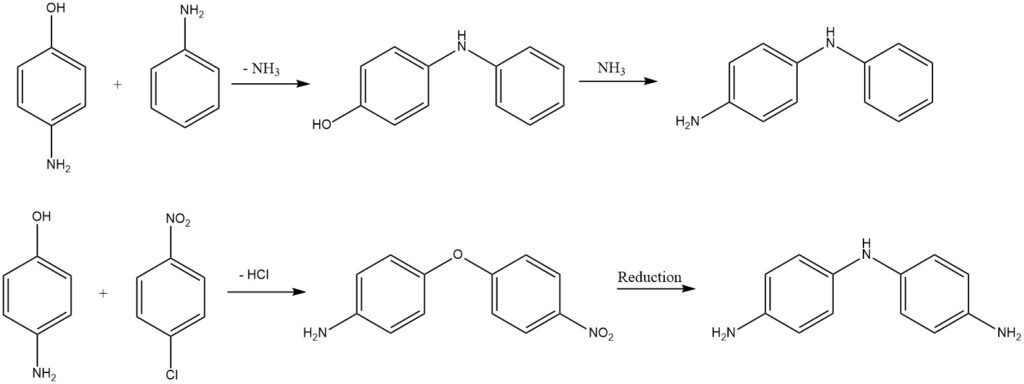
Le difenilammine sostituite o gli eteri difenilici si ottengono dagli amminofenoli tramite l’eliminazione di ammoniaca o acido cloridrico.
2.6. Reazioni dell’anello benzenico
Sia i gruppi amminici che quelli idrossilici funzionano come gruppi donatori di elettroni, portando alla formazione di vari derivati sostituiti. Le interazioni controllate tra amminofenoli e cloro o bromo nell’acido acetico glaciale producono uno spettro di prodotti alogenati.
L’acido solforico concentrato o l’oleum, con o senza calore, genera acidi solfonici aromatici. Il gruppo acido solfonico entra prevalentemente nelle posizioni orto o para rispetto al gruppo idrossilico. Un ulteriore trattamento con oleum produce composti disolfonati.
La carbossilazione dell’m-amminofenolo produce acido p-amminosalicilico.
3. Produzione di amminofenoli
Gli amminofenoli vengono sintetizzati tramite due vie principali: riduzione dei nitrofenoli o reazioni di sostituzione. La riduzione può essere ottenuta utilizzando ferro o idrogeno in presenza di un catalizzatore. Oggi, quest’ultimo metodo è la scelta preferita per produrre 2- e 4-amminofenoli.
3.1. Riduzione dei nitrocomposti
3.1.1. Riduzione del ferro
La riduzione dei nitrofenoli utilizzando trucioli di ferro avviene in una soluzione o sospensione leggermente acida. Dopo la riduzione, il fango di ferro-ossido di ferro viene separato dalla soluzione. Per migliorare la solubilità in acqua, viene aggiunto idrossido di sodio, producendo amminofenolato di sodio.
A causa della suscettibilità all’ossidazione in soluzione acquosa, sono consigliati vari metodi di purificazione. Successivamente, gli amminofenoli vengono precipitati da soluzioni acide mediante neutralizzazione di base, mentre spesso vengono incorporati agenti riducenti.
Tuttavia, la riduzione del 2-nitrofenolo con ferro genera lacche colorate insolubili come sottoprodotti, riducendo la resa. Di conseguenza, il significato industriale della riduzione del ferro per il 2-nitrofenolo è limitato.
3.1.2. Riduzione catalitica
La riduzione catalitica avviene principalmente in soluzione, emulsione o sospensione all’interno di autoclavi o recipienti pressurizzati. Dopo l’aggiunta del catalizzatore, l’idrogeno pressurizzato viene introdotto nel recipiente. I solventi preferiti comprendono acqua e metanolo, con l’acqua integrata da idrossido alcalino, carbonato alcalino o acido.
Vengono impiegati catalizzatori come il nichel, in particolare il nichel Raney, o metalli preziosi supportati come platino o palladio su carbone attivo, o i loro ossidi.
L’aggiunta di solventi organici immiscibili all’acqua può prolungare la durata del catalizzatore, ridurre i consumi e migliorare la qualità del prodotto.
In genere, una pressione di idrogeno di 2 MPa è ottimale, sebbene possano essere utilizzate pressioni atmosferiche o superiori fino a 6 MPa. Le temperature di reazione rimangono inferiori a 100-110 °C.
3.1.3. Riduzione del nitrobenzene
La riduzione in ambiente acido del nitrobenzene produce 2- e 4-amminofenolo tramite riarrangiamento dell’intermedio fenilidrossilammina. Il prodotto principale è il 4-amminofenolo, insieme ai sottoprodotti 2-amminofenolo, anilina e 4,4′-diaminodifenil etere.
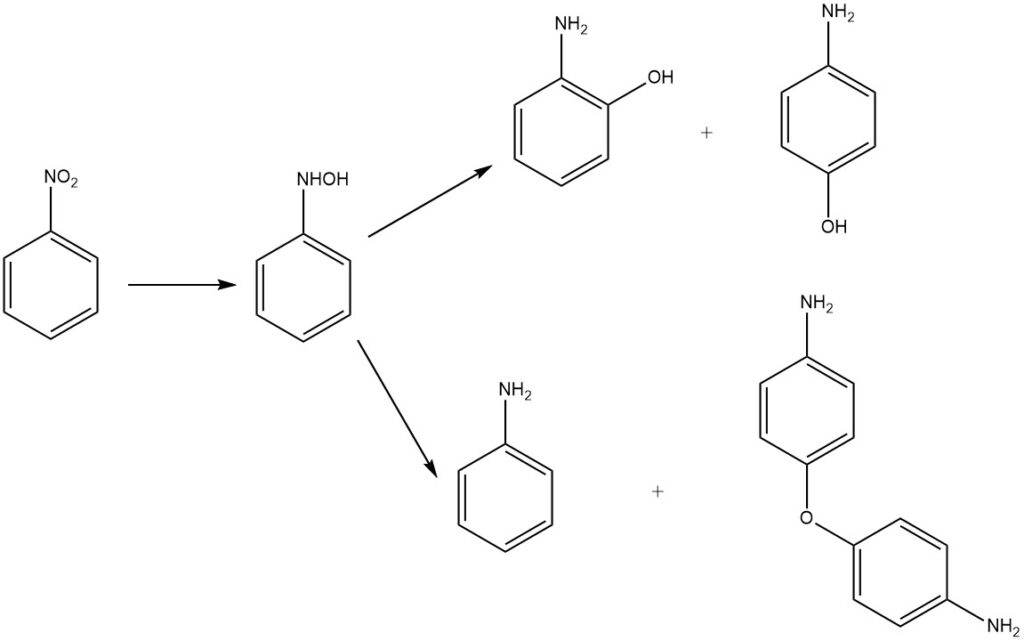
Storicamente, i metalli in acido solforico diluito fungevano da agenti riducenti. Attualmente, vengono impiegati catalizzatori a base di idrogeno e metalli preziosi come palladio o platino. Altri catalizzatori includono solfuro di molibdeno e platino e un catalizzatore misto platino-rutenio, spesso in forma di ossido o supportato su carbone attivo.
L’acido minerale acquoso diluito funge da mezzo di reazione e un processo in due fasi che coinvolge il rame Raney riduce selettivamente il nitrobenzene a fenilidrossilammina, che si riorganizza in 4-amminofenolo dopo l’aggiunta di acido solforico diluito.
Gli agenti bagnanti, in particolare i sali di ammonio quaternario con gruppi alchilici considerevoli, aumentano la resa di amminofenolo. In genere, la reazione avviene al di sotto di 100 °C e può utilizzare la pressione atmosferica o superiore. L’aggiunta di idrogeno avviene man mano che viene consumato e i solventi organici inerti possono aumentare le rese.
In un metodo alternativo, la riduzione del nitrobenzene si ferma all’88%, creando una miscela bifase contenente nitrobenzene non reagito e il catalizzatore di metallo prezioso. La separazione di fase è sufficiente per la lavorazione, con la fase di nitrobenzene riciclata.
La fase acquosa di acido solforico contiene 4-amminofenolo e anilina che viene rimossa dopo la neutralizzazione. La purificazione e la cristallizzazione producono 4-amminofenolo.
3.1.4. Riduzione elettrolitica
La riduzione elettrolitica offre un’alternativa meno inquinante ai sistemi metallo-acido, ma l’implementazione industriale rimane limitata. L’elettrolisi di nitrobenzene, fenilidrossilammina o azossibenzene in soluzioni acide produce specificamente 4-amminofenolo.
3.2. Sostituzione
La sostituzione di gruppi amminici o idrossilici al posto di vari altri gruppi non è di significativa importanza industriale per la produzione di 2- e 4-amminofenolo. Tuttavia, questo tipo di reazione trova utilità nella sintesi di derivati del 2- e 4-amminofenolo.
Al contrario, la via di riduzione diretta non produce facilmente 3-amminofenolo. La sua produzione comporta principalmente la reazione tra acido 3-amminobenzensolfonico e idrossido di sodio o la reazione del resorcinolo con ammoniaca.
La sostituzione del gruppo acido solfonico nell’acido 3-amminobenzensolfonico è ottenuta tramite un processo di fusione con soda caustica (della durata di 5-6 ore a 240-245 °C), seguito da distillazione sotto vuoto per purificare il prodotto.
Un metodo alternativo comporta la reazione del resorcinolo con ammoniaca, potenzialmente in presenza di fosfato diammonico e pentossido di arsenico o solfito di ammonio, con conseguente formazione di 3-amminofenolo.
Inoltre, il 3-amminofenolo può essere ottenuto tramite l’idrolisi della 3-amminoanilina.
3.3. Purificazione degli amminofenoli
Gli amminofenoli vengono purificati tramite sublimazione a temperature elevate e pressione ridotta.
Per il 3-amminofenolo, la distillazione sotto vuoto è un metodo di purificazione adatto, in cui l’aggiunta di anidride solforosa durante la distillazione o la raccolta del distillato sotto uno strato di un liquido inerte di densità inferiore, come l’acqua, aiuta a ottenere un prodotto incolore.
Un approccio di purificazione alternativo prevede il trattamento delle soluzioni acquose di amminofenoli con carbone attivo. Durante questo processo, l’inclusione di sostanze come solfito di sodio, ditionito di sodio o etilendiamminotetraacetato disodico serve a migliorare la qualità e la stabilità dei prodotti, mentre chela gli ioni di metalli pesanti che potrebbero facilitare l’ossidazione.
L’aggiunta di ditionito di sodio, idrazina o idrosolfito di sodio è inoltre consigliata durante la precipitazione o la cristallizzazione degli amminofenoli.
Per gli amminofenoli, in particolare il 4-amminofenolo prodotto mediante riduzione catalitica, i contaminanti possono spesso essere ridotti o eliminati impiegando varie procedure. Questi metodi includono il trattamento con 2-propanolo, chetoni alifatici, cicloalifatici o aromatici, ammine aromatiche, toluene o acetati alchilici a basso peso molecolare, nonché l’uso di acido fosforico, acido idrossiacetico, acido idrossipropionico o acido citrico.
Anche l’estrazione con cloruro di metilene, cloroformio o nitrobenzene può essere efficace per mitigare o rimuovere i contaminanti.
4. Utilizzi degli amminofenoli
Sia il 2-amminofenolo che il 4-amminofenolo sono potenti agenti riducenti, il che li rende preziosi come sviluppatori fotografici, riconosciuti con nomi commerciali come Atomal e Ortol per il 2-amminofenolo e Activol, Azol, Certinal, Citol, Paranol, Rodinal, Unal e Ursol P per il 4-amminofenolo.
Queste sostanze trovano applicazione sia singolarmente che in combinazione con idrochinone. La forma ossalato del 4-amminofenolo è commercializzata con il nome commerciale Kodelon.
La versatilità degli amminofenoli li rende intermedi essenziali nella sintesi di quasi tutti i tipi di tinte e coloranti. Inoltre, il 2-amminofenolo è impiegato specificamente per esaltare le tonalità di pelle, pelliccia e capelli, che vanno dalle tonalità di grigio e marrone ai toni giallo-marrone.
Per diversi scopi, il 3-amminofenolo funge da colorante per capelli e da agente di accoppiamento nelle formulazioni di tinture per capelli. Nel frattempo, il 4-amminofenolo è parte integrante della sintesi farmaceutica, contribuendo alla produzione di tinte per legno che conferiscono una tinta rosata al legname e agendo come agente colorante per pelliccia e piume.
Data la stretta vicinanza dei gruppi amminico e idrossilico sull’anello benzenico, insieme alla loro predisposizione alla condensazione con reagenti appropriati, il 2-amminofenolo è un precursore chiave nella sintesi di sistemi eterociclici come ossichinoline, fenossamine e benzossazoli che vengono utilizzati come inibitori dell’infiammazione.
Per quanto riguarda il 3-amminofenolo, le sue applicazioni comprendono la stabilizzazione di termoplastici contenenti cloro, sebbene il suo ruolo principale sia quello di intermedio per la produzione di acido 4-ammino-2-idrossibenzoico, un agente tubercolostatico.
Allo stesso modo, i derivati dei 4-amminofenoli sostituiti con azoto sono da tempo riconosciuti per le loro proprietà antipiretiche e analgesiche, contribuendo in modo significativo all’utilizzo del 4-amminofenolo.
5. Tossicologia degli amminofenoli
Gli amminofenoli sono classificati come irritanti. Il loro grado di tossicità varia da lieve a moderato; tuttavia, un’esposizione prolungata o ripetuta può portare a vari effetti avversi, tra cui prurito generalizzato, sensibilizzazione cutanea, dermatite e risposte allergiche.
L’esposizione al 2- e 4-amminofenolo può portare alla produzione spontanea di coniugati immunogenici. Un’altra potenziale preoccupazione è la formazione di metaemoglobina, che provoca cianosi.
L’inalazione di 4-amminofenolo può innescare questa reazione e portare anche ad asma bronchiale. In particolare, il 3-amminofenolo presenta un rischio minore rispetto agli altri isomeri. L’irritazione causata dai derivati solfonati è più lieve rispetto ai composti non solfonati.
Il 2-amminofenolo ha proprietà neuroattive, inducendo scariche di picco quando introdotto nel cerebroventricolo dei ratti. D’altra parte, il 4-amminofenolo è nefrotossico e inibisce significativamente la funzione tubulare prossimale.
Nei mitocondri renali dei ratti, la respirazione, la fosforilazione ossidativa e l’attività dell’ATPasi sono inibite dal 4-amminofenolo. Mentre il 3-amminofenolo non è così pericoloso, sia il 2-amminofenolo che il 4-amminofenolo mostrano effetti teratogeni nei criceti.
L’impatto del 4-amminofenolo si estende all’inibizione della sintesi del DNA e all’alterazione della struttura del DNA nei linfoblasti umani. Inoltre, gli amminofenoli sono stati identificati come agenti genotossici, come dimostrato dall’induzione di scambi di cromatidi fratelli e dai test del micronucleo.
Chiaramente, è essenziale una manipolazione prudente di questi composti e l’esposizione prolungata dovrebbe essere ridotta al minimo. Si raccomandano procedure di rimozione rapida degli indumenti contaminati e lavaggio accurato della zona interessata con acqua corrente per almeno 10 minuti.
Riferimenti
- Amminofenoli; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_099
- Amminofenoli; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0113091413092003.a01.pub2
