Cyclohexylamine : propriétés, réactions, production et utilisations
Qu’est-ce que la cyclohexylamine ?
La cyclohexylamine, également connue sous le nom d’aminocyclohexane, est une amine primaire aliphatique de formule chimique C6H13N. C’est un liquide incolore qui est miscible à l’eau et aux solvants organiques courants.
Table des matières
1. Propriétés physiques de la cyclohexylamine
La cyclohexylamine est un liquide incolore à l’odeur d’ammoniaque ou de poisson, très soluble dans l’éthanol, l’éther, l’acétone et les solvants organiques courants. Elle forme un azéotrope avec l’eau qui bout à 96,4 °C et contient 44,2 % de cyclohexylamine.
Les propriétés physiques de la cyclohexylamine sont répertoriées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Numéro CAS | [108-91-8] |
| Formule chimique | C6H13N |
| Poids moléculaire | 99,18 g/mol |
| Point de fusion | -17,8 °C |
| Point d'ébullition | 134,5 °C |
| Densité | 0,8647 g/cm3 |
| Indice de réfraction | 1,4592 |
| Viscosité à 20 °C | 2,10 Pa·s |
| pKa | 10,63 |
| Densité de vapeur | 3,42 |
| Pression de vapeur | 1,4 kPa à 20 °C |
| Capacité thermique spécifique à 20 °C | 2,366 J g-1K-1 |
| Chaleur de vaporisation | 399,86 J/g |
| Point d'éclair (coupe fermée) | 26,5 °C |
| Température d'inflammation | 265 °C |
| Plage d'inflammation dans l'air | 1,6–9,4 vol% |
2. Réactions chimiques de la cyclohexylamine
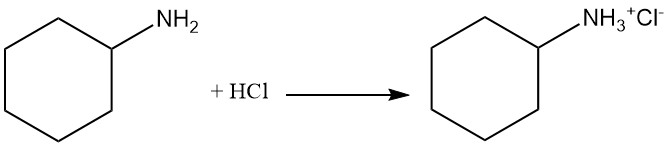
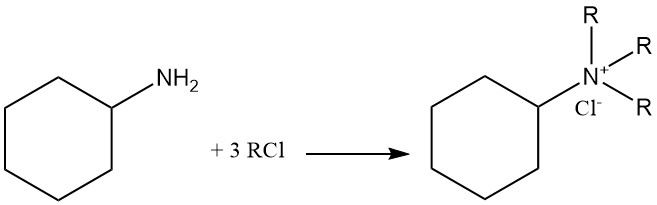
La cyclohexylamine est une base faible avec un pKb de 3,4 qui a une réactivité similaire à celle des amines aliphatiques primaires. Elle forme des sels avec les acides de Brønsted et de Lewis. L’alkylation exhaustive conduit à la formation de cations ammonium quaternaire.
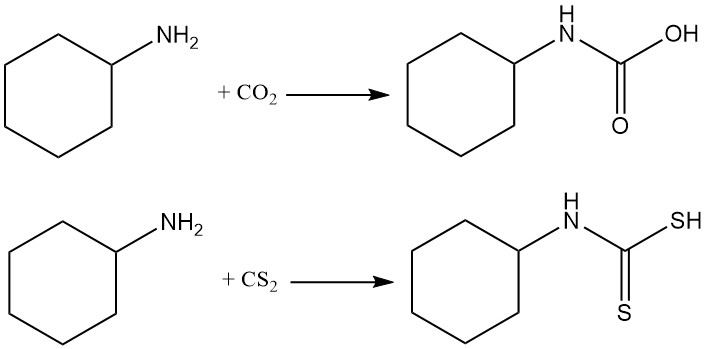
La cyclohexylamine réagit avec le dioxyde de carbone et le disulfure de carbone pour produire respectivement des carbamates et des thiocarbamates.
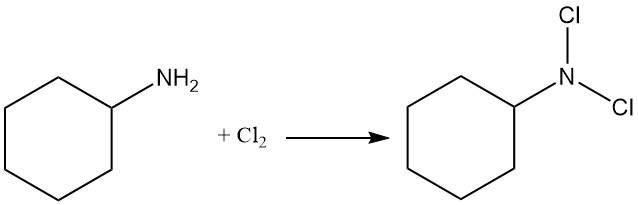
La réaction de la cyclohexylamine avec le chlore produit de la N,N-dichlorocyclohexylamine.
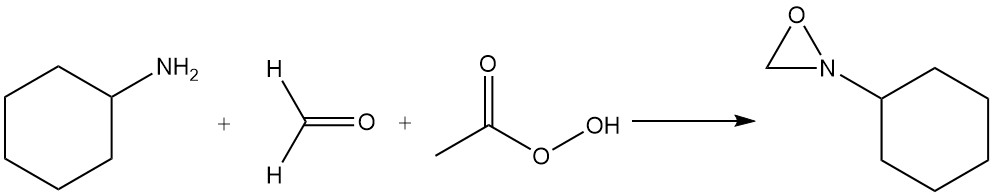
La 2-cyclohexyloxaziridine est préparée par réaction d’un mélange de cyclohexylamine, de formaldéhyde et d’acide peracétique.
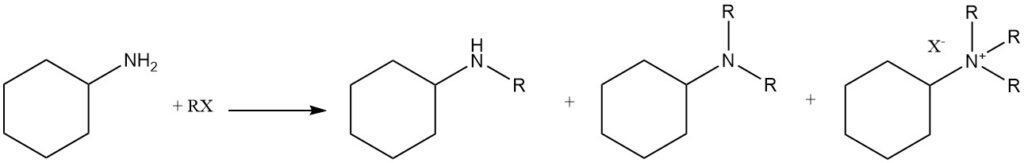
La N-alkylation de la cyclohexylamine peut être réalisée en utilisant divers agents alkylants, notamment des halogénures d’alkyle, des sulfates et des phosphates. En variante, des alcools peuvent être utilisés comme composés alkylants en présence de métaux catalytiques (aluminium, cuivre, nickel, cobalt ou platine) ou dans des conditions de Leuckart-Wallach.
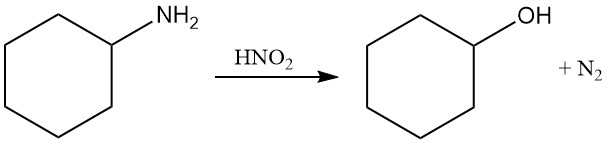
La cyclohexylamine subit une diazotation avec de l’acide nitreux pour former de l’azote gazeux et du cyclohexanol.
Les chlorures d’acide réagissent avec la cyclohexylamine dans des conditions de Schotten-Baumann pour former des amides de cyclohexyle.
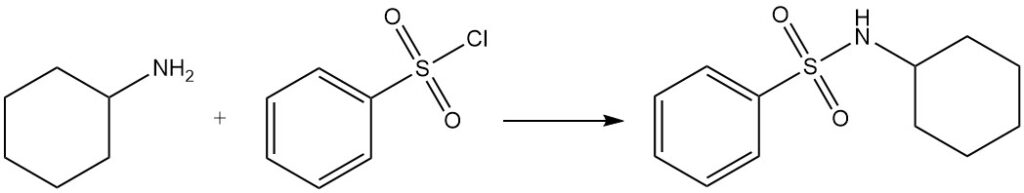
Le chlorure de benzènesulfonyle réagit avec la cyclohexylamine pour produire du N-cyclohexylbenzènesulfonamide, qui est soluble dans les solutions alcalines (test de Hinsberg).
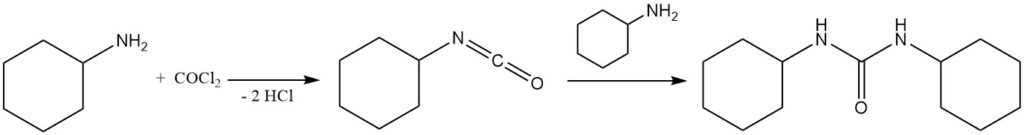
Le phosgène réagit avec la cyclohexylamine pour former de l’isocyanatocyclohexane, qui réagit à son tour avec la cyclohexylamine pour former la 1,3-dicyclohexylurée.
En raison du caractère nucléophile de la cyclohexylamine, elle réagit avec les époxydes pour produire des dérivés d’hydroxyalkylamine et de dihydroxyalkylamine.
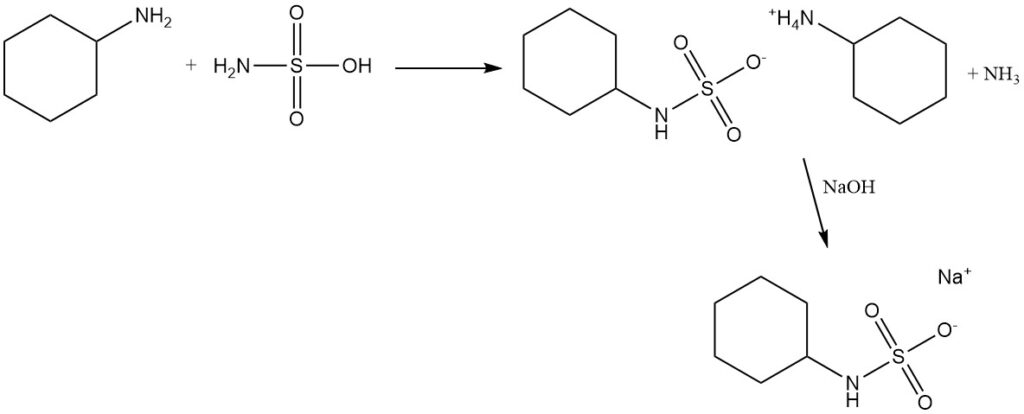
La cyclohexylamine de haute pureté réagit avec l’acide sulfamique, puis est traitée avec de l’hydroxyde de sodium ou de l’hydroxyde de calcium, pour former du cyclohexylsulfamate de sodium ou de calcium, qui sont des édulcorants artificiels utilisés dans le passé.
La réaction de condensation de la cyclohexylamine avec le mercaptobenzothiazole produit du N-cyclohexyl-2-benzothiazolesulfénamide, qui est utilisé comme accélérateur modéré du caoutchouc.
3. Production industrielle de cyclohexylamine
La cyclohexylamine est produite commercialement par la réaction du cyclohexanol avec de l’ammoniac et de l’hydrogène en phase vapeur à l’aide de catalyseurs métalliques tels que Ni ou Co.
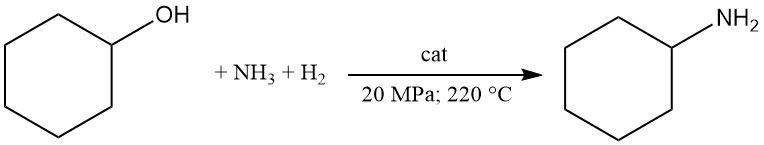
Dans ce procédé, le cyclohexanol réagit à 20 MPa et 220 °C avec au moins 3 moles d’ammoniac en présence d’hydrogène circulant sur un catalyseur à lit fixe.
Un rapport d’alimentation ammoniac/cyclohexanol accru favorise la formation de cyclohexylamine et réduit la formation du sous-produit dicyclohexylamine.
L’amination réductrice de la cyclohexanone à l’aide d’un procédé continu est une autre méthode de production de cyclohexylamine. Dans ce procédé, l’hydrogène et l’ammoniac sous pression réagissent avec la cyclohexanone sur des catalyseurs au nickel ou au cobalt à 0,1–20 MPa et à des températures élevées jusqu’à 275 °C.

Un rapport ammoniac-cyclohexanone de 3,3:1 et un rapport hydrogène-cyclohexanone de 6,5:1 ont été revendiqués.
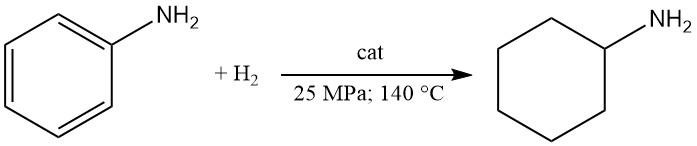
La cyclohexylamine est produite par hydrogénation en phase liquide d’aniline sur un catalyseur cobalt-alumine à 25 MPa et 140 °C avec un rendement de 80 %. Cependant, l’hydrogénation en phase vapeur sur nickel sur pierre ponce favorise la formation de dicyclohexylamine.
Le choix des catalyseurs et des conditions de réaction influence la sélectivité de la réaction pour la cyclohexylamine. Par exemple, si l’aniline est hydrogénée à 160–200 °C en présence d’un catalyseur ruthénium-palladium supporté sur γ-alumine, le mélange final ne contient que 19,3 % de cyclohexylamine et 80,3 % de dicyclohexylamine.
Une sélectivité élevée pour la cyclohexylamine est obtenue en ajoutant de l’ammoniac pendant l’hydrogénation de l’aniline à 160 à 180 °C et 2 à 5 MPa en utilisant un catalyseur ruthénium sur charbon.
La cyclohexylamine est également fabriquée à l’échelle commerciale par hydrogénation du nitrobenzène sans séparation d’aniline intermédiaire.
La synthèse directe de cyclohexylamine à partir de phénol à l’aide de catalyseurs au rhodium ou au nickel a été explorée, mais avec une sélectivité plus faible envers la cyclohexylamine par rapport à la dicyclohexylamine.
La cyclohexylamine est purifiée à partir de sous-produits par distillation sous pression réduite.
4. Utilisations de la cyclohexylamine
La cyclohexylamine est un composé miscible à l’eau qui forme un azéotrope avec l’eau. Elle est utilisée comme inhibiteur de corrosion dans les systèmes à vapeur basse pression car elle forme un film protecteur et est un agent neutralisant les acides.
En 2000, environ 55 % de la production américaine de cyclohexylamine était consacrée à cette application. Par rapport à la morpholine, la cyclohexylamine offre une stabilité chimique supérieure dans les environnements à haute pression et ne forme pas de nitrosamine.
Elle est utilisée comme inhibiteur de corrosion pour les solutions d’alcool de radiateur et également dans les industries du papier et du revêtement des métaux pour la protection contre l’humidité et l’oxydation.
Au-delà de l’inhibition de la corrosion, la cyclohexylamine est utilisée comme accélérateur de vulcanisation, additif anticorrosif et précurseur de divers composés, notamment des plastifiants, des émulsifiants, des coagulants et des durcisseurs époxy.
Ses sels avec des acides gras empêchent la formation de mousse dans les huiles minérales. La cyclohexylamine est également utilisée comme terminateur de chaîne dans la polymérisation du polyamide et comme précurseur d’herbicides comme l’hexazinone. Elle fonctionne également comme durcisseur pour les résines époxy et comme catalyseur pour les polyuréthanes.
Historiquement, la cyclohexylamine était utilisée dans la production d’édulcorants à base de cyclamate.
Les principaux producteurs de cyclohexylamine sont US Amines, Air Products, BASF, Borsodchem, Jintian Enterprises et New Japan Chemical Co.
5. Toxicologie de la cyclohexylamine
La cyclohexylamine est un liquide alcalin facilement absorbé par voie orale et respiratoire, bien que l’absorption cutanée soit plus lente. L’excrétion urinaire rapide se produit avec une altération métabolique minimale. Le composé possède une forte odeur de poisson avec un seuil d’odeur d’environ 2,5 ml/m³.
L’exposition humaine à la cyclohexylamine peut induire des effets sympathomimétiques à des doses quotidiennes de 5 mg/kg. Des études toxicologiques approfondies ont été menées en raison de son association avec l’édulcorant saccharine.
Des études d’alimentation à long terme sur des rongeurs n’ont révélé aucun effet cancérigène, mutagène ou tératogène à des doses allant jusqu’à environ 20 mg/kg par jour. Des études de fertilité sur des rats n’ont montré aucun effet nocif, malgré une atrophie testiculaire mineure à des doses plus élevées.
Des limites d’exposition professionnelle ont été établies pour protéger la santé humaine. Une étude d’inhalation de 4 heures sur des humains a montré une irritation à 10 ml/m³, tandis qu’une concentration moyenne pondérée dans le temps de 2 ml/m³ a été bien tolérée.
Par conséquent, la concentration maximale sur le lieu de travail (valeur MAK) a été fixée à 2 ml/m³ avec une catégorie de limitation de pointe de I.
Des études de toxicité aiguë sur des animaux indiquent une DL50 orale de 710 mg/kg chez le rat et une DL50 cutanée de 320 mg/kg chez le lapin.
Références
- Amines, Aliphatic, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
- Amines, Cycloaliphatic. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0325031203011905.a01.pub2
- Aniline and Its Derivatives. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0114091201130914.a01.pub2
- Cyclohexylamine [MAK Value Documentation, 2017]. – https://onlinelibrary.wiley.com/doi/10.1002/3527600418.mb10891e6218
