Brenztraubensäure: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist Brenztraubensäure?
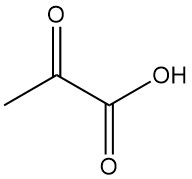
Brenztraubensäure, auch bekannt als 2-Oxopropansäure, Pyroracemsäure oder α-Ketopropionsäure, ist eine wichtige α-Oxocarbonsäure mit der Formel C3H4O3. Sie ist eine farblose Flüssigkeit mit einem Geruch ähnlich dem von Essigsäure, die eine wichtige Rolle im Energiestoffwechsel lebender Organismen spielt.
Brenztraubensäure wird während Belastungsphasen aus Glykogen im Muskelgewebe synthetisiert und anschließend zu Milchsäure reduziert. Der Leberstoffwechsel von Brenztraubensäure zu Alanin erfolgt durch reduktive Aminierung.
Die erste Entdeckung und Beschreibung der Brenztraubensäure wird Berzelius im Jahr 1835 zugeschrieben.
Inhaltsverzeichnis
1. Physikalische Eigenschaften der Brenztraubensäure
Brenztraubensäure ist eine farblose Flüssigkeit mit einem Geruch wie saurer Essig. Sie ist mit Wasser, Ethanol und Ether mischbar und kommt nur in der Ketoform vor; die Enolform wurde bisher nicht nachgewiesen.
Die wichtigsten physikalischen Eigenschaften der Brenztraubensäure sind in der folgenden Tabelle zusammengefasst.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [127-17-3] |
| Chemische Formel | H3C-CO-COOH |
| Molekulargewicht | 88,06 g/mol |
| Schmelzpunkt | 13,6 °C |
| Siedepunkt Punkt | bei 101,31 kPa: 165 °C (Zersetzung) bei 1,33 kPa: 57,9 °C bei 0,13 kPa: 21,4 °C |
| Dichte (20 °C) | 1,268 g/cm3 |
| Brechungsindex (25 °C) | 1,4259 |
| pKa | 2,45 (bei 25 °C) |
| Dampfdruck | 1,29 mmHg |
| Flammpunkt | 91 °C |
| Zündtemperatur | 305 °C |
2. Chemische Reaktionen der Brenztraubensäure
Brenztraubensäure reagiert sowohl als Carbonsäure als auch als Keton und bildet Derivate wie Oxime, Hydrazone und Salze.
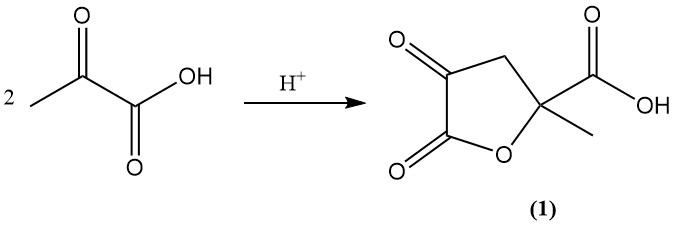
Unter sauren Bedingungen oder beim Stehen wird Brenztraubensäure in 4,5-Dioxo-2-methyltetrahydrofuran-2-carbonsäure umgewandelt (1).
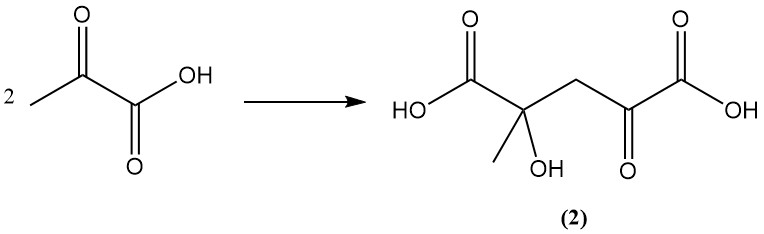
Wässrige Brenztraubensäurelösungen polymerisieren über Ketoglutarsäure (2) und die trimeren Aldolprodukte zu höhermolekularen Produkten.
Ähnlich wie andere 2-Oxosäuren spaltet Brenztraubensäure bei der Behandlung mit konzentrierter Schwefelsäure Kohlenmonoxid ab.
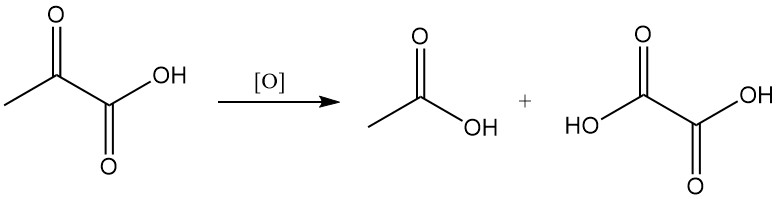
Die Oxidation von Brenztraubensäure ergibt je nach Reaktionsbedingungen Essig- oder Oxalsäure und Kohlendioxid.
Durch Reduktion von Brenztraubensäure entsteht Milchsäure.
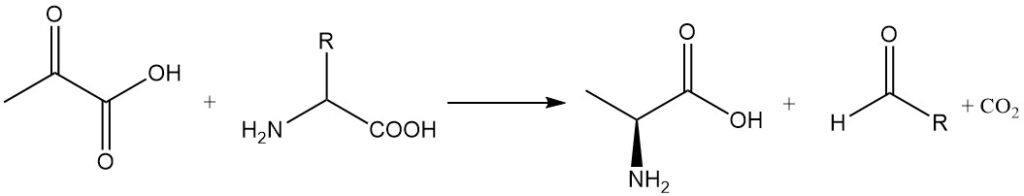
Transaminierungsreaktionen zwischen Brenztraubensäure und α-Aminosäuren ergeben Alanin und die entsprechenden Aldehyde mit einem Kohlenstoffatom weniger. Alanin kann auch durch reduktive Aminierung von Brenztraubensäure synthetisiert werden.
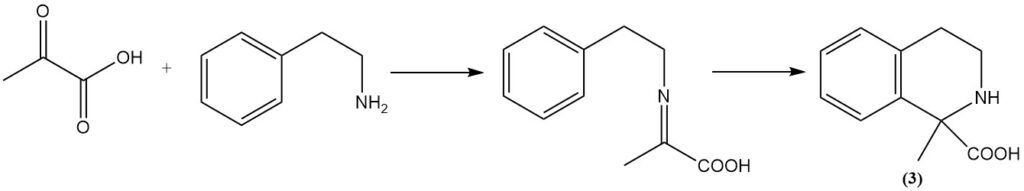
Die Bischler-Napieralski-Reaktion von Phenylethylamin mit Brenztraubensäure ergibt das entsprechende Tetrahydroisochinolin (3).
Brenztraubensäure reagiert mit o-Phenylendiaminen zu Chinoxalinolen und mit 4,5-Diaminopyrimidinen zu Hydroxypteridinen.
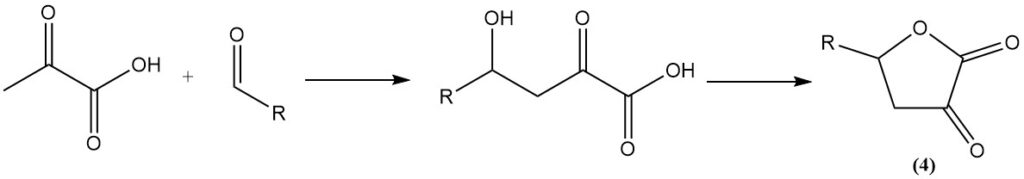
Die Reaktion von Aldehyden mit Brenztraubensäure ergibt α-Keto-γ-Hydroxysäuren, die anschließend zu Butyrolacton-Derivaten cyclisieren (4).
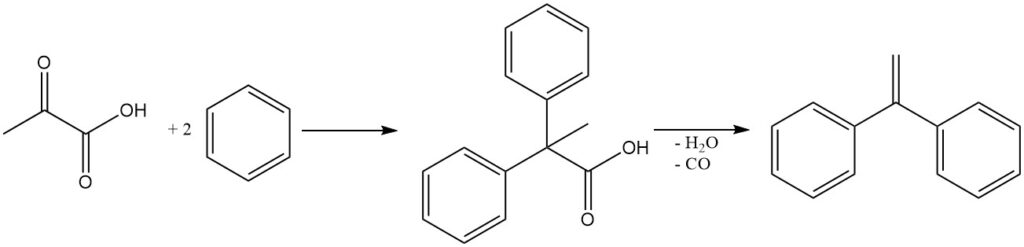
Diarylpropionsäuren werden durch Friedel-Crafts-Reaktionen aus Brenztraubensäure und aromatischen Verbindungen hergestellt. Diese Verbindungen werden als Zwischenprodukte bei der Synthese von 1,1-Diarylethylen durch Dehydratation und Decarbonylierung verwendet.
3. Industrielle Produktion von Brenztraubensäure
Industriell wird Brenztraubensäure durch Dehydratation und Decarboxylierung von Weinsäure hergestellt.
Bei diesem Verfahren wird Brenztraubensäure aus einer Mischung von Weinsäure und Kalium- und Natriumhydrogensulfat bei 220 °C destilliert. Die in einer Ausbeute von etwa 60 % erhaltene Rohsäure wird anschließend zur Reinigung einer Vakuumdestillation unterzogen. Durch Zugabe von Ethylenglykol kann die Reaktionstemperatur auf 160 °C gesenkt werden.
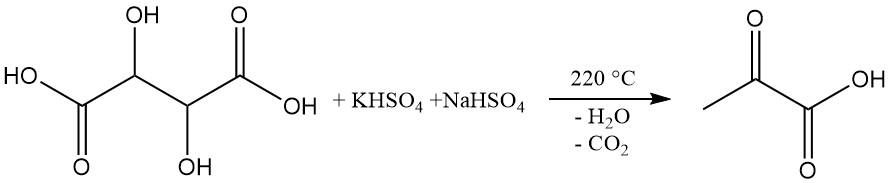
Zu den alternativen Herstellungsverfahren gehört die Gasphasenoxidation von Milchsäure, obwohl dieses Verfahren keinen industriellen Erfolg erzielt hat.
Im Gegensatz dazu bietet der mikrobielle Oxidationsprozess von D-Milchsäure eine hohe Ausbeute. Darüber hinaus kann Brenztraubensäure durch die mikrobielle Oxidation von Propylenglykol oder die Hydrolyse von 2,2-Dihalogenpropionsäuren hergestellt werden. Ein weiteres synthetisches Verfahren ist die Halogenoxidation von Methylglyoxal.
4. Verwendung von Brenztraubensäure
Brenztraubensäure wird hauptsächlich als Zwischenprodukt bei der Synthese von Arzneimitteln wie antimikrobiellen, entzündungshemmenden und kardiovaskulären Arzneimitteln verwendet.
Sie wird auch bei der Herstellung von Kosmetika aufgrund ihrer peelenden und hauterneuernden Eigenschaften verwendet. Sie wird häufig in chemischen Peelings verwendet.
Brenztraubensäure wird in der Lebensmittelindustrie als Aromastoff verwendet. Sie wird häufig bei der Herstellung von Käse, Joghurt und anderen Milchprodukten eingesetzt. Es trägt zur Farbe und zum Geschmack von Brot und Gebäck bei und verbessert den Geschmack von verarbeitetem Fleisch.
Neben seinen geschmacksverstärkenden Eigenschaften wirkt Brenztraubensäure aufgrund ihrer antimikrobiellen Wirkung auch als Konservierungsmittel in einigen Lebensmitteln.
Brenztraubensäure wird auch bei der Herstellung von Pflanzenschutzmitteln und Polymeren verwendet.
5. Toxikologie der Brenztraubensäure
Brenztraubensäure ist ätzend und reizt Augen, Haut und Atemwege.
Akute Toxizität
- Verschlucken: schwere Verätzungen im Mund- und Rachenraum, mit der Gefahr einer Perforation der Speiseröhre und des Magens.
- Einatmen: ätzend für die Atemwege.
- Hautkontakt verursacht schwere Verätzungen.
- Augenkontakt verursacht schwere Augenschäden.
Andere toxikologische Wirkungen
- Es liegen keine Daten zu Hautreizungen oder Sensibilisierung vor.
- Der Ames-Test auf Mutagenität war negativ.
- IARC, NTP und OSHA klassifizieren Brenztraubensäure nicht als Karzinogen.
- Daten zur Reproduktionstoxizität liegen nicht vor.
- Es liegen keine Informationen zu spezifischer Zielorgantoxizität oder Aspiration vor. Gefahren.
Referenzen
- Oxocarboxylic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a18_313
- https://www.sciencedirect.com/topics/chemistry/bischler-napieralski-reaction
- https://pubchem.ncbi.nlm.nih.gov/compound/Pyruvic-Acid
- https://www.sigmaaldrich.com/US/en/sds/Aldrich/W297003
- https://chemistry-europe.onlinelibrary.wiley.com/doi/abs/10.1002/cber.19380711024
