Chlorure cyanurique : propriétés, réactions, production et utilisations
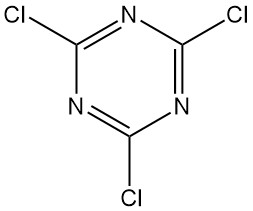
Qu’est-ce que le chlorure cyanurique ?
Le chlorure cyanurique, également connu sous le nom de 2,4,6-trichloro-1,3,5-triazine, est un composé organique de formule C3N3Cl3. Il se présente sous la forme d’un solide cristallin incolore à l’odeur piquante. C’est le dérivé chloré de la 1,3,5-triazine et le trimère du chlorure de cyanogène.
Table des matières
1. Propriétés physiques du chlorure cyanurique
Le chlorure cyanurique forme des cristaux monocliniques incolores d’odeur piquante, rappelant l’acétamide et les chlorures d’acide. Il est soluble dans la plupart des solvants organiques mais insoluble dans l’eau.
Le tableau 1 montre la solubilité (en % en poids) du chlorure cyanurique dans divers solvants à 25 °C.
| Solvant | Solubilité (% en poids) |
|---|---|
| Acétone | 25,0 |
| Acétonitrile | 21,0 |
| Acrylonitrile | 19,0 |
| Benzène | 19,0 |
| Chlorobenzène | 16,0 |
| Tétrachlorométhane | 7,5 |
| Éther diéthylique | 14,0 |
| Dioxane | 55,0 |
| Acétate d'éthyle | 21,0 |
| Méthylvinylcétone | 27,0 |
| Nitrobenzène | 18,0 |
| Tétrahydrofurane | 43,0 |
| Trichlorométhane | 20,0 |
| Toluène | 18,5 |
Le chlorure cyanurique se sublime avant d’atteindre le point d’ébullition. La pression de vapeur du chlorure cyanurique liquide en fonction de la température est donnée par l’équation suivante :
ln p (mmHg) = -0,33480-742,7311/T(K)+11,15147 ln T(K)
Les propriétés physiques importantes du chlorure cyanurique sont répertoriées dans le tableau suivant.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [108-77-0] |
| Formule | C3N3Cl3 |
| Poids moléculaire | 184,5 g/mol |
| Point triple | 145,7 °C à 255 kPa |
| Point d'ébullition point | 194 °C |
| Densité (solide) | 1,92 g/cm3 |
| Densité (fusion) | 1,48 g/cm3 |
| Capacité thermique | 0,99 kJ kg-1 K-1 à 150 °C |
| Chaleur de fusion | 123 kJ/kg |
| Chaleur de vaporisation | 256 kJ/kg |
2. Réactions du chlorure cyanurique
Dans des conditions anhydres, le chlorure cyanurique agit comme agent de chloration. Les alcools et les amines tertiaires sont convertis en chlorures d’alkyle, tandis que les acides carboxyliques dans l’acétone anhydre avec la triéthylamine forment des chlorures d’acide, qui sont isolés ou utilisés in situ pour la production d’esters et d’amides. L’acide cyanurique est un sous-produit dans les deux cas.
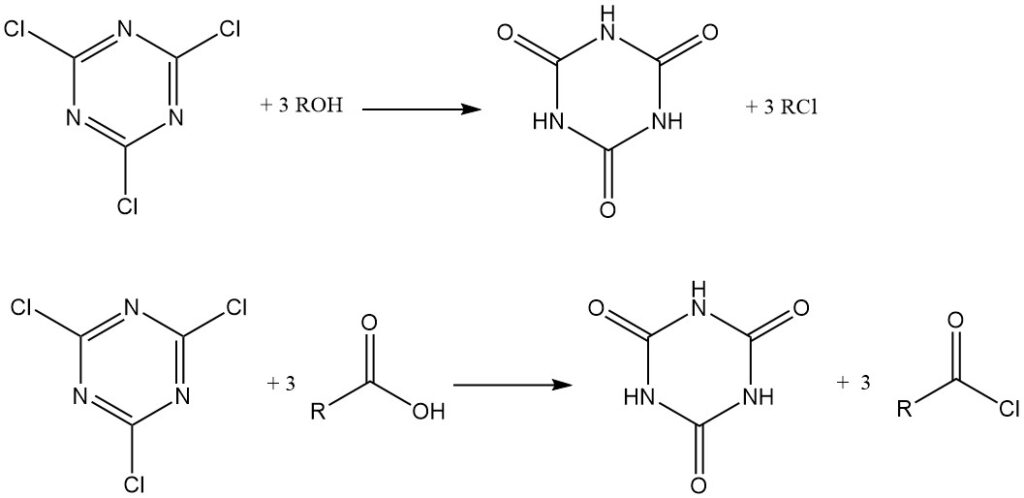
Il peut également être utilisé comme réactif de condensation (déshydratation). Les amides, les thioamides et les aldoximes peuvent être convertis en nitriles.
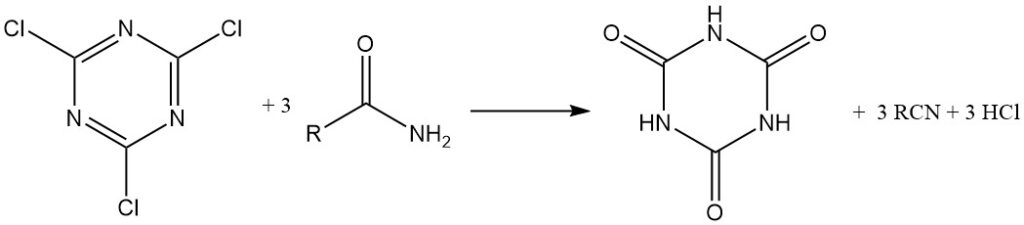
Dans des conditions anhydres, les amines aliphatiques tertiaires réagissent avec le chlorure cyanurique pour former des dérivés de mélamine substitués, avec un groupe alkyle converti en chlorure d’alkyle correspondant.
Le chlorure cyanurique réagit généralement comme le chlorure d’acide, formant du chlorure d’hydrogène. Bien qu’une suspension dans de l’eau glacée présente une certaine stabilité (jusqu’à 12 heures à 0 °C), l’hydrolyse est accélérée lorsque la température augmente, avec plus de 40 % hydrolysés en 1 heure à 30 °C. L’acide cyanurique est le produit final de l’hydrolyse.
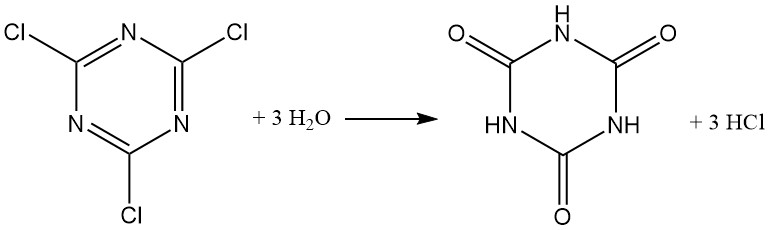
Les milieux aqueux alcalins (NaOH ou NaHCO3 à 40 °C) favorisent la formation de 2,4-dichloro-6-hydroxy-1,3,5-triazine. Un excès de base donne de la 2,4-dihydroxy-6-chloro-1,3,5-triazine. La formation de cyanurate trisodique ne se produit qu’au-dessus de 125 °C.
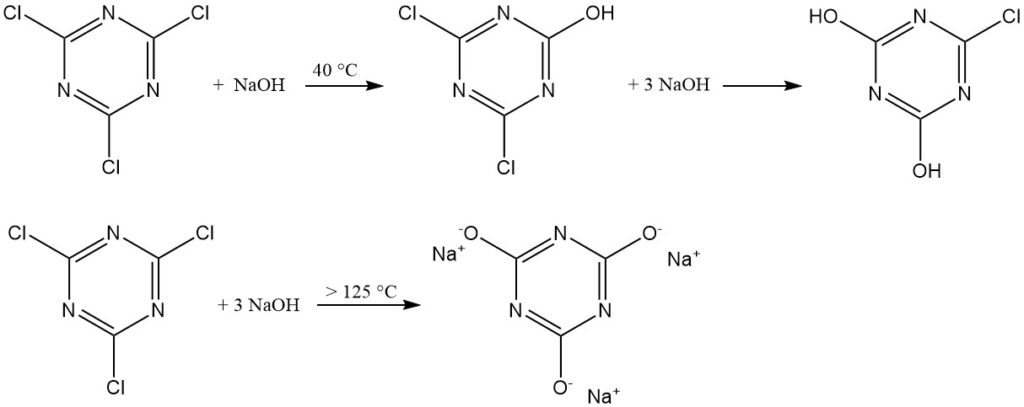
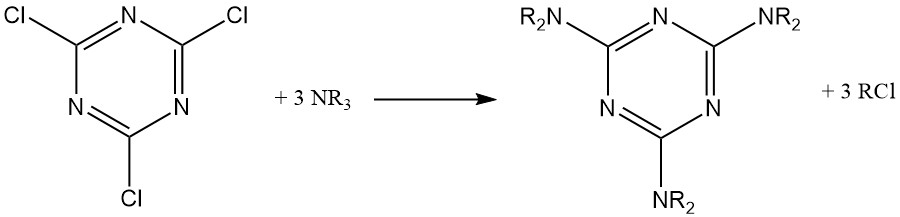
La stabilité temporaire du chlorure cyanurique dans l’eau permet des réactions avec des nucléophiles puissants (tels que les alcools, les thiols et les amines primaires et secondaires) dans des suspensions d’eau glacée. Ces réactions se déroulent souvent étape par étape pour obtenir une trisubstitution à des températures contrôlées.
Une règle empirique suggère de remplacer le premier chlore à 0–5 °C, le deuxième à 30–50 °C et le troisième à 70–100 °C pour les substituants amine. Les piégeurs de HCl comprennent l’hydroxyde de sodium, l’hydrogénocarbonate de sodium, l’hydrogénophosphate disodique et les amines tertiaires.
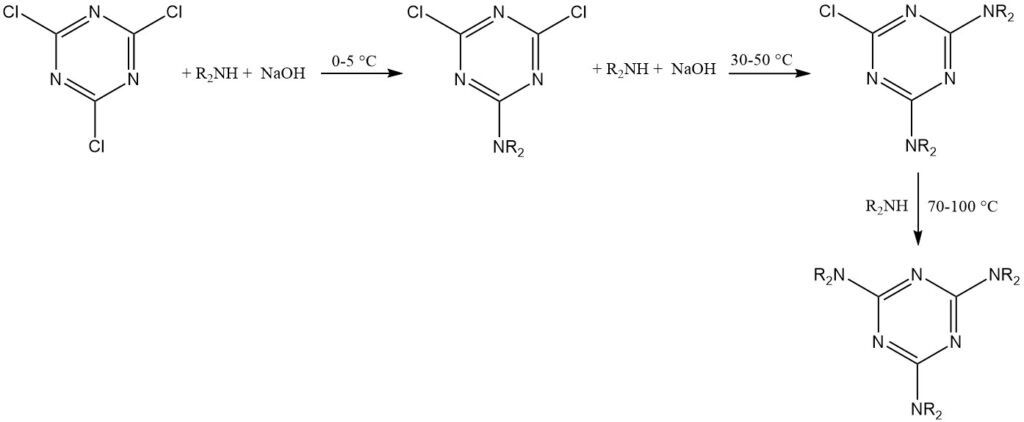
Le produit triazine est généralement isolé par filtration ou centrifugation. L’acétone, la méthyléthylcétone ou le toluène sont des solvants courants pour ces réactions.
Le chlorure cyanurique (en fusion ou en poudre) est dissous/suspendu dans le solvant avec le nucléophile, puis traité avec de la soude aqueuse. Le produit est isolé de la couche organique par évaporation ou filtration.
Cette méthode permet l’introduction séquentielle de divers substituants à différentes températures. Des solvants à point d’ébullition élevé ou le réactif fondu peuvent être nécessaires pour remplacer le troisième atome de chlore.
La neutralisation de l’acide chlorhydrique libéré et la dissipation de chaleur pendant les réactions sont cruciales. L’hydrolyse exothermique du chlorure cyanurique (ΔH = -2164 kJ/kg) peut devenir incontrôlable, en particulier dans la production de cyanurate à partir d’alcools.
Les solvants miscibles à l’eau accélèrent l’hydrolyse. Le stockage de solutions de chlorure cyanurique dans de l’acétone aqueuse sans évacuation adéquate de la chaleur peut entraîner des réactions incontrôlables, même à température ambiante.
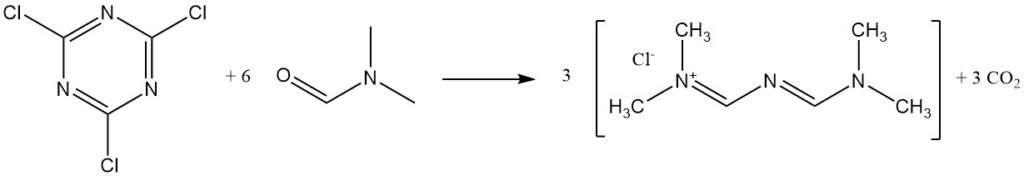
Le chlorure cyanurique réagit avec le DMF pour former le sel de Gold.
3. Production de chlorure cyanurique
Les installations de production de chlorure cyanurique sont généralement situées à proximité d’usines d’acide cyanhydrique (HCN), la principale matière première. Le cyanure de sodium peut également être utilisé, mais dans une moindre mesure.
Le processus de production de chlorure cyanurique comprend deux étapes principales : la chloration de HCN en chlorure de cyanogène (ClCN) et la trimérisation de ClCN en chlorure cyanurique.
Tout d’abord, HCN réagit avec le chlore (Cl2) dans un réacteur en boucle à des températures modérées entre 20 et 40 °C pour former ClCN. Cette réaction est exothermique (ΔH = -89 kJ/mol).
Ensuite, le ClCN est séparé, purifié, puis trimérisé (combinant trois molécules en une seule) sur du charbon actif à des températures supérieures à 300 °C. Cette étape est également exothermique (ΔH = -233 kJ/mol).
La figure 1 illustre un processus détaillé de production de chlorure cyanurique à partir de chlore et d’acide cyanhydrique.
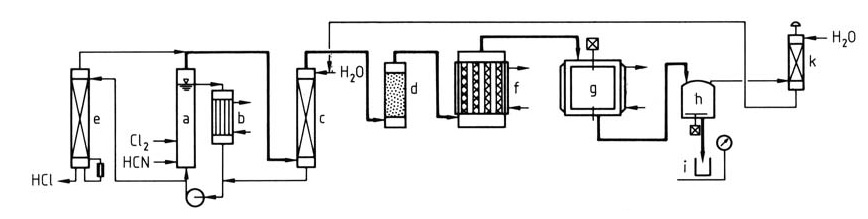
a) Réacteur ClCN ; b) Échangeur de chaleur ; c) Épurateur ; d) Sécheur ; e) Épurateur d'effluents ; f) Trimériseur ; g) Condenseur ; h) Stockage ; i) Tambour ; k) Épurateur de gaz de queue
Un mélange de HCN et de Cl2 est introduit dans le réacteur en boucle (a et b). La solution aqueuse saturée de ClCN sort de la boucle, puis le ClCN est lavé à l’eau (c) pour éliminer les impuretés et séché (d).
L’eau de lavage contenant du HCl est envoyée dans un stripper (e) pour récupérer le ClCN dissous et libérer le HCl concentré pour une utilisation ultérieure. Alternativement, les sections (e), (a) et (c) peuvent être combinées en une seule unité. Le ClCN purifié et sec subit une trimérisation (f) sur charbon actif pour former des vapeurs de chlorure cyanurique.
Les vapeurs sont condensées en chlorure cyanurique fondu ou solide (g). Le produit peut être dissous dans un solvant pour une utilisation en captivité ou conditionné dans des conteneurs (h et i). Les gaz résiduaires sont épurés et recyclés (k) pour minimiser les déchets.
Ce procédé permet généralement d’obtenir des rendements en ClCN supérieurs à 95 % et des rendements en chlorure cyanurique supérieurs à 90 %.
Plusieurs variantes visent à éliminer la formation de HCl dilué pendant la production de ClCN. Il s’agit notamment de réactions en phase gazeuse en une étape utilisant du charbon de bois, du tétrachloroéthane ou du cyanogène et du chlore sur charbon de bois.
D’autres catalyseurs pour la trimérisation de ClCN, comme le chlorure cyanurique fondu, les chlorures métalliques, les mélanges eutectiques et les zéolites, ont été explorés.
En laboratoire, les solutions de ClCN dans des solvants organiques tels que le benzène et le chloroforme peuvent être trimérisées à l’aide de HCl. Les procédés commerciaux peuvent utiliser l’azéotrope chlorure d’hydrogène-éther diméthylique pour la trimérisation.
L’équipement de production de ClCN utilise des matériaux résistants à la corrosion, tels que le verre, les fluoropolymères, le graphite ou des résines spéciales. Les équipements de production de chlorure cyanurique utilisent généralement du nickel, de l’acier inoxydable ou de l’aluminium.
L’humidité est une préoccupation importante dans ce processus et peut provoquer une corrosion grave. Un équipement, des matériaux et des procédures de manipulation appropriés sont importants pour réduire ce risque.
4. Utilisations du chlorure cyanurique
Le chlorure cyanurique est utilisé comme précurseur de pesticides et d’herbicides, dans la production de colorants, d’azurants et de stabilisateurs de lumière UV dans les plastiques et dans la synthèse organique.
Les dérivés du chlorure cyanurique les plus importants sont les aminotriazines, en particulier les alkylaminotriazines, qui sont utilisés comme pesticides et herbicides. Les herbicides à base de triazine restent parmi les plus réussis commercialement, la plupart des formulations contenant du 2-chloro- ou du 2-méthylthio-4,6-dialkylamino-1,3,5-triazines.
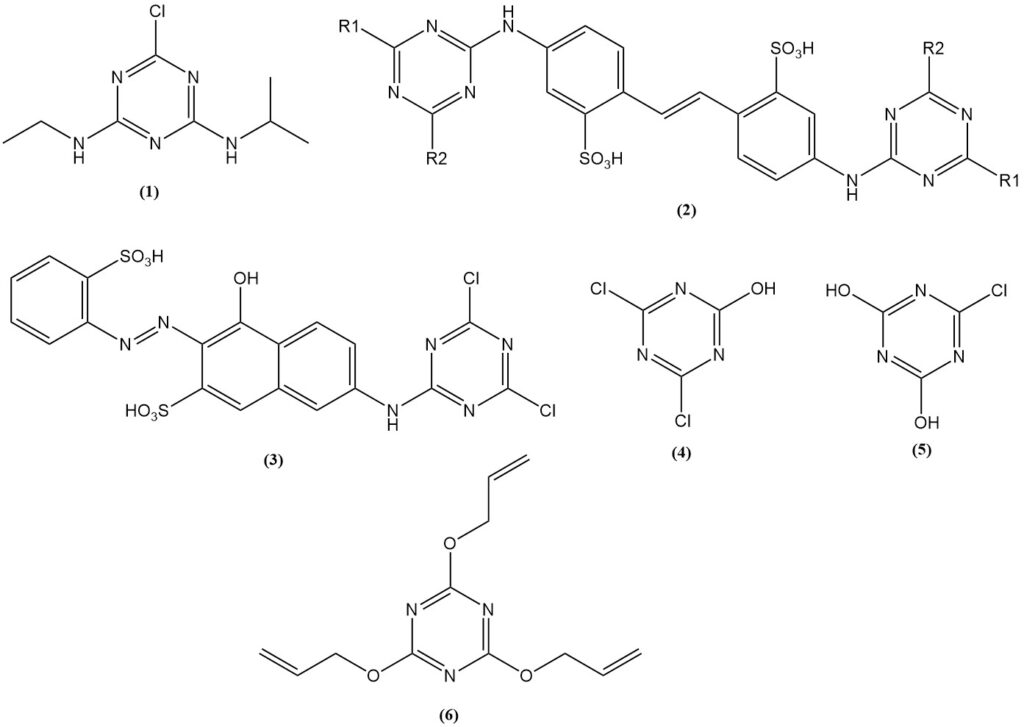
L’atrazine (1) est l’herbicide triazine le plus important, représentant plus de 70 % de la consommation de chlorure cyanurique dédiée à la production d’herbicides. Les herbicides à base de triazine sont fabriqués dans le monde entier.
Moins de 30 % de la production de chlorure cyanurique est utilisée dans d’autres applications industrielles, telles que les azurants optiques, les stabilisateurs UV, les colorants réactifs et les agents de réticulation.
Les produits de réaction des aminostilbènes avec des triazines substituées, en particulier les acides bis(triazinylamino)stilbènedisulfoniques (2), sont utilisés comme agents de blanchiment pour les tissus et le papier.
Les dérivés de colorants préparés à partir du chlorure cyanurique peuvent réagir chimiquement avec les tissus. Les colorants Procion (3) ont été parmi les premiers.
Le chlorure cyanurique et les cyanurates sont utilisés dans la production de gélatine et de colles. Les exemples incluent les sels de sodium de 2,4-dichloro-6-hydroxy-1,3,5-triazine (4) et de 2,4-dihydroxy-6-chloro-1,3,5-triazine (5). De plus, le cyanurate de triallyle (6) est utilisé dans les industries du caoutchouc et des plastiques.
Les triazines ont diverses autres utilisations, notamment comme modificateurs, accélérateurs, retardateurs de flamme, produits pharmaceutiques, antioxydants, antiozonants et capteurs de métaux lourds.
5. Toxicologie du chlorure cyanurique
Le chlorure cyanurique est un irritant grave pour la peau, les muqueuses (y compris les yeux), les voies respiratoires et le tractus gastro-intestinal. Son seuil d’irritation d’une minute pour les muqueuses est exceptionnellement bas, à 0,3 mg/m³. Des réactions allergiques peuvent également se produire.
Le contact direct avec le chlorure cyanurique doit être strictement évité. Assurez une ventilation adéquate dans les environnements de travail.
Lors de la manipulation de vapeurs ou de poussières de chlorure cyanurique, portez un masque à gaz complet équipé d’une cartouche de charbon actif ou utilisez un appareil respiratoire autonome.
Le chlorure cyanurique est étiqueté avec le symbole de danger Xi et est associé aux phrases de risque (phrases R) R 36/37/38, indiquant une irritation des yeux, du système respiratoire et de la peau. De plus, les phrases de sécurité (S) 28 soulignent la nécessité de porter des vêtements de protection appropriés.
Les phrases R et S suivantes doivent également être appliquées pour un étiquetage de sécurité complet :
- R 22 : Nocif en cas d’ingestion
- R 26 : Très toxique par inhalation
- R 41/43 : Peut entraîner une sensibilisation par inhalation et par contact avec la peau
- S 36/37/39 : Porter des vêtements de protection appropriés, des gants et une protection des yeux/du visage
- S 45 : En cas d’accident ou de malaise, consulter immédiatement un médecin
Lorsque vous ajoutez de la poudre de chlorure cyanurique à des solvants inflammables, utilisez des entonnoirs reliés à la terre pour éviter les décharges électrostatiques. Seul le personnel qualifié et formé aux procédures de manipulation appropriées doit être autorisé à travailler avec du chlorure cyanurique.
Référence
- Cyanuric Acid and Cyanuric Chloride; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_191
