Anhídrido ftálico: Propiedades, Reacciones, Producción y Usos
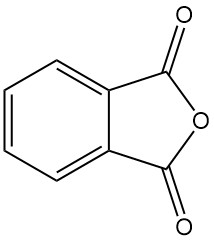
¿Qué es el anhídrido ftálico?
El anhídrido ftálico [85-44-9], también conocido como isobenzofuran-1,3-diona, es un compuesto orgánico con la fórmula C6H4(CO)2O. Es un sólido de incoloro a blanco, en forma de agujas con un olor suave y distintivo que se forma por la deshidratación de ácido ftálico.
El anhídrido ftálico fue el primer anhídrido de un ácido dicarboxílico que se utilizó comercialmente. Es un importante químico industrial utilizado para la producción a gran escala de plastificantes para plásticos.
A. Laurent descubrió por primera vez el anhídrido ftálico en 1836 y, desde 1872, lo produce BASF mediante el proceso de oxidación de naftaleno.
Tabla de contenido
1. Propiedades físicas del anhídrido ftálico
El anhídrido ftálico existe en forma de agujas o plaquetas incoloras con formas cristalinas monoclínicas o rómbicas. Las propiedades físicas del anhídrido ftálico se enumeran en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Número CAS | [85-44-9] |
| Fórmula química | C8H4O3 |
| Peso molecular | 148,12 g/mol |
| Densidad (sólido a 4 °C) | 1,527 g/cm3 |
| Densidad de vapor específica (1013 mbar) | 6,61 kg/m3 |
| Punto de fusión | 131,6 °C |
| Punto de ebullición (1013 mbar) | 295,1 °C |
| Calor de fusión | 159,1 J/g |
| Calor de combustión | 22.160,7 J/g |
| Calor de formación (naftaleno) | 12.058 J/g |
| Calor de formación (o-xileno) | 8.625 J/g |
| Calor de sublimación | 601 J/g |
| Calor de evaporación | 441,7 J/g |
| Punto de inflamación | 152°C |
| Temperatura de ignición | 580°C |
| Límites de inflamabilidad (1013 mbar) | Superior: 10,5 % en volumen Inferior: 1,7 % en volumen |
| Límite inferior de explosión de polvo | 25 g/m3 |
La densidad del anhídrido ftálico líquido entre 140 y 240 °C se puede determinar mediante la siguiente ecuación:
ρ/kg.m-3 = 1321.55-0.6697 (t/°C)-0.000905 (t/°C) 2
Los datos de solubilidad del anhídrido ftálico en varios disolventes se presentan en la Tabla 2.
Los datos comunicados sobre los riesgos de explosión del anhídrido ftálico en el aire muestran variaciones significativas. Pueden producirse explosiones en concentraciones inferiores a 100 g/m³, influenciadas por las impurezas presentes en la muestra. Incidentes industriales recientes sugieren que exceder los 35 g/m³ de anhídrido ftálico en el gas producto de la reacción puede provocar ignición al entrar en contacto con la sal de transferencia de calor debido a la rotura de los tubos del reactor.
| Disolvente | Temperatura (°C) | Solubilidad (g/100 g) |
|---|---|---|
| Agua | 20 | 1,64 |
| Agua | 50 | 1,74 |
| Agua | 100 | 19.0 |
| Disulfuro de carbono | 20 | 0,7 |
| Ácido fórmico | 20 | 4.7 |
| Piridina | 20 | 80 |
| Benceno | - | soluble |
| Etanol | 20 | soluble |
| Éter dietílico | 20 | ligeramente soluble |
2. Reacciones de anhídrido ftálico
El anhídrido ftálico muestra la reactividad del anhídrido cíclico y los compuestos aromáticos.
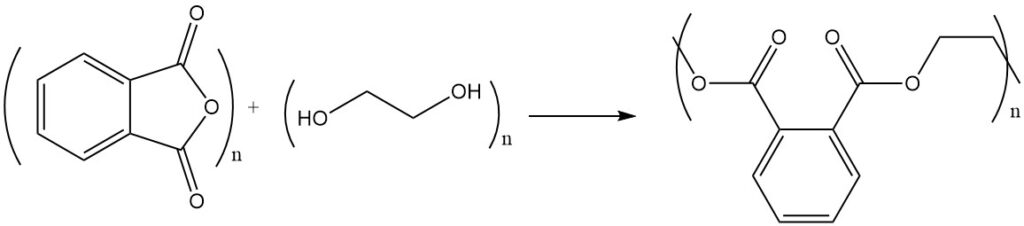
La reacción del anhídrido ftálico con alcoholes o dioles produce ésteres o poliésteres. Por ejemplo, el anhídrido ftálico reacciona con el etilenglicol para formar poliéster, un polímero con unidades éster repetidas.
Las resinas de poliéster insaturado se forman mediante policondensación con anhídrido maleico o ácido fumárico.
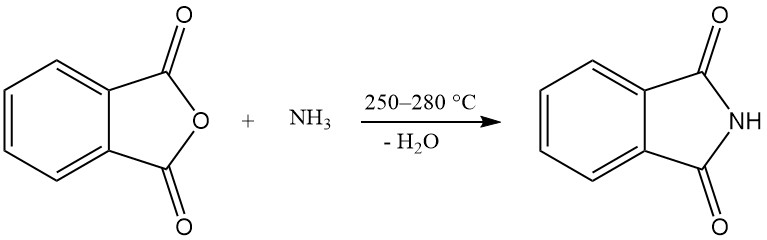
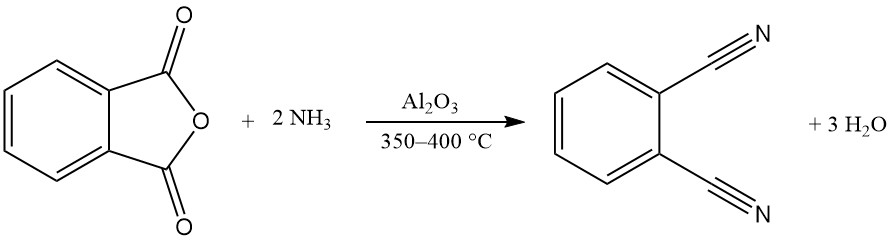
Uno o ambos grupos carboxi del anhídrido ftálico pueden reaccionar con el amoníaco para producir ftalimida o ftalonitrilo.
Los colorantes de ftaleína y rodamina, algunos con más de un siglo de historia de producción, se obtienen mediante la reacción de anhídrido ftálico con fenoles, aminofenoles o derivados de quinaldina. La fluoresceína se sintetiza a partir de anhídrido ftálico y resorcinol utilizando catalizadores ácidos.
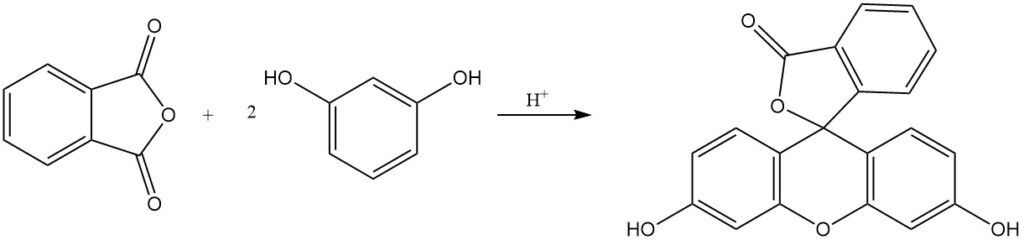
La reacción del anhídrido ftálico con fenol produce fenolftaleína en presencia de un catalizador ácido.
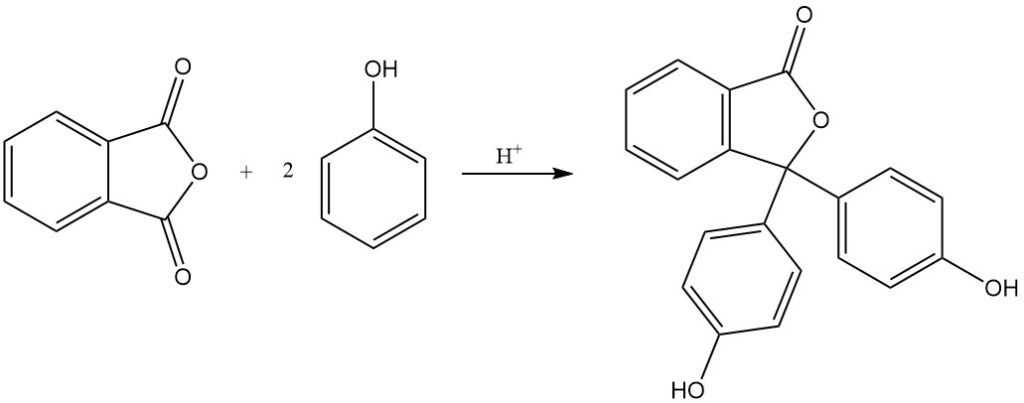
Cuando el anhídrido ftálico se hace reaccionar con 4-aminofenol, se produce N-(4-hidroxifenil)ftalimida.
La reacción de Friedel-Crafts del anhídrido ftálico con derivados del benceno, seguida del cierre del anillo, forma derivados de antraquinona, que se utilizan para fabricar tintes de antraquinona.
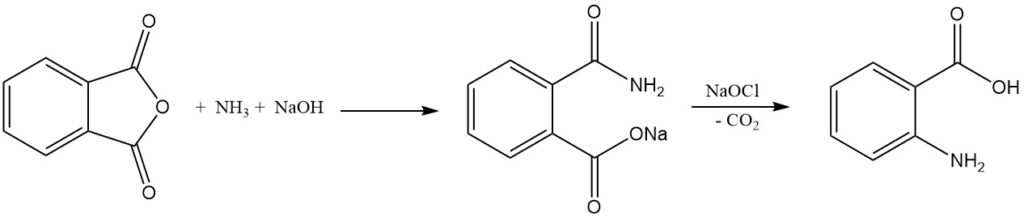
La síntesis industrial de ácido antranílico a partir de anhídrido ftálico implica dos pasos. Primero, el anhídrido ftálico reacciona con amoníaco en presencia de hidróxido de sodio para formar sal de ácido ftalámico, y luego la sal de sodio del ácido ftalámico sufre un reordenamiento de Hofmann y descarboxilación cuando se trata con hipoclorito para dar ácido antranílico.
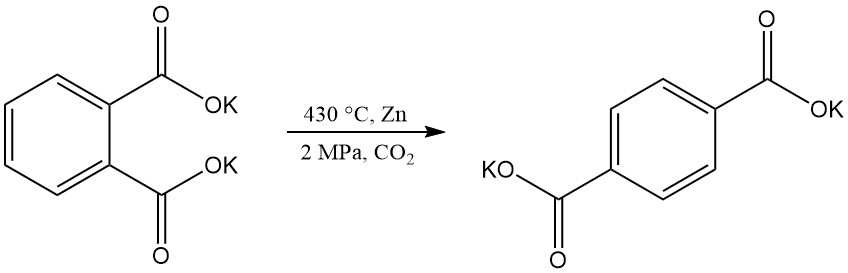
El ácido tereftálico se puede producir mediante la reordenación del ftalato dipotásico, pero los desafíos técnicos han hecho que este proceso quede obsoleto.
La hidrogenación electroquímica del anhídrido ftálico produce ácido 3,5-dihidroftálico, mientras que la hidrogenación con un catalizador de níquel produce ftaluro.
3. Producción de anhídrido ftálico
El anhídrido ftálico se produce predominantemente a escala industrial mediante la oxidación en fase gaseosa de o-xileno o naftaleno. También se puede preparar mediante oxidación en lecho fluidizado de naftaleno o mediante oxidación en fase líquida de o-xileno.
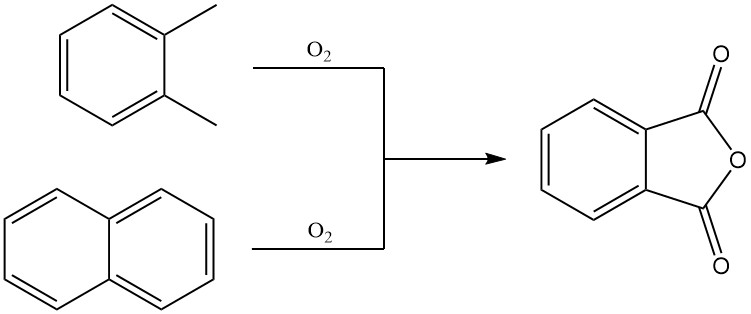
3.1. Producción de anhídrido ftálico mediante oxidación en fase gaseosa de o-xileno o naftaleno
El o-xileno precalentado se mezcla con aire caliente y se alimenta a un reactor tubular que contiene un catalizador altamente selectivo. La reacción de oxidación es exotérmica y el calor generado se utiliza para producir vapor, con el exceso de vapor disponible para uso externo.
Los gases efluentes del reactor se preenfrían. A altas concentraciones de anhídrido ftálico, algo de anhídrido ftálico líquido se puede recolectar directamente en un condensador y la corriente de gas producto restante ingresa a un sistema de condensador de conmutación.
Los tubos con aletas dentro de los condensadores interruptores se enfrían mediante aceite de transferencia de calor en un proceso cíclico. Durante el ciclo de enfriamiento, el anhídrido ftálico se condensa como sólido en los tubos y un ciclo de calentamiento posterior funde el anhídrido ftálico depositado, que luego se recoge en un tanque de almacenamiento.
Después de la separación del anhídrido ftálico, los gases de escape que contienen subproductos requieren limpieza mediante lavado con agua, incineración catalítica o incineración térmica.
El lavado con agua permite la concentración de ácido maleico (un subproducto) de la solución de lavado, que puede procesarse aún más para producir ácido fumárico o anhídrido maleico.
La combinación de depuración con producción de anhídrido maleico elimina el vertido de aguas residuales contaminadas.
El anhídrido ftálico crudo se transfiere a un sistema de tratamiento térmico/químico continuo que convierte cualquier subproducto del ácido ftálico nuevamente en anhídrido ftálico. Finalmente, el anhídrido ftálico bruto tratado se purifica mediante un sistema de destilación continuo de dos etapas.
3.1.1. Procesos Comerciales
El proceso BASF opera con una amplia gama de cargas de o-xileno (hasta 105 g/m³) y emplea un reactor de acabado para reducción de subproductos y mejora de la calidad.
Este proceso ofrece una operación flexible para un rendimiento optimizado, reducción de residuos y vida útil prolongada del catalizador y no requiere activación de SO2 ni un precondensador para la recolección de anhídrido ftálico crudo.
El anhídrido ftálico crudo producido contiene un bajo subproducto, lo que lo optimiza para un bajo consumo de energía y una alta exportación neta de energía.
El proceso Wacker acomoda o-xileno, naftaleno o sus mezclas. Utiliza cargas de o-xileno de 90 a 100 g/m³ (STP) y se centra en modificaciones del proceso para ahorrar energía.
El proceso Nippon Shokubai VGR se distingue por el reciclaje del gas de ventilación, lo que reduce la concentración de oxígeno a <10 % en volumen para un funcionamiento seguro con alta o -carga de xileno (hasta 85 g/m³ STP). Este proceso logra altos rendimientos atribuidos a un sistema catalizador especializado y también puede utilizar naftaleno como materia prima.
El proceso LAR de Alusuisse-Ftalital propone cargas de o-xileno de hasta 134 g/m³ (STP) para una posible reducción de energía y tamaño de los equipos . Comercialmente utiliza cargas de hasta 80 g/m³ (STP) y emplea catalizadores en forma de anillo o medio anillo capaces de procesar tanto o-xileno como naftaleno o sus mezclas.
El proceso Rhône-Poulenc utiliza o-xileno como materia prima y somete el producto crudo a un postratamiento químico antes de las dos etapas. destilación. Trata los gases residuales mediante incineración.
El proceso ELF Atochem/Nippon Shokubai aprovecha el catalizador Nippon Shokubai para procesar o-xileno o naftaleno y utiliza cargas de alimentación industriales de hasta 75 g/m³ (STP) para o-xileno.
3.1.2. Catalizador y mecanismo de reacción
Las plantas modernas utilizan predominantemente catalizadores en forma de anillo en reactores tubulares enfriados por sales fundidas para lograr eficiencia energética. También están disponibles soportes de media carcasa.
Los catalizadores típicos consisten en un soporte cerámico inerte (silicato, carburo de silicio, etc.) recubierto con una fina capa de óxidos de vanadio y titanio. Se pueden agregar antimonio, rubidio, cesio, niobio y fósforo para mejorar la selectividad hacia el anhídrido ftálico.
Son comunes los catalizadores de dos zonas que combinan zonas de baja y alta actividad; algunos procesos utilizan tres zonas para altas cargas de o-xileno, y ciertos catalizadores requieren activación con SO2 para prolongar su vida útil.
La vía de reacción exacta para la formación de anhídrido ftálico no se comprende completamente y depende de los métodos de medición y las configuraciones experimentales.
Generalmente se acepta un mecanismo redox que involucra átomos de oxígeno en la red del catalizador. Si bien el alcohol intermedio no se ha observado definitivamente, es probable que esté presente en la conversión de o-xileno en anhídrido ftálico.
La conversión industrial de o-xileno alcanza rendimientos que superan el 80% del máximo teórico (alrededor de 110-112 kg de PA por 100 kg de o-xileno). Sin embargo, los rendimientos de conversión de naftaleno suelen ser más bajos (alrededor del 85 % del máximo teórico, o 98 kg de PA por 100 kg de naftaleno), debido a subproductos adicionales como la naftoquinona.
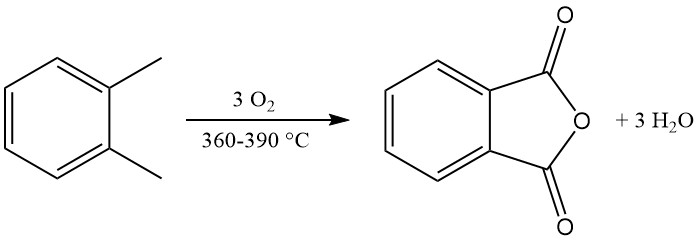
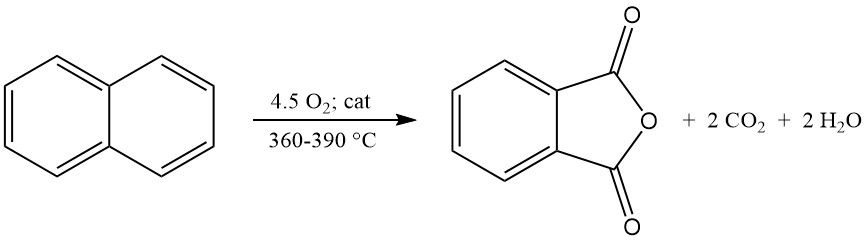
La reacción de oxidación exotérmica genera un calor significativo: 1300-1800 kJ/mol para o-xileno y 2100-2500 kJ/mol para naftaleno. Este calor suele aprovecharse para la producción de vapor.
Los principales subproductos de la oxidación de o-xileno incluyen ácido maleico y ftalida, y la oxidación de naftaleno produce además naftoquinona, que requiere más purificación.
3.1.3. Purificación de anhídrido ftálico
Para obtener anhídrido ftálico de alta pureza después de la etapa de reacción inicial, el producto crudo a menudo se somete a un tratamiento térmico antes de la destilación para eliminar las impurezas.
El tratamiento térmico simple (100–400 °C) es adecuado para productos con bajo contenido de impurezas elaborados a partir de o-xileno. El tratamiento tiene como objetivo eliminar el agua, los contaminantes de bajo punto de ebullición (anhídrido maleico, o-tolualdehído) y la ftalida.
El anhídrido ftálico producido por la oxidación de naftaleno necesita un tratamiento químico adicional debido a la presencia de naftoquinona como subproducto.
Se pueden utilizar varios productos químicos para la eliminación de naftoquinonas, incluido ácido sulfúrico, hidróxido de sodio, mezcla de ácido bórico/ácido sulfúrico, disulfuro de potasio, carbonato de sodio, maleato de potasio y polidienos alifáticos.
La destilación se utiliza como etapa final de purificación del anhídrido ftálico bruto.
El proceso de destilación (Figura 1) normalmente implica un sistema continuo con múltiples columnas.
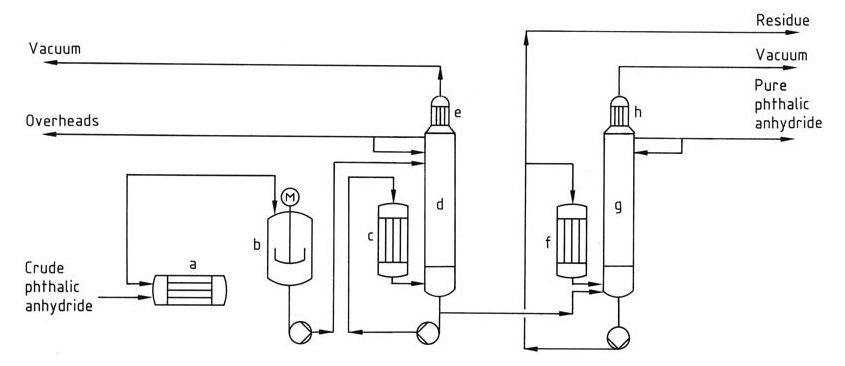
a) Calentador de anhídrido ftálico bruto; b) Predescomponedor; c) Caldero; d) columna extractora; e) Condensador; f) Caldero; g) columna de destilación; h) Condensador
Primero, el predescomponedor convierte el ácido ftálico residual en el producto crudo en anhídrido ftálico, y luego la primera columna concentra y elimina las impurezas de bajo punto de ebullición como el anhídrido maleico y el ácido benzoico de la cabeza. Finalmente, la segunda columna purifica el anhídrido ftálico destilándolo dejando atrás el residuo de alto punto de ebullición.
3.2. Producción de anhídrido ftálico mediante oxidación de naftaleno en lecho fluidizado
El anhídrido ftálico se puede producir mediante oxidación de naftaleno en lecho fluidizado. Un ejemplo es el proceso Badger, que todavía se utiliza, y las plantas que emplean este proceso pueden aumentar su capacidad de producción inyectando oxígeno y aire, lo que permite una mayor concentración de naftaleno.
La naftaleno líquido se inyecta y vaporiza directamente en el fondo del lecho para asegurar una distribución uniforme por todo el catalizador y el oxígeno atmosférico se alimenta a través de una placa distribuidora para facilitar la reacción.
La mezcla vigorosa dentro del lecho fluidizado mantiene una temperatura uniforme (345–385 °C) y el calor generado por la reacción se utiliza para la producción de vapor a alta presión a través de tubos de enfriamiento.
Se utilizan ciclones y filtros cerámicos para separar y reciclar el catalizador, que puede regenerarse mediante SO2.
Hasta el 60% del anhídrido ftálico se recupera como condensado líquido, el resto se obtiene por desublimación en condensadores de conmutación y finalmente se destila al vacío para producir un producto puro.
3.3. Producción de anhídrido ftálico mediante oxidación en fase líquida de o-xileno
El anhídrido ftálico se puede producir mediante oxidación en fase líquida de o-xileno. En este proceso se utiliza una mezcla de ácido acético, o-xileno (>99% de contenido de isómero orto requerido para un alto rendimiento) y Se alimenta un catalizador a base de cobalto, manganeso y bromo a un sistema de reactor en cascada.
La reacción comienza bajo presión con inyección de aire y avanza a través de vasos posteriores. El agua generada como subproducto se elimina en el primer recipiente mediante destilación azeotrópica con o-xileno.
Se separan los isómeros del ácido ftálico y se obtiene anhídrido ftálico por cristalización. Debido a la presencia de bromo en el catalizador, el producto crudo requiere un pretratamiento especial antes de la purificación final por destilación.
El Proceso Sisas es un proceso de dos pasos que implica la oxidación en fase líquida de o-xileno a ácido o-toluico crudo y el o-xileno sin reaccionar se recicla. Luego, el ácido o-toluico separado se oxida en fase gaseosa para producir anhídrido ftálico.
El rendimiento molar global de anhídrido ftálico basado en o-xileno puede alcanzar hasta el 88%.
El proceso de oxidación en fase líquida es una alternativa a los métodos tradicionales, pero no ha logrado una adopción industrial generalizada en comparación con la oxidación catalítica de lecho fijo.
4. Usos del anhídrido ftálico
La aplicación más importante del anhídrido ftálico es la producción de plastificantes. Los principales usos del anhídrido ftálico son la producción de plastificantes (55 %), resinas de poliéster insaturado (14 %), resinas alquídicas (15 %) y otros productos químicos como colorantes y pigmentos, detergentes, herbicidas e insecticidas, retardantes de fuego, sacarina. y agentes reticulantes de resina de poliéster.
Se utiliza ampliamente en todo el mundo para una gama extremadamente amplia de aplicaciones, que van desde la industria del plástico hasta la síntesis de resinas, fungicidas agrícolas y aminas.
5. Toxicología del anhídrido ftálico
El anhídrido ftálico presenta una toxicidad aguda baja, pero puede inducir irritación respiratoria y sensibilización al inhalarlo. Los estudios de exposición crónica no sugieren ningún potencial carcinogénico y los datos limitados sobre toxicidad reproductiva requieren más investigación.
Toxicidad aguda
El anhídrido ftálico presenta una toxicidad aguda baja según los valores de LD50:
- Oral (rata): 1500–4000 mg/kg
- Inhalación (rata): >210 mg/m³ h (polvo)
- Dérmica (conejo): >10000 mg/kg
El contacto de la piel con anhídrido ftálico puede causar una ligera irritación, mientras que el contacto con los ojos es irritante. También puede inducir sensibilización dérmica.
Toxicidad subaguda
La exposición dietética en ratas (hasta 3800 ppm) durante 28 días no mostró efectos significativos.
Los estudios de alimentación forzada en ratas revelaron toxicidad en la mucosa renal y gástrica a dosis superiores a 1200 mg/kg/día.
Los estudios de inhalación demostraron irritación respiratoria en varios animales en altas concentraciones (10000 mg/m³).
La exposición repetida por inhalación (8,5 mg/m³) provocó irritación del tracto respiratorio y neumonías frecuentes en ratas.
Genotoxicidad
No se observaron efectos mutagénicos o cromosómicos en pruebas in vitro con y sin activación metabólica.
Toxicidad crónica y carcinogenicidad
Los estudios dietéticos a largo plazo en ratas y ratones con dosis altas (hasta 3600 mg/kg/día) no mostraron una mayor formación de tumores en comparación con los controles.
Toxicidad reproductiva
Los estudios limitados que involucran inyección intraperitoneal en ratones sugieren riesgos potenciales de malformación en dosis altas (≥55,5 mg/kg/día) durante la gestación. Sin embargo, la ruta de exposición y la cepa animal limitan la conclusión de estos hallazgos.
Referencias
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- Phthalic anhydride (PA): a valuable substrate in organic transformations. – https://pubs.rsc.org/en/content/articlehtml/2023/ra/d3ra03378c
- Process for the production of phthalic anhydride. – https://patents.google.com/patent/US4435580A/en
