2-Cloroetanol

El 2-cloroetanol, también conocido como etilenclorhidrina, es un compuesto químico orgánico con la fórmula HOCH2CH2Cl. Es un líquido incoloro y de olor agradable que era un importante intermediario utilizado en el pasado para producir óxido de etileno, pero que ya no es así.
Tabla de contenido
1. Propiedades físicas del 2-cloroetanol
Las soluciones diluidas de 2-cloroetanol en agua tienen un olor algo dulce y agradable. Es un líquido inflamable que puede formar un azeótropo con agua que hierve a 97,8 con 42% de H2O en peso. La etileno clorhidrina es miscible con agua, etanol, acetona y benceno.
Las propiedades físicas generales del 2-cloroetanol se enumeran en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Número de registro CAS | [107-07-3] |
| Peso molecular | 80,52 g/mol |
| Punto de fusión (pf) | -69 °C |
| Punto de ebullición (pb) | 129°C |
| Densidad a 20 °C | 1,2133 g/mL |
| Índice de refracción | 1,44 |
| Viscosidad (η) | 3,43 mPa.s |
| Presión de vapor | 700 Pa (a 20 °C) |
| Punto de inflamación | 57 °C |
| Temperatura de autoignición | 425°C |
| Límite explosivo | 5–16% |
2. Reacciones químicas del 2-cloroetanol
El 2-cloroetanol sufre reacciones que son características tanto de los alcoholes como de los cloruros de alquilo. La reacción más común del 2-cloroetanol es la deshidrocloración para formar óxido de etileno, que se usó industrialmente pero se volvió menos importante debido a métodos alternativos.
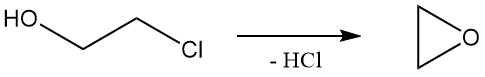
La tasa relativa de solvólisis de etileno clorhidrina en agua a 97 °C es 1,0.
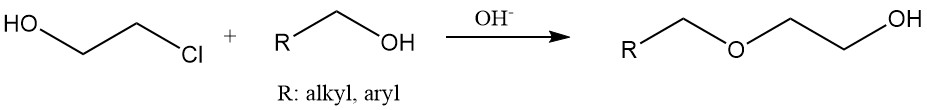
Los éteres hidroxietílicos se producen haciendo reaccionar 2-cloroetanol con alcoholes o fenoles en condiciones básicas. La hidroxietilcelulosa y el almidón modificado se fabrican tratando estos materiales con etileno clorhidrina.
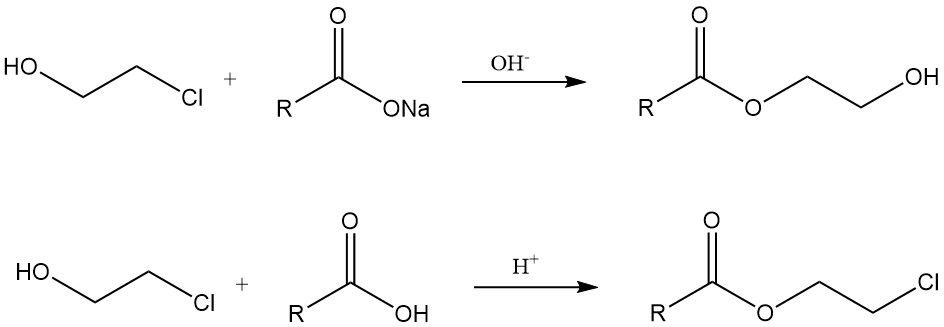
Las clorhidrinas reaccionan con carboxilatos metálicos en presencia de una base para dar ésteres de hidroxietilo. Por otro lado, los β-cloroésteres se forman mediante reacciones con ácidos carboxílicos en condiciones ácidas o a partir de cloruros ácidos.
El carbonato cíclico puede producirse mediante la reacción de 2-cloroetanol con dióxido de carbono en presencia de una amina.
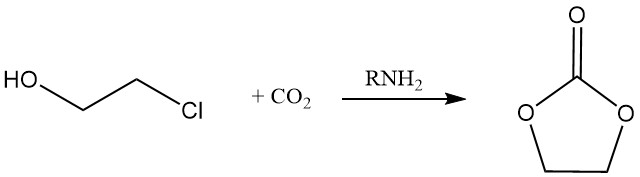
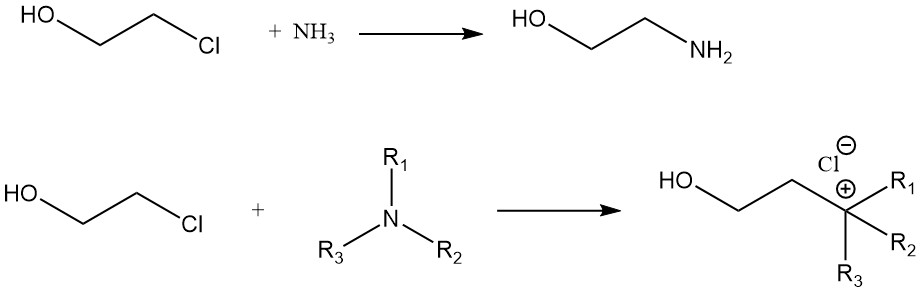
Una comparación de la velocidad de reacción de la etilenclorhidrina con varias aminas da el siguiente orden: n-amilamina > ciclohexilamina > anilina. La reacción de etilenclorhidrina con amoníaco da monoetanolamina. Los compuestos de amonio cuaternario se forman a partir de etilenclorhidrina y aminas terciarias.
Otras reacciones del 2-cloroetanol incluyen la formación de nitrilos a partir de cianuros, acetales a partir de aldehídos, oxazolidinonas a partir de cianatos y la oxidación de etilenclorhidrina a ácido monocloroacético.
La reacción del 2-cloroetanol con fosgeno forma cloroformiato de 2-cloroetilo.
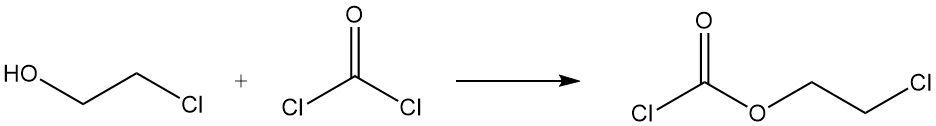
3. Producción de 2-cloroetanol
Ya en 1904, BASF produjo 2-cloroetanol haciendo reaccionar etileno y CO2 en una solución acuosa de polvo blanqueador.
Hoy en día, el 2-cloroetanol se produce mediante la hipocloración de etileno con ácido hipocloroso, que se forma mediante la reacción reversible del cloro y el agua, lo que resulta en una eficiencia limitada.
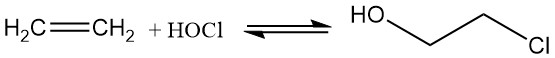
Cl2 + H2O ⇌ HOCl + HCl ; K = 4.2 x 10-4
La reacción entre etileno y ácido hipocloroso es más rápida que la reacción de etileno y cloro para formar dicloroetano, por lo que cuando se agrega etileno al sistema acuoso, se produce clorhidrina preferentemente.
Se forma una cantidad mínima de dicloroetano con buena agitación en la fase gaseosa si la concentración de 2-cloroetanol no supera el 6-8%. Sin embargo, el aumento de la concentración de HCl reduce el HOCl disponible, lo que lleva a una formación significativa de dicloroetano después de que el HCl es superior al 3%.
Debido a la baja solubilidad en agua del dicloroetano (0,869 g/100 ml a 20 °C), forma una fase separada, disolviendo tanto el cloro como el etileno para una mayor formación de dicloroetano.
Estudios de Laboratorio y Optimización de Reactores
Un estudio de laboratorio investigó los parámetros de hipocloración utilizando configuraciones de una sola columna y de reactor de reciclaje. Los resultados muestran que se prefirieron temperaturas de 35 a 50 °C y un exceso de etileno del 50 % para una extracción eficiente de dicloroetano.
Se logró un rendimiento del 88 % de 2-cloroetanol utilizando una operación continua a una concentración de 6,4 % de etileno clorhidrina, una temperatura de 35 °C, una proporción de etileno:cloro de 1,42 y una alimentación de cloro de 71 g/h.
La producción de 2-cloroetanol para óxido de etileno ha sido reemplazada por oxidación directa de etileno con catalizadores de plata. Sin embargo, el óxido de propileno y la epiclorhidrina todavía se producen mediante oxidación directa de la olefina original.
En la producción a escala industrial de etileno clorhidrina, cloro, etileno y agua se introdujeron conjuntamente hacia arriba a través de torres empaquetadas. Estos reactores minimizan el contacto etileno-cloro y maximizan el contacto hidrocarburo-fase líquida.
Las líneas de alimentación están ubicadas estratégicamente para garantizar la disolución completa del cloro antes de la introducción del etileno. Algunas plantas utilizan columnas de mezcla separadas para cloro y agua antes de la torre de reacción de etileno.
La corriente de producto resultante contiene una solución de 2-cloroetanol al 4,5-5,0% con rendimientos que alcanzan el 85-89% de etileno convertido. El dicloroetano y el éter bis(2-cloroetílico) son subproductos menores.
4. Usos del 2-cloroetanol
El 2-cloroetanol se utilizó principalmente para la síntesis de óxido de etileno, pero todavía encuentra diversas aplicaciones en diversas industrias.
El 2-cloroetanol se utiliza como catalizador para el metabolismo de las olefinas y la polimerización de cicloalquenización-apertura en forma de aductos con haluros de tungsteno o molibdeno y compuestos orgánicos de aluminio.
Se utiliza en la producción de tintes, productos farmacéuticos, biocidas, plastificantes y tiodiglicol.
Se utiliza como materia prima en la producción de celulosa modificada (hidroxietilcelulosa) y estría, y para disolver diversos materiales, incluido acetato de celulosa y etilcelulosa utilizados en recubrimientos y películas.
Encuentra aplicación en la impresión textil para disolver tintes y en procesos como desparafinado de aceites, refinación de colofonia, extracción de lignina de pino e incluso limpieza de maquinaria.
5. Toxicología del 2-cloroetanol
La etilenoclorhidrina plantea importantes riesgos para la salud. La manipulación segura requiere protección cutánea, ocular y respiratoria debido a su alta toxicidad dérmica y toxicidad oral y por inhalación moderada.
El 2-cloroetanol se puede absorber a través de la piel, la inhalación y la ingestión. Las exposiciones agudas pueden ser fatales por contacto con la piel o por inhalación. Los síntomas incluyen daño ocular, dificultad respiratoria, dificultad gastrointestinal y daño a órganos.
Datos de toxicidad:
- Oral: moderadamente tóxico, con valores de LD50 de entre 60 y 95 mg/kg en ratas.
- Piel: puede absorberse a través de la piel y alcanzar niveles potencialmente dañinos. La irritación local es mínima.
- Ojo: el contacto puede causar daños graves o incluso ceguera. El lavado inmediato es crucial.
- La inhalación es mortal en concentraciones de vapor saturado. La CL50 estimada está entre 16 y 62 ppm.
- No hay evidencia de efectos reproductivos o de desarrollo en estudios con animales.
- Mutagenicidad: Los resultados positivos y negativos en varias pruebas sugieren la posibilidad de mutaciones por sustitución de pares de bases.
- Carcinogenicidad: No hay evidencia de carcinogenicidad en estudios con animales. Los datos humanos no son concluyentes.
El 2-cloroetanol está clasificado como inflamable, extremadamente tóxico por diversas vías y causa daños oculares graves. Los límites de exposición ocupacional varían según la agencia y oscilan entre 1 y 5 ppm.
Referencia
- Chlorohydrins; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_565.pub2
