Herstellung aromatischer Amine
Aromatische Amine werden durch drei Arten von Reaktionen hergestellt:
- Reduktionen: Verwendung metallischer Elemente wie Eisen (Fe), Zink (Zn), Zinn (Sn), Aluminium (Al) oder der entsprechenden Salze; schwefelhaltige Verbindungen; elektrochemische Verfahren; und katalytische Hydrierung.
- Nukleophile Substitutionen: Dabei handelt es sich um den Austausch von Substituenten wie Halogen-, Hydroxyl-, Alkoxy- und Sulfongruppen.
- Umlagerungen und Abbauvorgänge: einschließlich Umwandlungen wie die Benzidin– und Beckmann-Umlagerung sowie die Schmidt- und Hofmann-Abbauvorgänge.
Es ist zu beachten, dass die ersten beiden Reaktionstypen wichtiger sind. Chemische Umlagerungen und Abbauvorgänge führen selten zu reinen Reaktionsprodukten mit hohen Ausbeuten.
Inhaltsverzeichnis
1. Herstellung aromatischer Amine durch Reduktion von Nitroverbindungen
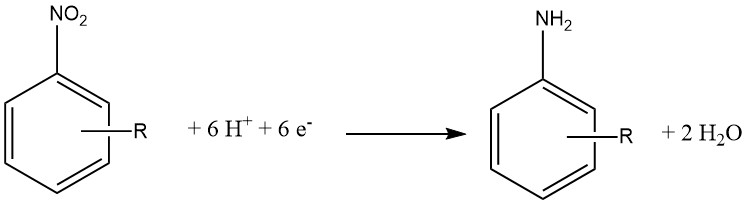
Aromatische Amine werden durch Reduktion aromatischer Kohlenstoff-Stickstoff-Verbindungen mit Stickstoffoxidationsstufen im Bereich von +3 bis +2 hergestellt. Bemerkenswert ist, dass die Reduktion von Nitroverbindungen im industriellen Maßstab aufgrund der präzisen Herstellung von Ausgangsmaterialien, die für eine Vielzahl von Verbindungen erreicht werden kann, weit verbreitet ist.
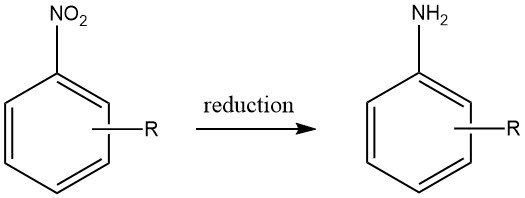
Allerdings ist die wirtschaftliche Machbarkeit der Herstellung anderer aromatischer Stickstoffverbindungen als brauchbare Ausgangsmaterialien für aromatische Amine begrenzt, wodurch deren praktischer Nutzen eingeschränkt wird.
1.1. Chemische Reduktion
Während des chemischen Reduktionsprozesses, der aromatische Nitroverbindungen in aromatische Amine umwandelt, stammt das Wasserstoffatom, das an das Stickstoffatom gebunden wird, typischerweise aus dem Lösungsmittel, häufig Wasser, oder wird durch die Verwendung zugesetzter Säure eingeführt.
Unter den zentralen Reduktionsmitteln stehen verschiedene Metalle wie Eisen, Zinn und Zink im Vordergrund, daneben kommen auch Phosphor, Sulfide, Sulfite und Schwefeldioxid zum Einsatz.
Es ist zu beachten, dass die mögliche Oxidation des Reduktionsmittels, die zur Bildung eines potenziell unbrauchbaren Abfallprodukts führt, sorgfältige umweltgerechte Entsorgungsmaßnahmen erfordert.
Dadurch hat die Bedeutung der chemischen Reduktion im Vergleich zur katalytischen Reduktion, insbesondere bei der großtechnischen Synthese verschiedener Produkte, abgenommen.
1.1.1. Reduktion mit Eisen
Der Prozess der Reduktion von Verbindungen mit Eisen, auch BÉCHAMP-Reduktion genannt, wurde erstmals 1854 aufgeklärt und wird häufig unter verdünnten sauren Bedingungen durchgeführt. Eisen behält seine herausragende Rolle als primärer Metallkatalysator für die Umwandlung von Nitroverbindungen in die entsprechenden aromatischen Amine.
Nahezu alle Nitroverbindungen können mit Eisen in Wasser und saurem Milieu erfolgreich zu aromatischen Aminen reduziert werden. Insbesondere ist mit der Entstehung unerwünschter Nebenprodukte vor allem dann zu rechnen, wenn das Molekül andere reduktionsempfindliche Substituenten wie Nitroso, Azo, Hydrazin, Sulfoxid oder zusätzliche Nitrogruppen enthält oder wenn es einer Verseifung unterliegen kann.
Kohlenstoff-Kohlenstoff-Mehrfachbindungen bleiben gegenüber Angriffen inert. Bemerkenswert ist, dass sowohl Bayer (Deutschland) als auch Mobay (USA) den eisenvermittelten Reduktionsansatz zur Erzeugung von Eisenoxiden anwenden, wobei Anilin als Nebenprodukt entsteht.

Ein weiterer Fall von industrieller Bedeutung ist der ausschließliche Einsatz von Eisen in neutralem Milieu zur Reduktion von 4,4′-Dinitro-2,2′-stilbendisulfonsäure zu 4,4′-Diamino-2,2′-stilbendisulfonsäure. Außerdem werden zahlreiche Farbstoffzwischenprodukte mit begrenztem Volumen durch die eisenvermittelte Methode reduziert.
1.1.2. Reduktion mit anderen Metallen
Aromatische Nitrogruppen werden durch den Einsatz von Zink, Zinn und Aluminium oder deren entsprechenden Salzen in saurem, neutralem oder alkalischem Medium reduziert.
Diese Reduktionsmittel sind mild und beeinträchtigen daher keine funktionellen Gruppen wie -OH, -OR, -COOH, -CO-Ar, Halogen oder -CN. Während sie in Laborkontexten Anwendung finden, mangelt es ihrer praktischen Nutzung an wesentlicher industrieller Bedeutung.
Dies ist in erster Linie auf den vorherrschenden Einsatz der katalytischen Hydrierung zurückzuführen, die im Einklang mit den gesetzlichen Richtlinien zur Abwasserbewirtschaftung und -entsorgung steht.
1.1.3. Reduktionen mit Sulfid, Hydrogensulfit und Schwefeldioxid
Verbindungen mit mehreren Nitrogruppen können reduziert werden, wodurch Nitroamine entstehen, indem eine äquimolare Menge Sulfidreagens verwendet wird. Bevorzugt sind Natrium- oder Ammoniumsulfid. Durch die Reduktion von 1,3-Dinitrobenzol mit Natriumsulfid wird eine Ausbeute von 87 % m-Nitroanilin erreicht.
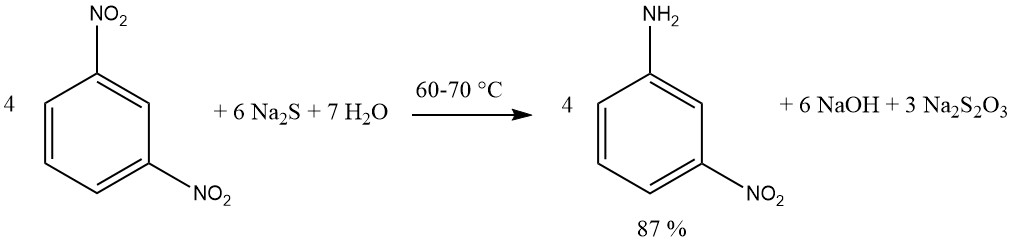
Durch die Zugabe von elementarem Schwefel verringert sich die erforderliche Menge an Natriumsulfid. Beispielsweise wird 4-Nitrotoluol mit hoher Effizienz unter Verwendung von Natriumsulfid und Schwefel zu 4-Aminobenzaldehyd reduziert.
Azogruppen bleiben unverändert, wenn die Reduktion mit Natriumsulfid im Temperaturbereich von 40–70 °C, bei kurzen Reaktionszeiten und ohne Sulfidüberschuss erfolgt.
Allerdings werden Halogensubstituenten leicht durch -SH-Gruppen ersetzt. In Fällen, in denen ein Überschuss an Reduktionsmittel kein Problem darstellt, kann Ammoniumhydrogensulfid in Gegenwart von Ammoniak verwendet werden.
Die Reduktion aromatischer Nitro-, Nitroso- oder Azoverbindungen zu ihren entsprechenden aromatischen Aminen unter Verwendung von Sulfit oder Hydrogensulfit wird als Piria-Reaktion bezeichnet (PIRIA, 1851).
Unter wässrigen oder alkoholischen Bedingungen entstehen überwiegend N- und C-Sulfonsäuren. Durch die Behandlung mit Mineralsäure entsteht ein Gemisch aus aromatischen Aminen und Aminobenzolsulfonsäuren.
Das Vorhandensein eines Chinonoxim-Zwischenprodukts erleichtert die Einführung von Hydrogensulfit in den aromatischen Ring während der Reduktion von ortho- und para-Nitrosophenolen oder Naphtholen.
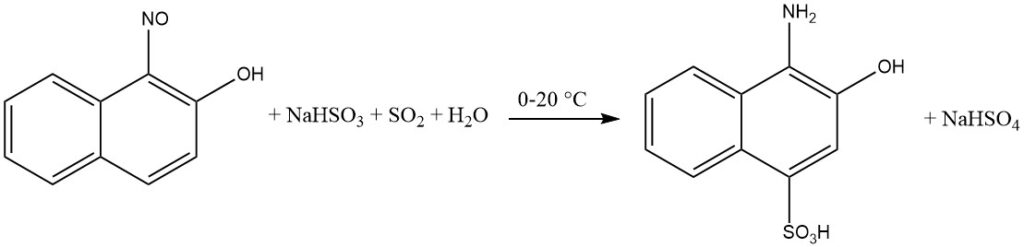
Insbesondere wenn sich die Hydroxylgruppe in der para-Position befindet, wird die Sulfogruppe in der 2-Position eingebaut. An der 3-Position befindliche Substituenten wie Cl oder COOH werden durch Wasserstoff ersetzt.
Der industrielle Einsatz der Reduktion mit Schwefeldioxid (SO2) wurde erst dann relevant, wenn die C-Sulfonierungsnebenreaktion reduziert wurde.
Dieses Verfahren wird optimalerweise in einem geschlossenen System unter Verwendung stark saurer Bedingungen (z. B. 15 – 40 %ige wässrige Schwefelsäure) und Temperaturen im Bereich von 80 – 180 °C durchgeführt. Katalysatoren wie Jod, Jodwasserstoff oder Jodsalze sind integraler Bestandteil, und Reaktoren aus glasbeschichteten Materialien sind optimal.
Natriumdithionit führt zu einer nahezu quantitativen Reduktion der aromatischen Nitro- und Nitrosogruppen.
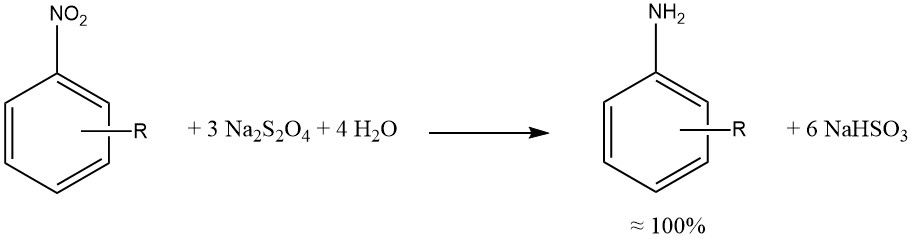
Wenn möglich, wurden Reduktionen durch Sulfid, Sulfit und andere Schwefelverbindungen durch katalytische Hydrierungen ersetzt, was zu saubereren Reaktionsmischungen, geringerer Korrosion (im Zusammenhang mit der SO2-Verwendung) und weniger Umweltbedenken führt.
1.1.4. Elektrochemische Reduktion von Nitroverbindungen
Die elektrochemische Reduktion wird typischerweise als eine spezielle Variante der chemischen Reduktion angesehen. Bei diesem Ansatz dient eine anorganische Verbindung als Reduktionsmittel, die oxidierte Form wird anschließend an der Kathode reduziert und kann so erneut reagieren.
Das Kathodenmaterial kann aus Pb, Sn, Ni oder Cu bestehen und auf der Kathodenseite einer semipermeablen Membran wird 15 – 20 %ige Salzsäure verwendet. Auf der Anodenseite wird 30 %ige Schwefelsäure eingesetzt.
Obwohl elektrochemische Reduktionen seit über einem Jahrhundert bekannt sind, wurden sie bis vor Kurzem nicht in großem Umfang kommerziell genutzt. Allerdings wächst das Interesse an dieser Methode, da die Fortschritte in der Zelltechnologie und bei Membranen immer besser werden.
Einige Produkte wurden erfolgreich durch elektrochemische Reduktion hergestellt, insbesondere in Indien, wie z. B. p-Aminobenzoesäure, p-Aminophenol und mehrere andere, die den Maßstab einer Pilotanlage oder darüber hinaus erreicht haben.
1.2. Katalytische Hydrierung von Nitroverbindungen
1.2.1. Reduktion mit Hydrazin
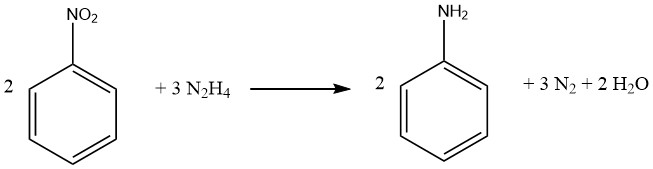
Der Reduktionsprozess aromatischer Nitroverbindungen mit Hydrazin ist eine spezielle Form der katalytischen Hydrierung, bei der Hydrazin als Wasserstoffquelle dient.
Der Zersetzungsmechanismus von Hydrazin an Edelmetallkatalysatoren variiert je nach pH-Wert, was bei höheren pH-Werten zu einer erhöhten Wasserstoffausbeute pro Mol Hydrazin führt.
Unter schwach alkalischen oder neutralen Bedingungen entsteht 1 Mol H2.
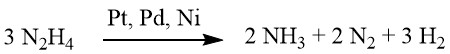
Bei Zugabe von Bariumhydroxid oder Calciumcarbonat steigt diese Ausbeute jedoch auf 2 Mol H2.
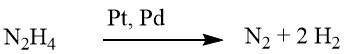
Während die Reduktion mit Hydrazin manchmal ohne Katalysator ablaufen kann, wird sie typischerweise in Gegenwart eines Hydrierungskatalysators wie Raney-Nickel, Palladium auf Kohle oder Palladium auf Calciumcarbonat durchgeführt.
Idealerweise liefert 1 Mol Hydrazin vier Reduktionsäquivalente, abhängig vom pH-Wert und dem Katalysator, obwohl praktisch weniger Äquivalente erzeugt werden, was einen Überschuss an Hydrazin erfordert. Wichtig ist, dass Kohlenstoff-Kohlenstoff-Doppelbindungen und Carbonylgruppen unverändert bleiben. Die Isolierung von Zwischenprodukten während des Reduktionsprozesses hängt von den Reaktionsbedingungen ab.
Bei der nichtkatalytischen Reduktion mit Hydrazin werden Carbonylgruppen enthaltende Verbindungen über die Bildung von Hydrazon-Zwischenprodukten zu ihren entsprechenden Hydroxyverbindungen reduziert.
Die Reduktion aromatischer Nitroverbindungen mit Hydrazin bietet im Vergleich zur katalytischen Reduktion mit Wasserstoff nur begrenzte Vorteile. Es findet seinen Einsatz vor allem in Laborexperimenten und bei kleinen Produktmengen, bei denen normale Druckbedingungen angewendet werden können.
Im Labormaßstab wurde Cyclohexen auch als Wasserstoffquelle für die katalytische Hydrierung von Polynitroverbindungen untersucht.
1.2.2. Reduktion von Nitrogruppen mit Wasserstoff
Die Erzeugung primärer aromatischer Mono- oder Polyamine erfordert im Allgemeinen eine katalytische Hydrierung der entsprechenden Nitroverbindung, die entweder in der Dampfphase oder in der Flüssigphase durchgeführt wird, und kann mit oder ohne Anwesenheit eines Lösungsmittels durchgeführt werden. Zahlreiche bekannte Produkte, darunter Anilin, o- und p-Toluidin, 2,4- und 2,6-Diaminotoluol und 1-Naphthylamin, werden mit dieser Methode hergestellt.
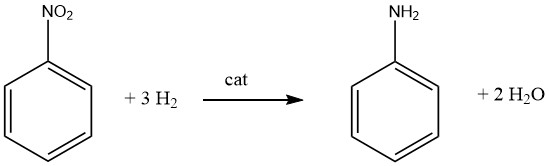
Es ist wichtig zu erkennen, dass die katalytische Reduktion von Nitroverbindungen exotherm ist. Bei der Flüssigphasenhydrierung von Nitrobenzol werden 553,5 kJ/mol Energie freigesetzt, während bei der Dampfphasenhydrierung bei 200 °C 493,2 kJ/mol freigesetzt werden.
Bei unzureichender Ableitung kann diese Wärme zu potenziell gefährlichen Explosionen führen, insbesondere wenn es zu einer thermischen Zersetzung der Nitroverbindung kommt oder Kondensationsreaktionen wie bei Chlornitroverbindungen ausgelöst werden.
Um diese Risiken zu mindern, werden die Konzentration der Nitroverbindung, die Menge und der Partialdruck des Wasserstoffs, die Temperatur und die Aktivität des Katalysators sorgfältig reguliert.
Dampfphasenhydrierung
Die industrielle Anwendung der Dampfphasenhydrierung wird durch den Siedepunkt und die thermische Stabilität von Nitroverbindungen eingeschränkt.
In den Vereinigten Staaten wird ein erheblicher Teil des Anilins durch Dampfphasenhydrierung von Nitrobenzol unter Verwendung eines Kupfer-Siliciumdioxid-Katalysators hergestellt, was eine beeindruckende Umwandlungsrate von 99 % ergibt. Bayer setzt zu diesem Zweck in Europa und Brasilien Pd-Aluminiumoxid ein.
Flüssigphasenhydrierung
Im Allgemeinen wird die Flüssigphasenhydrierung der meisten aromatischen Nitroverbindungen bevorzugt. In diesem Szenario können Druck und Temperatur unabhängig voneinander manipuliert werden. Es ist wichtig zu beachten, dass Temperaturen über 170–200 °C Hydrierungsreaktionen fördern können, an denen der aromatische Ring beteiligt ist.
Daher wird der Reduktionsprozess typischerweise im Bereich von 100–170 °C durchgeführt. Bestimmte Verbindungen wie 1-Brom-4-nitrobenzol erfordern noch niedrigere Temperaturen (20–70 °C), um eine empfindliche Gruppenspaltung zu verhindern.
Industriell werden Drücke im Bereich von 1–15 MPa (10–150 bar) eingesetzt. Für die Hydrierung von Nitroaromaten mit erhöhter Empfindlichkeit werden niedrigere Drücke (0,1–5 MPa, 1–50 bar) empfohlen.
Der Druck beeinflusst vor allem die Reaktionsgeschwindigkeit, indem er den Phasentransfer und die Sättigung des Katalysators mit Wasserstoff beeinflusst. Die Reaktionszeit hängt von verschiedenen Parametern ab, darunter Wasserstoffdruck, Konzentration, Temperatur, Katalysatoraktivität und -konzentration sowie Mischung.
Häufig wird eine anfängliche Induktionsperiode beobachtet, die von der Katalysatoraktivität unbeeinflusst bleibt. Die Reaktionszeiten liegen typischerweise zwischen einigen Minuten und mehreren Stunden. Längere Zeiträume sind erforderlich, wenn diese Parameter nicht entsprechend optimiert werden.
Aufgrund der inhärent exothermen Natur der Reaktion müssen insbesondere bei der industriellen Hydrierung aromatischer Polynitroverbindungen in Abwesenheit von Lösungsmitteln strenge Sicherheitsvorkehrungen eingehalten werden.
Die exotherme Natur wird durch die kontinuierliche Zugabe kleiner Mengen der Nitroverbindung gesteuert, wobei deren Konzentration unter 2 % gehalten wird. Zur Aufnahme der Reaktionswärme durch kontinuierliche Verdampfung kann deionisiertes Wasser zugeführt werden.
Dadurch werden nicht nur hitzebedingte Probleme gemindert, sondern auch die Katalysatoraktivität beeinträchtigt. Ein höherer Wassergehalt bei der diskontinuierlichen Hydrierung von Dinitrotoluol ohne Lösungsmittel führt zu einer verringerten Aktivität des Pd-auf-Kohlenstoff-Katalysators.
Wenn das Amin in Wasser löslich ist, kann es als Lösungsmittel verwendet werden. Dieser Ansatz eignet sich auch, wenn die Nitroverbindung mit Alkali wasserlösliche Salze bildet, wie dies bei Nitrocarbon- oder Sulfonsäuren der Fall ist.
In bestimmten Fällen können Lösungen des Amins in Wasser (30–40 %) direkt im Hydrierungsreaktor erzeugt werden, sodass keine zusätzlichen Konzentrationsschritte erforderlich sind.
Typischerweise werden Lösungsmittel wie Methanol und 2-Propanol bevorzugt. Dioxan, Tetrahydrofuran und N-Methylpyrrolidon wurden ebenfalls verwendet. Beispielsweise erzielt o-Nitrophenol unter Verwendung von Pt auf Kohlenstoff gute Hydrierungsausbeuten in Methanol.
Bei Verwendung eines mit Wasser nicht mischbaren Lösungsmittels wie Toluol muss der Wassergehalt minimiert werden, um die Katalysatoraktivität zu erhalten, ähnlich wie bei der lösungsmittelfreien Hydrierung. In einigen Fällen werden hochpolare Nitroverbindungen wie Bis(4-amino-3-nitrophenyl)sulfon mit flüssigem Ammoniak hydriert.
Hydrierungskatalysatoren
Die Dampfphasenhydrierung basiert auf Metallen oder Metallderivaten auf Trägern in Festbetten oder Wirbelbetten. Bei der Flüssigphasenhydrierung werden aufgrund ihrer relativ geringeren Kosten überwiegend Metalle mit großen Oberflächen eingesetzt, wie z. B. Raney-Nickel, Raney-Nickel-Eisen, Raney-Kobalt und Raney-Kupfer.
Edelmetallkatalysatoren wie Pt und Pd werden im Allgemeinen in Konzentrationen von 0,5–5 Gew.-% auf Trägermaterialien mit großer Oberfläche wie Holzkohle, Siliciumdioxid, Aluminiumoxid oder Erdalkalicarbonaten verwendet.
Die pulverförmige Katalysatorform eignet sich für Aufschlämmungen, während Pelletformen in Festbetten verwendet werden. Es ist unbedingt erforderlich, die Bedingungen zu optimieren, die die Wiederverwendung und Regeneration des Katalysators ermöglichen und gleichzeitig für die Produktion im großen Maßstab (>500 t/a) wirtschaftlich sind.
Zersetzungs- und Oxidationsnebenprodukte führen häufig zur Desaktivierung des Katalysators durch Oberflächenblockierung. Bereits geringe Mengen Schwefel-, Arsen- oder Antimonverbindungen können Katalysatoren vergiften. Allerdings zeigen diese Katalysatorgifte mit zunehmender Oxidationsstufe eine geringere Wirkung (z. B. As3- → As5+ oder S2- → S4+).
Bei Edelmetallkatalysatoren können Halogenid-, Natrium-, Magnesium-, Kobalt- und CO2-Ionen die Aktivität verringern. Schwefelhaltige nitroaromatische Verbindungen zeigen eine bessere Reduktion mit Molybdän oder Wolframsulfid oder mit Nickelkatalysatoren, die Zink oder Calciumcarbonat enthalten.
Pd-auf-Kohlenstoff-Katalysatoren können durch Kupfersalze angegriffen werden, während sowohl Nitrophenol als auch Nitrokresol bei der Hydrierung von Dinitrotoluol als starke Katalysatorgifte und Zersetzungsaktivatoren wirken.
Hydrierung von Halogenid-substituierten Nitroverbindungen
Die Hydrierung von Nitroverbindungen mit Halogenidsubstitutionen erfordert oft niedrigere Temperaturen, um einen Halogenid-Wasserstoff-Austausch zu verhindern. Katalysatoren, insbesondere sulfidvergiftete Metallkatalysatoren, zeigen unter solchen Bedingungen eine verringerte Aktivität.
1-Chlor-2-nitrobenzol kann bei 80 °C und 1,0–5,0 MPa (10–50 bar) effektiv reduziert werden, indem ein 5 Gew.-%iger Pt-auf-Kohlenstoff-Katalysator verwendet wird, der mit verdünnter Schwefelsäure behandelt wird, gefolgt von H2 und H2S. Dieser Katalysator kann ohne zusätzliche Reinigung bis zu 30 Mal recycelt werden.
Ähnliche Methoden wurden für die Hydrierung von 3-Chlornitrobenzol unter Verwendung von mit Thiocyanat behandelten Katalysatoren eingesetzt. Der Einsatz modifizierter Katalysatoren steigert die Selektivität und Effektivität der Reaktion, was zu hohen Ausbeuten und hervorragender Produktreinheit führt.
Ausrüstung und Baumaterialien
Die Hydrierung in der Dampfphase wird typischerweise im kontinuierlichen Modus durchgeführt, während die Flüssigphasenhydrierung je nach Maßstab durch diskontinuierliche oder kontinuierliche Prozesse erreicht werden kann. Kontinuierliche Flüssigphasenhydrierung wird hauptsächlich für einige ausgewählte Produkte im großen Maßstab eingesetzt, wie z. B. Dinitrotoluol, Nitrotoluol und 1-Nitronaphthalin.
Der Großteil der Produktion aromatischer Amine erfolgt jedoch in einer Batch-Hydrierung unter Verwendung von Katalysatoraufschlämmungen. Dieser Ansatz ermöglicht schnelle Übergänge zwischen Produkten, ein Luxus, den man sich bei der Verwendung von Festbettkatalysatoren nicht leisten kann.
Eine wirksame Vermischung der drei Phasen (Wasserstoffgas, Nitroverbindungslösung und fester Katalysator) ist wichtig. Für optimale Reaktionen sind ein schneller Transport der Reaktanten zu aktiven Katalysatorzentren und die anschließende Produktentfernung von entscheidender Bedeutung.
Während bei herkömmlichen diskontinuierlichen katalytischen Hydrierungen Rührautoklaven aus Stahl oder Edelstahl zum Einsatz kommen, hat die zunehmende Einführung der Schleifenreaktortechnologie zu einer verbesserten Leistung geführt. Schlaufenreaktoren wurden von Buss (Basel, Schweiz) erfolgreich zur katalytischen Hydrierung aromatischer Nitroverbindungen eingesetzt.
Zu den Vorteilen gegenüber Rührautoklaven gehören ein verbesserter Wärme- und Stoffübergang sowie eine verbesserte Reaktionsselektivität. Kontinuierliche Hydrierung führt im Allgemeinen zu kürzeren Chargenzykluszeiten und höheren Produktausbeuten. Auch der Katalysatorverbrauch wird oft reduziert.
Schleifenreaktoren bieten eine unkomplizierte und zuverlässige Methode für den Übergang von der Pilotanlage zur Produktion, da die Maßstabsvergrößerung in erster Linie von der Düsenkonfiguration und der Umpumprate bestimmt wird.
Im Gegensatz dazu ist die Maßstabsvergrößerung für Rührautoklaven aufgrund der erheblichen Diskrepanz zwischen kleinen Pilotbehältern und großen Produktionsbehältern (z. B. Verhältnisse 1:1500 bis 1:12500) komplexer.
Temperatur- und Konzentrationsgradienten sowie längere Reaktionszeiten in größeren Produktionsbehältern führen häufig zu unbeabsichtigten Nebenreaktionen und verringerten Produktausbeuten.
Schleifenreaktoren mildern diese Herausforderungen, indem sie die Reaktionen auf eine stark bewegte, genau definierte Zone mit wesentlich kürzeren Zykluszeiten beschränken.
2. Herstellung aromatischer Amine durch nukleophile Substitution
Im Allgemeinen können alle Nicht-Kohlenstoff-Substituenten am aromatischen Ring durch Aminogruppen ersetzt werden, aber nur einige wenige dieser Substitutionsreaktionen haben eine bedeutende industrielle Bedeutung. Diese beinhalten:
- Substitution von Halogenidgruppen
- Substitution von Hydroxyl- und Ethergruppen
- Substitution von Sulfogruppen
2.1. Austausch von Halogenid
Die Halogenidsubstitution ist nützlich bei der Erzeugung von Aminen, die neben Diarylaminen mono-, poly- oder heterocyclische Substituenten enthalten. Darüber hinaus erstreckt sich dieser Prozess auf Arylpolyamine und liefert zahlreiche relevante Produkte, insbesondere als Zwischenprodukte für Farbstoffe und Pigmente.
2.1.1. Aktivierte Halogenide
Aromatische Halogenide, die ortho- und/oder para-elektronenziehende Gruppen wie -NO2 oder -CN enthalten, können nukleophile aromatische Substitutionsreaktionen eingehen. Sowohl o-Chlornitrobenzol als auch p-Chlornitrobenzol reagieren mit Ammoniak bei 170 °C, während 2,4-Dinitrochlorbenzol bei einer niedrigeren Temperatur von 70 °C reagiert, ohne dass ein Katalysator erforderlich ist.
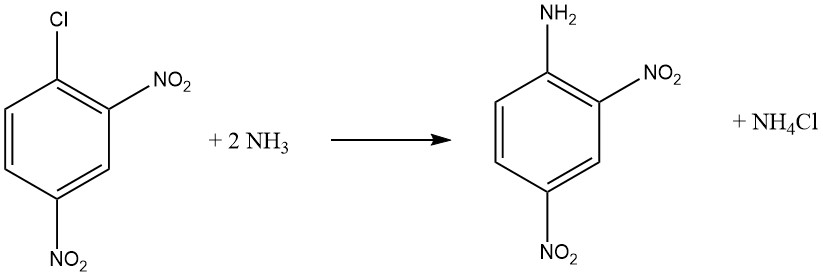
Die Reaktionsgeschwindigkeit zwischen der haloaromatischen Verbindung und dem Amin wird durch die Basizität des Amins beeinflusst, außer wenn sterische Hinderung ein Faktor ist.
Bei der Umsetzung von Methylamin oder Ammoniak mit einer Lösung oder Suspension von 2,4-Dinitrochlorbenzol bei höheren Temperaturen wird in guten Ausbeuten N-Methyl-2,4-dinitronilin anstelle von 2,4-Dinitroanilin erhalten.
Reaktionsbedingungen:
Bei der Synthese von 4-Nitroanilin wird 4-Chlornitrobenzol mit einem Überschuss an wässrigem Ammoniak in einem gerührten Titanreaktor bei 175 °C und 4,2 MPa (42 bar) über einen Zeitraum von 10 Stunden umgesetzt, was eine Ausbeute von 99,3 % ergibt.
Ein weiteres Beispiel ist die Herstellung von 4-(4-Methylanilino)-3-nitrobenzolsulfonamid, die durch 5-stündiges Erhitzen von 4-Chlor-3-nitrobenzolsulfonamid mit p-Toluidin auf 130 °C erreicht wird, was zu einer Ausbeute von 90,1 % führt.
Bei der Synthese von 4-Nitrodiphenylamin, einem Vorläufer für Kautschuk-Antiozonmittel, wird 4-Nitrochlorbenzol mit Anilin in Chlorbenzol kondensiert. N-alkylierte p-Phenylendiamin-Derivate können jedoch nicht in wässrigem Medium hergestellt werden.
2.1.2. Nicht aktivierte Halogenide
Nicht aktivierte Halogenide zeigen Eliminierungs-Additions-Reaktionen über ein Benzin-Zwischenprodukt, ein Prozess, der höhere Temperaturen erfordert als die nukleophile aromatische Substitution. Solche Reaktionen führen zu Isomerengemischen, wenn zusätzliche Substituenten vorhanden sind, was ihre industrielle Anwendung einschränkt.
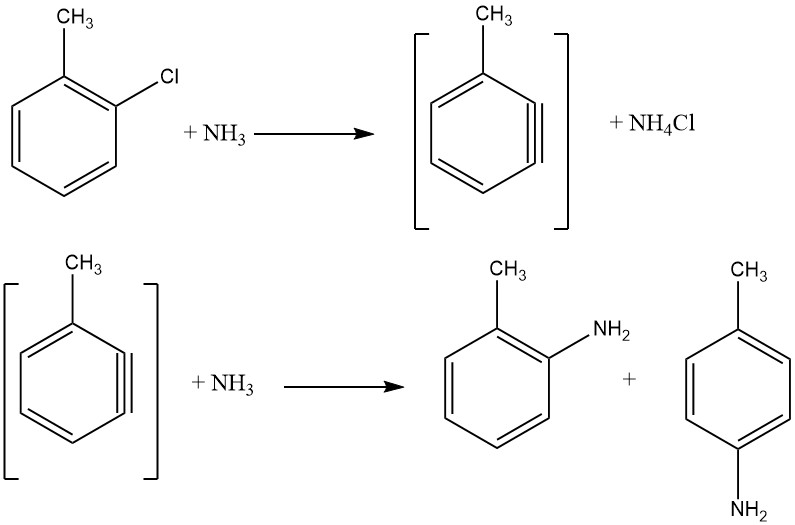
Die Reaktion zwischen Chlorbenzol und Ammoniak erfolgt mit angemessenen Geschwindigkeiten erst oberhalb von 200 °C, was häufig die Anwesenheit eines Katalysators wie Kupfer(I)- und Kupfer(II)-Salzen oder deren Aminkomplexe erfordert.
Auch Metallamide wie NaNH2 und LiNEt2 werden eingesetzt. Die zur Erleichterung des Halogenidaustauschs erforderliche Energie ist umgekehrt proportional zur Reihenfolge der aktivierten Halogenide: F < Cl < Br < I.
Reaktionsbedingungen:
Typischerweise in einer wässrigen Suspension oder Lösung bei erhöhten Temperaturen und Drücken durchgeführt, ist eine sorgfältige Temperaturüberwachung während der Aufheizphase in Batch-Prozessen aufgrund der exothermen Natur von Arylhalogenid-Amin-Reaktionen von entscheidender Bedeutung.
Kontinuierliche Prozesse mildern diese Bedenken im Allgemeinen. Der freigesetzte Halogenwasserstoff wird mit überschüssigem Ammoniak oder durch Zugabe von Basen wie Natriumcarbonat oder Calciumoxid neutralisiert. Bei einem erheblichen Überschuss an Amin verläuft die Reaktion normalerweise mit nahezu vollständiger Ausbeute.
Bei unzureichendem Überschuss an stark basischen Aminen in wässrigen Lösungen kann es zu Nebenreaktionen wie Hydrolyse oder Diarylaminbildung kommen.
Die Hydrolyse von Cyanogruppen zu Amiden in wässrigen Lösungen kann durch den Einsatz inerter Lösungsmittel verhindert werden. Carbonsäuren können leicht in die entsprechenden Amide umgewandelt werden, indem die Reaktion in nichtwässrigen Medien durchgeführt wird.
Baumaterialien:
Bei erhöhten Temperaturen und Drücken kann das Vorhandensein von Halogeniden und Aminen schwere Korrosion hervorrufen, was die Auswahl von Material und Ausrüstung zu einer Herausforderung macht. Während normale Stahlautoklaven für Laborzwecke ausreichen können, ist mit einer erheblichen Wandstärkenreduzierung zu rechnen (einige Millimeter pro Jahr).
Darüber hinaus kann Spannungskorrosion den Reaktorverfall beschleunigen. Niedriglegierte Stähle sind für Produktionsanlagen, insbesondere solche mit kontinuierlichen Reaktoren, schlecht geeignet. Erfolgreiche Reaktionen in wässrigen Medien wurden mit rostfreien Stählen, insbesondere chrom- und nickelhaltigen austenitischen Stählen der Typen 316, erzielt.
Allerdings neigen selbst diese Materialien zur Lochfraßbildung, was zur Verwendung korrosionsbeständigerer Legierungen wie Hastelloy und Inconel führt. Auch Reaktormaterialien wie Zirkonium, Titan und Tantaclad (mit Tantal umhüllter Stahlexplosionsstahl) haben Anwendung gefunden.
2.2. Austausch von Hydroxyl- und Ethergruppen
Der Ersatz einer aromatischen Hydroxylgruppe durch ein Amin ist nicht auf Phenole und Kresole beschränkt; es erstreckt sich auch auf Chinolin- und Isochinolin-Derivate. Ammoniak kann aktivierte Alkoxygruppen in ortho- oder para-Position ersetzen, wobei die Aktivierung durch Nitro-, Halo- oder Cyanogruppen induziert wird.
Beispielsweise reagiert 2,4-Dinitroanisol mit Ammoniak bei Temperaturen im Bereich von 50 bis 200 °C und ergibt 2,4-Dinitroanilin mit einer Ausbeute von 50 bis 90 %.
Das Interesse an Phenol-Amin-Reaktionen hängt oft von den Kosten des Phenol-Rohstoffs ab. Die primären Austauschprozesse sind:
1. Reaktion im wässrigen Medium ohne Katalysator:
Bei erhöhter Temperatur und erhöhtem Druck reagiert 3-Nitrosalicylsäure mit wässrigem Ammoniak zu 2-Amino-3-nitrobenzoesäure.
2. Reaktion in Gegenwart eines sauren Katalysators:
m-Aminophenole entstehen durch die Reaktion von Resorcin und wässrigem Ammoniumhydroxid oder Alkylaminen mit Borsäure als Katalysator.
Durch den Einsatz desselben Katalysators unter wasserfreien Bedingungen reagiert Resorcin mit Ethanolamin oder 3-Amino-1-propanol zu 3-(β- und γ-Hydroxyalkylamino)phenolen. Ein analoger Prozess verwendet einen säureaktivierten Aluminiumoxid-Siliciumdioxid-Katalysator.
3. Mehrphasensystemreaktionen ergeben Nitroaniline aus Nitrophenolen und Ammoniak, vorzugsweise durch Verwendung eines Lösungsmittels, in dem das Reaktionsprodukt eine gute Löslichkeit aufweist. Bei diesen Reaktionen werden zahlreiche Phasentransferkatalysatoren eingesetzt.
4. p-Nitrosoanilin und p-Nitroso-N-phenylamin werden in flüssigem Ammoniak unter Verwendung eines Ammoniumsalzes oder eines tertiären Amins in einem organischen Lösungsmittel synthetisiert.
5. p-Nitrosophenole reagieren mit Alkylaminen über p-Nitrosophenylether und ergeben die entsprechenden N-substituierten p-Nitrosoaniline. Das dabei entstehende Wasser wird entfernt, um die Reaktion zum Abschluss zu bringen.
6. Das Halcon-Verfahren ist eine bedeutende Dampfphasenaminierung von Phenol, bei der Phenole oder Naphthole mit Ammoniak in der Gasphase bei 250 °C unter Verwendung metallischer oder nichtmetallischer Oxide wie MgO, B2O3, Al2O3, SiO2, TiO2 reagieren oder Mischungen.

U.S. Steel Chemicals setzt das Halcon-Verfahren seit 1982 in seinem Werk in Haverhill, Ohio ein und produziert Anilin aus Phenol (Anilinkapazität: 100.000 t/a).
7. Die Bucherer-Reaktion ist die Reaktion von 1- oder 2-Naphtholen mit wässrigen Amin- oder Ammoniumlösungen unter Verwendung von Hydrogensulfit als Katalysator. Diese Reaktion wird hauptsächlich für die Naphthalinreihe verwendet. Der Einsatz von Hydrogensulfit senkt die Reaktionstemperatur um 50 bis 150 °C und führt zu einer hohen Reinheit und Ausbeute (85 – 95 %).
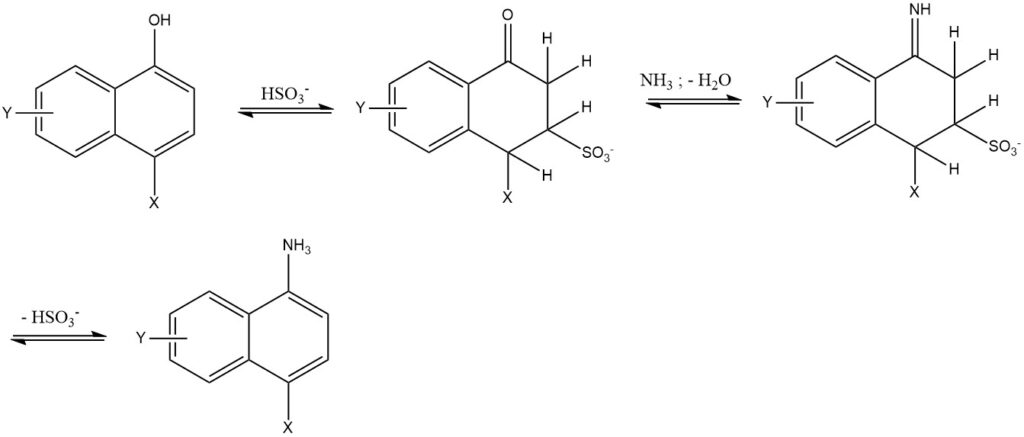
2.3. Austausch von Sulfogruppen
Ammoniak hat die Fähigkeit, Sulfogruppen in Benzol-, Naphthalin- und Anthrachinon-Derivaten zu ersetzen. Allerdings hat dieser Austauschprozess nur innerhalb der Anthrachinonreihe eine bedeutende industrielle Bedeutung.
In der Vergangenheit erfolgte die Herstellung von 1-Aminoanthrachinonen durch die Reaktion von 1-Sulfoanthrachinonen mit Aminen. Um der Freisetzung von Hydrogensulfit entgegenzuwirken, wurden stöchiometrische Mengen eines Oxidationsmittels, beispielsweise Natrium-3-nitrobenzolsulfonat, zugegeben.
Ein neuerer Ansatz zur Synthese von 1-Aminoanthrachinon beinhaltet die Reduktion des entsprechenden Nitroanthrachinons. Diese Methode macht die quecksilberkatalysierte Sulfonierung, die zu 1-Sulfoanthrachinon führt, überflüssig.
Durch einen Prozess, der in einem wässrigen Medium unter Druck bei Temperaturen im Bereich von 100 bis 200 °C durchgeführt wird, wird 1-Cyclohexylaminoanthrachinon-5-sulfonsäure aus Anthrachinon-1,5-disulfonsäure und Cyclohexylamin erzeugt. Die Oxidation von Hydrogensulfit wird mit Substanzen wie Natriumperchlorat oder 3-Nitrobenzolsulfonsäure erreicht.
3. Andere Prozesse
In dieser Diskussion werden verschiedene in der Literatur beschriebene Methoden zur Synthese aromatischer Amine hervorgehoben. Es ist wichtig zu beachten, dass hier nur eine Auswahl dieser Methoden behandelt wird.
Die großtechnische Produktion von 4,4′-Methylendianilin beinhaltet die Kondensation von Anilin mit Formaldehyd in wässrigen oder wässrig-methanolischen Lösungen.
Diphenylamin wird durch Dampfphasenkondensation von Anilin über einem Aluminiumoxid- oder Titankatalysator bei Temperaturen im Bereich von 450 bis 500 °C synthetisiert. Alternativ kann es in flüssiger Phase bei Temperaturen von 175 bis 450 °C hergestellt werden.
Arylhydroxylamine können in verdünnter Schwefelsäure zu o- und p-Aminophenolen umgelagert werden.
Ein wichtiges Pigmentzwischenprodukt, 3,3′-Dichlorbenzidin, wird von Bofors (mit Sitz in Muskegan, MI) hergestellt. Der Prozess beinhaltet die Benzidinumlagerung, die von o-Chlornitrobenzol ausgeht.
Verweise
- Amines, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_037
-
Process for the production of aromatic amines. – https://patents.google.com/patent/US5877350A/en
