Cyanuurzuur: eigenschappen, reacties, productie en toepassingen
Wat is cyanuurzuur?
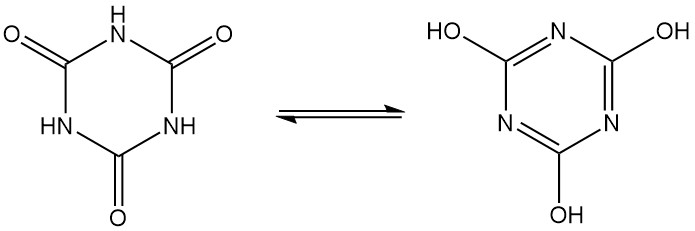
Cyanuurzuur, ook bekend als 1,3,5-triazine-2,4,6(1H,3H,5H)-trione, is een geurloze witte kristallijne vaste stof met een moleculaire formule van C3H3N3O3. Het is een cyclisch trimeer dat interconverteert tussen verschillende structuren via lactam-lactim tautomerie.
Hoewel cyanuurzuur al sinds 1776 bekend is, kreeg het pas in de jaren 50 van de vorige eeuw industriële betekenis.
Inhoudsopgave
1. Fysieke eigenschappen van cyanuurzuur
Cyanuurzuur is een witte kristallijne vaste stof die een kleurloos kristallijn dihydraat vormt uit water en water verliest bij blootstelling aan droge lucht. Het is een zwak tribasisch zuur dat licht oplosbaar is in water en organische oplosmiddelen zoals aceton, benzeen, ether, ethanol, hexaan en isopropylalcohol.
De volgende tabel toont de oplosbaarheid van cyanuurzuur in verschillende oplosmiddelen bij 25 °C (wt%).
| Oplosmiddel | Oplosbaarheid (wt%) |
|---|---|
| Dimethylsulfoxide | 17,4 |
| Zwavelzuur (98 wt%) | 14,1 |
| Dimethylformamide | 7,2 |
| N-methyl-2-pyrrolidon | 6,3 |
| Dimethylacetamide | 3.0 |
| Pyridine | 2.2 |
De belangrijkste fysische eigenschappen van cyanuurzuur staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | 108-80-5 |
| Formule | C3H3N3O3 |
| Moleculair gewicht | 129,07 g/mol |
| Smeltpunt | 320 – 330 °C (ontleding) |
| Dichtheid | 1,80 g/cm³ |
| pKa1 | 6,88 |
| pKa2 | 11,40 |
| pKa3 | 13,5 |
2. Reacties van cyanuurzuur
Cyanuurzuur reageert met anorganische en organische basen om zouten te vormen, die de hydroxytautomeer in alkalische oplossingen begunstigen.
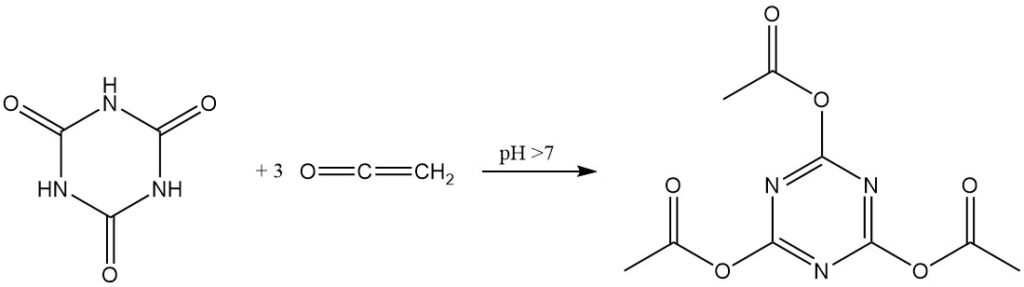
Onder druk en met een katalysator bij 350–400 °C reageert cyanuurzuur met ammoniak om melamine te produceren.
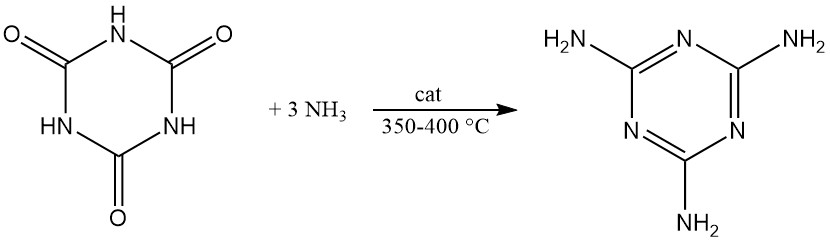
In aanwezigheid van alkalische katalysatoren reageert keteen met cyanuurzuur om triacetylcyanuraat te vormen in hoge opbrengst.
Cyanuurzuur reageert voornamelijk als een cyclisch imide. Het nucleofiele isocyanuraatstikstofatoom, vaak in anionische vorm, valt een positief gepolariseerd koolstofatoom aan. Dit leidt doorgaans tot trigesubstitueerde producten.
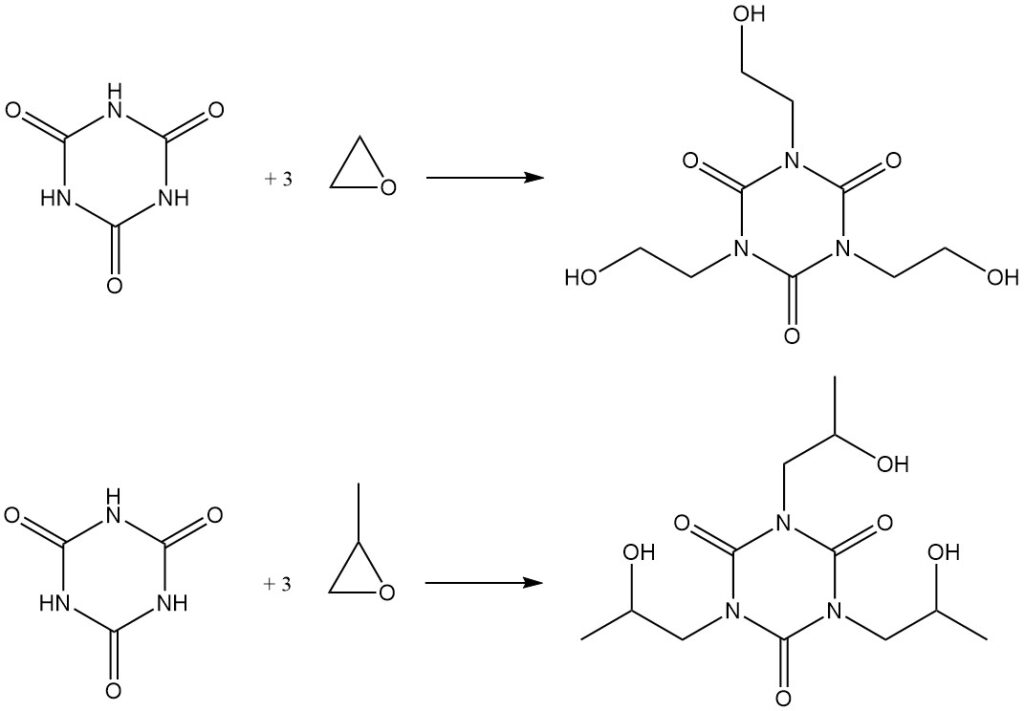
Het verhitten van cyanuurzuur met epoxiden in DMF resulteert in de vorming van hydroxyalkylisocyanaten. Voorbeelden zijn de synthese van tris(2-hydroxyethyl)isocyanuraat uit ethyleenoxide en het overeenkomstige hydroxypropylderivaat uit propyleenoxide.
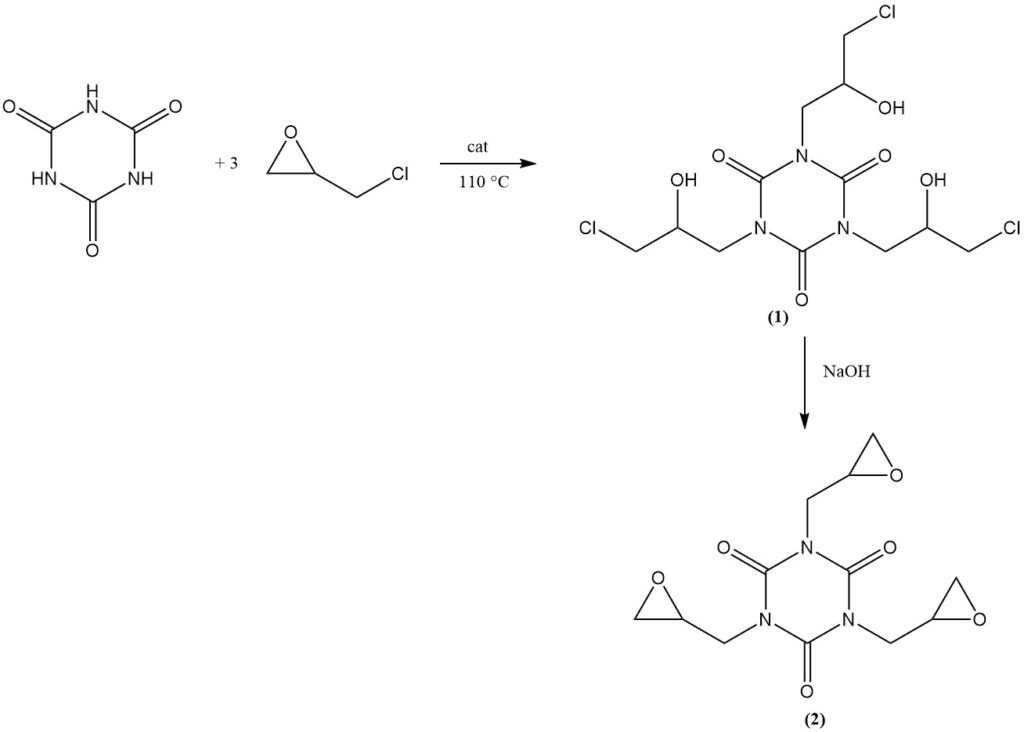
De reactie van cyanuurzuur met epichloorhydrine in aanwezigheid van een basische katalysator bij 110 °C levert tris(3-chloor-2-hydroxypropyl)isocyanuraat (1) op. Vervolgens levert dehydrochlorering in een waterige alkalische oplossing het commerciële product tris(2,3-epoxypropyl)isocyanuraat (2) op.
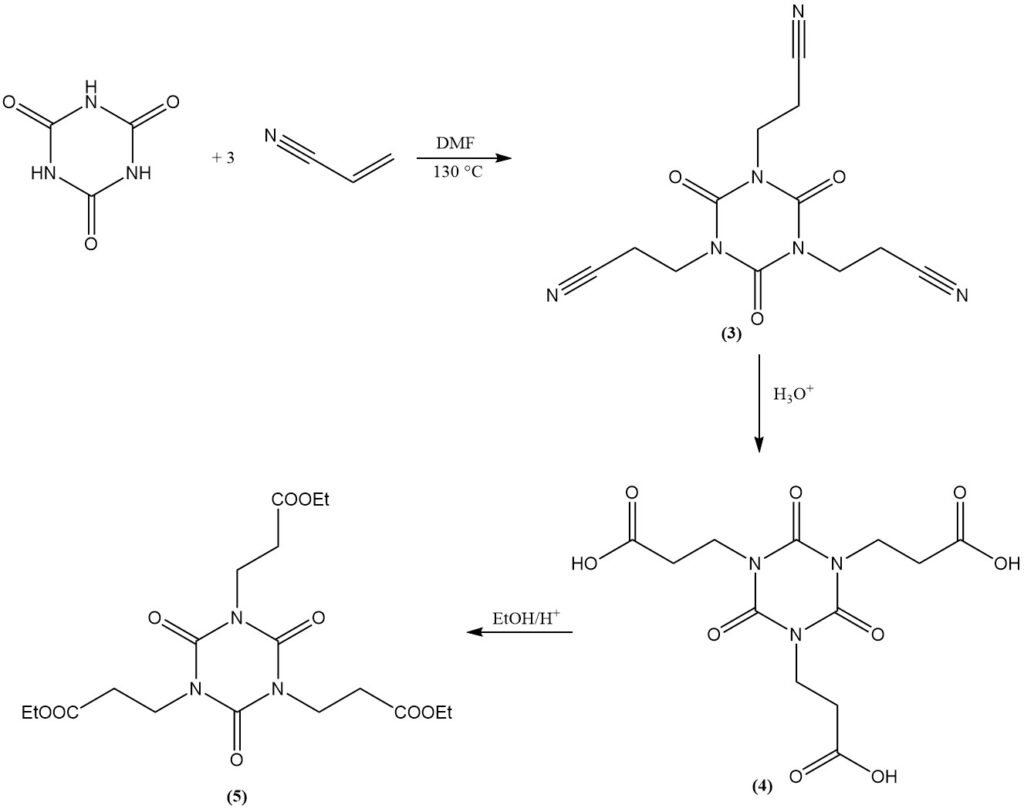
Cyanuurzuur ondergaat additiereacties met dubbele bindingen. Een voorbeeld is de vorming van bis(2-cyanoethyl) en tris(2-cyanoethyl) isocyanuraten uit acrylonitril in DMF bij 130 °C. Tris(2-cyanoethyl) isocyanuraat (3) kan worden verzeept om tris(2-carboxyethyl) isocyanuraat (4) te verkrijgen.
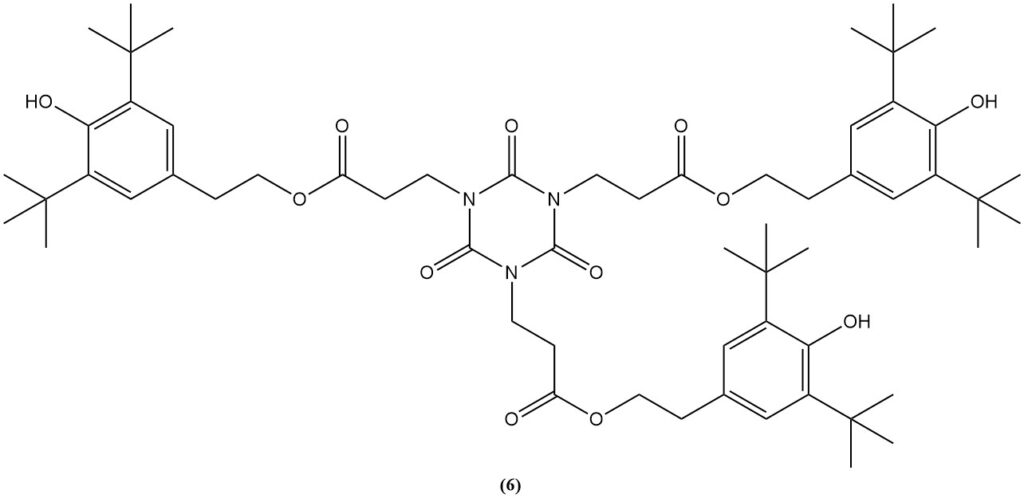
De verestering van het carboxyethylderivaat met ethanol produceert tris(2-carbethoxyethyl) isocyanuraat (5), een voorloper voor de commerciële lichtstabilisator en antioxidant (6).
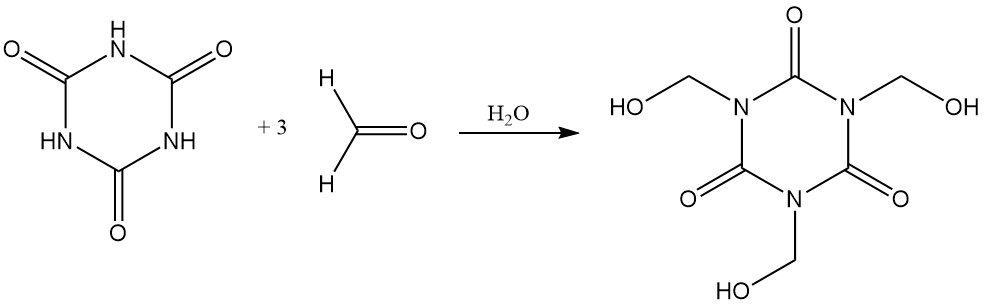
Cyanuurzuur lost gemakkelijk op in waterige formaldehyde om tris(hydroxymethyl)isocyanuraat te vormen.
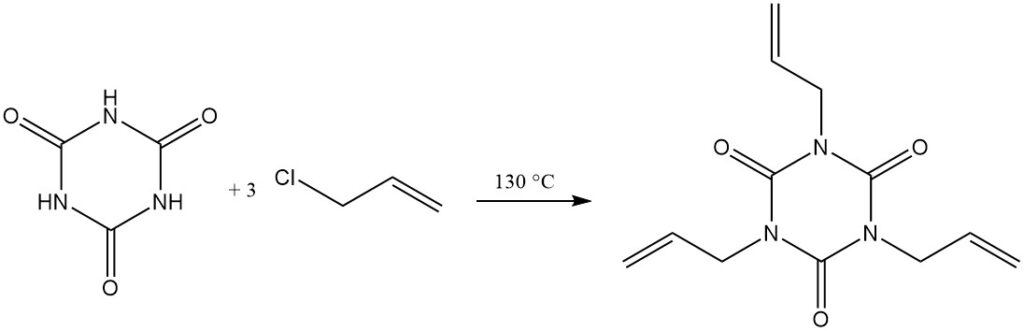
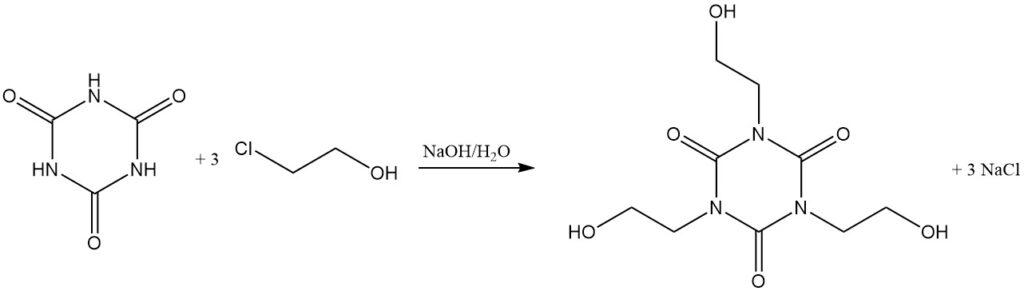
Bij verhoogde temperaturen en met een protonacceptor reageren alkylhaliden met cyanuurzuur. Voorbeelden zijn de reactie met allylchloride in dichloorbenzeen/triethylamine bij 130 °C om triallylisocyanuraat te vormen en met 2-chloorethanol in waterige natriumhydroxide om tris(2-hydroxyethyl)isocyanuraat te vormen.
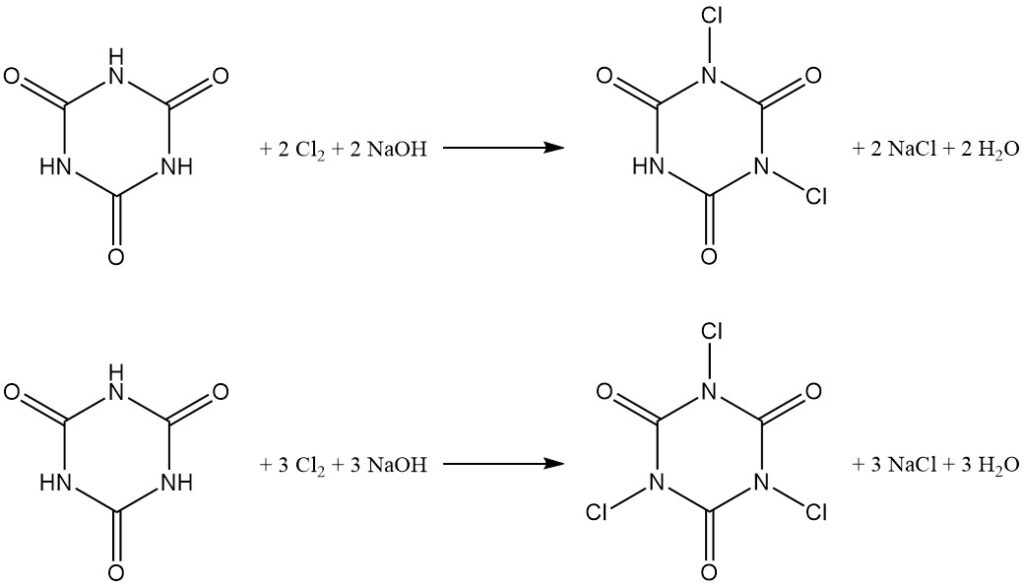
Gecontroleerde pH-chlorering van cyanuurzuur in water levert N,N’-dichloor en N,N’,N”-trichloor derivaten op (zie het artikel over chlooramines).
De productverdeling is afhankelijk van de molaire verhouding natriumhydroxide tot cyanuurzuur, waarbij een verhouding van 2:1 N,N’-dichloorisocyanuurzuur (DCCA) bevoordeelt en een verhouding van 3:1 N,N’,N”-trichloorisocyanuurzuur (TCCA) bevoordeelt met een opbrengst van 90%.
Boven 200 °C ontleedt cyanuurzuur langzaam, en versnelt het bij het smeltpunt (320–330 °C). Het primaire product is isocyaanzuur. Bij hogere temperaturen omvatten ontledingsreacties waarschijnlijk ringsplitsing via een cyanuurzuurintermediair.
3. Productie van cyanuurzuur
Zuiver cyanuurzuur kan in het laboratorium worden geproduceerd door de hydrolyse van cyanuurchloride of melamine. Verdere zuivering omvat herkristallisatie uit dimethylformamide of met behulp van natrium- of ammoniumzouten.
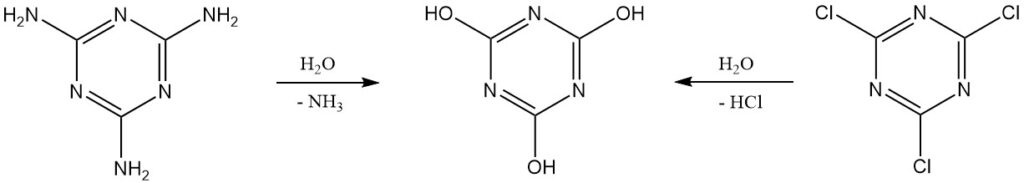
Cyanuurzuur wordt op commerciële schaal geproduceerd door thermische ontleding (pyrolyse) van ureum bij 200–300 °C, waarbij ammoniak als bijproduct ontstaat.
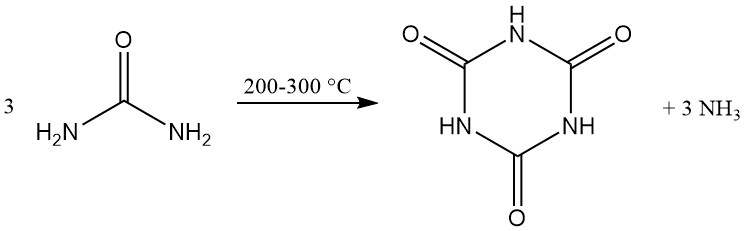
Talrijke gepatenteerde methoden richten zich op het verbeteren van warmte- en massaoverdracht door speciale reactoren te ontwerpen of reactiemengsels te modificeren. Tot de gebruikte reactoren behoren verwarmde schroeven, roterende trommels, transportbanden, roterende buisovens en kogelmolens.
Gefluïdiseerde bedden met AlF3-deeltjes of cyanuurzuurkristallen en hoogfrequente inductieverhitting van gesmolten ureum zijn ook onderzocht.
Het klonterprobleem tijdens het proces wordt opgelost door gebruik te maken van voorgemengde poeders met specifieke ureum-cyaanzuurverhoudingen, voorgevormd ureumcyanuraat of door het ruwe product te recyclen.
Gesmolten metalen of zouten kunnen worden gebruikt als warmteoverdrachtsmedia in plaats van directe verhitting. Hoogkokende oplosmiddelen zoals polyglycolethers en sulfolanen die ureum oplossen maar geen cyanuurzuur kunnen worden gebruikt om plaatselijke oververhitting te voorkomen en de vorming van isocyaanzuur te minimaliseren.
Ruw cyanuurzuur bevat doorgaans tot 30% onzuiverheden zoals melamine en zijn voorlopers. Zuiveringsmethoden omvatten zuurbehandeling en scheiding op basis van oplosbaarheid.
Verdunde minerale zuren zetten onzuiverheden om in ammoniak, koolstofdioxide of cyanuurzuur zelf. Een andere methode is dat het ruwe zuur wordt opgelost in een alkalische oplossing (NaOH of verdunde ammoniak) en dat de organische onzuiverheden vervolgens worden gefilterd. Het cyanuurzuur wordt vervolgens neergeslagen door minerale zuren toe te voegen.
4. Toepassingen van cyanuurzuur
Het belangrijkste gebruik van cyanuurzuur is bij de productie van N-gechloreerde isocyanuraten. Deze chloorhoudende derivaten worden veel gebruikt als ontsmettingsmiddelen en schoonmaakmiddelen in:
- Zwembadontsmettingsmiddelen
- Huishoudelijke bleekmiddelen
- Industriële en institutionele schoonmaakmiddelen
- Vaatwasmiddel
Cyanuurzuur wordt ook gebruikt om chloor in zwembadwater te stabiliseren door de deactiveringssnelheid met een factor 5-10 te verlagen bij gebruik in concentraties van 25-50 ppm.
Het is goedgekeurd voor gebruik als stikstofbron in voer voor herkauwers. Cyanuurzuur is een voorloper van isocyaanzuur.
Kleine hoeveelheden cyanuurzuur worden gebruikt om NOx-emissies in uitlaatgassen van stationaire dieselmotoren en boilers die worden gestookt op steenkool, olie of gas te verminderen.
Verschillende isocyanuraatderivaten van cyanuurzuur worden gebruikt in de kunststofindustrie. Voorbeelden zijn:
- Triallyl-isocyanuraat: gehomopolymeriseerd of gecopolymeriseerd, het functioneert als een cross-linking agent in polyethyleen, polyvinylchloride (PVC) en laminaatformuleringen.
- Tris(2-hydroxyethyl)isocyanuraat: Deze verbinding fungeert als een cross-linking agent voor polyurethanen, polyesters en alkydharsen die worden gebruikt in draademail en elektrische lakken.
- Triglycidylisocyanuraat: Het is een cross-linking agent in epoxyharsen en een uithardingsmiddel voor weerbestendige poedercoatings.
Melaminecyanuraat heeft commercieel belang gekregen als halogeenvrije vlamvertrager voor polyamideharsen. Het wordt ook gebruikt als een potentieel vast smeermiddel.
Tris(2-carboxyethyl)isocyanuraat wordt gebruikt bij de productie van in water oplosbare alkydharsen. De esterderivaten ervan dienen als weekmakers voor PVC en smeermiddelen.
5. Toxicologie van cyanuurzuur
Cyanuurzuur wordt over het algemeen beschouwd als een product met een laag risico. Het wordt geclassificeerd als in wezen niet-toxisch (acuut oraal en dermaal) en niet-irriterend voor de huid en ogen.
Acute toxiciteitsgegevens:
- LD50 (rat, oraal) > 5000 mg/kg (praktisch niet-toxisch)
- LD50 (konijn, dermaal) > 5000 mg/kg (praktisch niet-toxisch)
- LC50 (vis) > 2000 mg/L (24u) (lage toxiciteit)
- EC50 (Daphnia) > 2000 mg/L (lage toxiciteit)
Gegevens over subacute toxiciteit:
- NOEL (vis): 1000 mg/L
- NOEL (algen): 2500 mg/L
- Remming van de voortplanting (Daphnia): 1000 mg/L
Hoewel cyanuurzuur een lage inherente toxiciteit heeft, moet inademing van stof, oogcontact en inname toch worden vermeden. Wees u ervan bewust dat het boven 200 °C ontbindt tot giftig isocyaanzuur.
Referentie
- Cyanuric Acid and Cyanuric Chloride; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_191
