Butanon: Eigenschappen, Reacties, Productie en Toepassingen
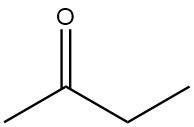
Wat is butanon?
Butanon, ook bekend als methylethylketon, is een alifatisch keton met de chemische formule C4H8O. Het is een kleurloze, laagviskeuze, ontvlambare vloeistof met een karakteristieke ketongeur die lijkt op die van aceton.
Butanon wordt voornamelijk gesynthetiseerd door het dehydrogeneringsproces van 2-butanol, vergelijkbaar met de productie van aceton door dehydrogenering van gasvormige isopropylalcohol met behulp van koper-, zink- of bronskatalysatoren bij temperaturen tussen 400 en 550 °C.
De conversie van 2-butanol bereikt 80-95% en de selectiviteit van butanon overschrijdt 95%. Bijproducten omvatten butenen gevormd door dehydratie en hogere ketonen door zelfcondensatie. In 2005 bereikte de wereldproductie van methylethylketon ongeveer 1 miljoen ton.
Inhoudsopgave
Sinds de jaren 80 is er een groeiende interesse in het gebruik van 2-butanon als oplosmiddel in verf en lijm. Methylethylketon wordt in het bijzonder gezien als een concurrent van ethylacetaat, vooral wanneer het wordt gebruikt als een oplosmiddel met een laag kookpunt.
De veelzijdigheid ervan als oplosmiddel strekt zich uit tot verschillende toepassingen zoals nitrocellulose, celluloseacetaat-butyraat, ethylcellulose, acrylharsen, vinylacetaten en vinylchloride-vinylacetaatcopolymeer, voornamelijk bij de bereiding van synthetische oppervlaktecoatings.
De geschiktheid ervan als lakoplosmiddel wordt toegeschreven aan de lage viscositeit, hoge concentratie vaste stoffen en het brede scala aan compatibele verdunningsmiddelen.
De verwijdering van methylethylketon van de lijst met gevaarlijke luchtverontreinigende stoffen (HAP) in 2005 speelde een belangrijke rol bij het behoud van de marktpositie van butanon in de Verenigde Staten. Bovendien is butanon bruikbaar als activator in oxidatieve reacties, als selectief extractiemiddel, als gespecialiseerd oplosmiddel voor het ontparaffineren van minerale oliefracties en als chemisch tussenproduct.
1. Fysische eigenschappen van butanon
Butanon is een laagkokend, snel verdampend oplosmiddel met een kookpunt van 79,6 °C. Het is slechts gedeeltelijk mengbaar met water, terwijl het volledig mengbaar is met de meeste organische oplosmiddelen.
Methylethylketon vormt binaire en ternaire azeotrope mengsels in combinatie met water en verschillende organische verbindingen.
Fysische eigenschappen van butanon omvatten:
- Molaire massa = 72,1 g/mol
- smeltpunt = -86,7 °C
- Vloeistofdichtheid bij 25 °C = 0,7995
- Breukindex bij 25 °C = 1,736
- Vloeistofviscositeit bij 25 °C = 0,395 mPa.s
- Oplosbaarheid bij 20 °C in water = 27,5 %
2. Chemische reacties van butanon
Onder normale omstandigheden en bij afwezigheid van atmosferische zuurstof is butanon stabiel. Na langdurige opslag moet voorzichtigheid worden betracht omdat methylethylketonperoxide wordt gevormd in aanwezigheid van zuurstof. Explosies kunnen optreden door onmiddellijke ontleding van de peroxiden.
2-Butanon is onverzeepbaar en hitte- en lichtbestendig. Het ontleedt echter na langdurige blootstelling aan UV-straling en geeft ethaan, methaan, koolmonoxide, ethyleen en diacetyl.
Diacetyl wordt gevormd door oxidatie van methylethylketon met lucht in aanwezigheid van speciale katalysatoren.
Methylethylketonperoxide, een polymerisatiekatalysator, wordt gevormd door oxidatie van butanon met een oplossing van waterstofperoxide.
Salpeterzuur en andere sterke oxidatiemiddelen oxideren butanon tot een mengsel van mierenzuur en propionzuur.
2-Butanol wordt verkregen door katalytische reductie van butanon met waterstof, door elektrolytische reductie in natriumacetaatoplossing of door reductie met ammoniumamalgaam of lithiumaluminiumhydride.
Een ander reductieproduct is 3,4-Dimethyl-3,4-hexaandiol dat wordt verkregen door elektrolytische reductie van methylethylketon in een zuur medium of door reductie met magnesiumamalgaam.
Methylethylketon vertoont reactiviteit ten opzichte van waterstofcyanide, natrium- en kaliumwaterstofsulfieten, wat resulteert in de vorming van additieproducten.
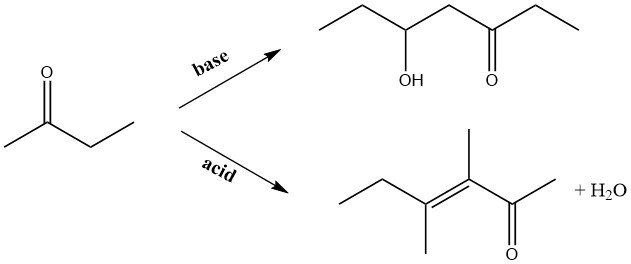
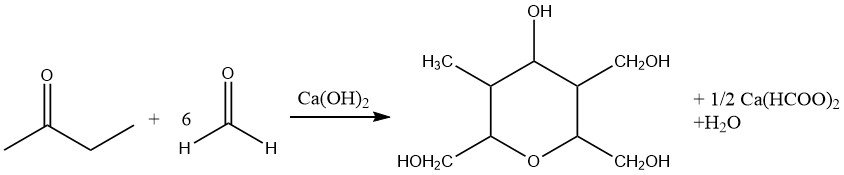
Onder alkalische omstandigheden ondergaat 2-butanon condensatiereacties met aldehyden, wat leidt tot de productie van hogere onverzadigde ketonen. Met name wanneer formaldehyde wordt gebruikt, wordt methylisopropylketon geproduceerd als een tussenproduct voor daaropvolgende syntheses, wat een specifiek interessegebied vormt.
Tijdens base-gekatalyseerde autocondensatie in de vloeibare fase of gasfasecondensatie op gealkaliseerde koperkatalysatoren reageert de carbonylgroep in het molecuul met de methylgroep. Omgekeerd wordt bij zuurgekatalyseerde condensatie de methyleengroep die naast de carbonylgroep ligt, het aanvalspunt.
De condensatie van butanon en citral resulteert in de vorming van methylpseudoionon, dat vervolgens cyclisatie kan ondergaan om methylionon te produceren. Deze verbinding wordt gebruikt bij de productie van synthetische violette parfums.
In aanwezigheid van laagmoleculaire aldehyden, met name tijdens base-gekatalyseerde en zuur-gekatalyseerde aldolisatie, is de α-positie van de carbonylgroep primair betrokken bij de reactie.
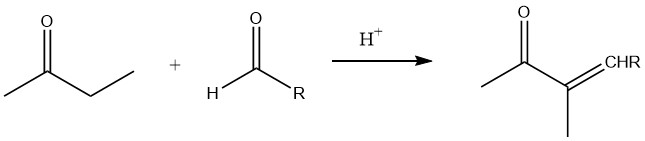
Dus, het gebruiken van minder dan stoichiometrische hoeveelheden formaldehyde in base-gekatalyseerde aldolisatie leidt tot de vorming van 2-methyl butaan-1-ol-3-on. Verder produceert uitputtende hydroxymethylering gepaard gaande met reductie van de carbonylgroep (gekruiste Cannizzaro-reactie) desoxyanhydroeneaheptiet.
Wanneer methylethylketon reageert met primaire en secundaire alcoholen, levert het hogere ketonen op. De reactie met sec-butylalcohol resulteert specifiek in de vorming van ethylamylketon.
Methylethylketon vertoont reactiviteit ten opzichte van polyoxyverbindingen of epoxiden, wat leidt tot de vorming van cyclische producten.
Amylnitriet valt selectief de CH2-groep aan in α-positie ten opzichte van de carbonylgroep, wat het monooxime van diacetyl oplevert.
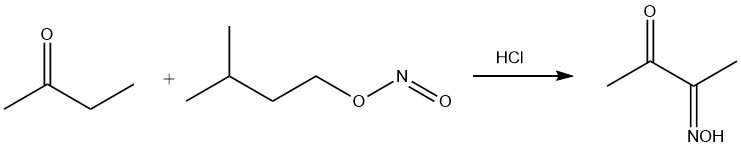
De ketogroep ondergaat een reactie met aminogroepen, wat resulteert in de eliminatie van water. In combinatie met hydroxylamine levert deze reactie methylethylketoxime op, een antiskinningmiddel.
De condensatie van butanon met alifatische esters en anhydriden produceert β-diketonen.
Fenolen ondergaan reacties met methylethylketon, waarbij oxyfenyleenverbindingen worden gevormd. Wanneer ze reageren met fenol, wordt 2,2-hydroxyfenylbutaan, een homoloog van hydroxyfenylpropaan (Bisfenol A), verkregen. Bisfenol A is een belangrijk materiaal dat wordt gebruikt bij de productie van synthetische harsen.
Methylethylketon kan worden onderworpen aan halogenering op de α-positie. Bovendien reageert het met Grignard-verbindingen, wat resulteert in de vorming van tertiaire alcoholen.
In aanwezigheid van acetyleen en natriumamide wordt 3-methyl-1-pentyn-3-ol gesynthetiseerd. Door 2-butanon te combineren met N-methylformamide kan N-methyl-formyl-aminobutaan worden verkregen. Bovendien maakt de Reformatzky-reactie de productie van β-oxyesters mogelijk met behulp van monobroom-gesubstitueerde esters.
3. Productie van butanon
De primaire methode voor de productie van butanon omvat de dehydrogenering van 2-butanol (sec-butylalcohol, SBA). Deze procestechniek wordt gebruikt in ongeveer 92% van de wereldwijde productiecapaciteiten, zoals gerapporteerd in 2006.
2-butanol kan eenvoudig worden verkregen via een tweestapsproces van het hydrateren van n-butenen afgeleid van petrochemische C4-raffinaten. Vloeibaar zwavelzuur wordt gebruikt als katalysator in dit proces. Als alternatief omvat een eenstapsprocedure de directe toevoeging van water aan een gestabiliseerde zure ionenuitwisselingshars, die dient als katalysator.
De resterende 8% methylethylketon wordt geproduceerd via een fatale productiemethode via Fischer-Tropsch-synthese of door katalytische oxidatie van vloeibaar n-butaan, wat resulteert in de productie van azijnzuur en methylethylketon als bijproduct.
3.1. Productie van butanon door katalytische dehydrogenering van sec-butylalcohol in de gasfase
De dehydrogenering van sec-butylalcohol (SBA) met behulp van koper-, zink- of bronskatalysatoren is een endotherme reactie met een warmteverandering (ΔH) van -51 kJ/mol. Het verhogen van de temperatuur leidt tot een verhoging van de concentratie butanon in het reactiemengsel, die stabiliseert op ongeveer 350 °C, ervan uitgaande dat er geen volgende reacties plaatsvinden.
Bij dehydrogenering in de gasfase is koper de voorkeurskatalysator, terwijl zink- of bronskatalysatoren doorgaans hogere dehydrogeneringstemperaturen vereisen (400 °C).
Zinkoxidekatalysatoren vertonen vaak een lagere selectiviteit vanwege een nevenreactie waarbij SBA wordt gedehydrateerd tot n-butenen. Voor de dehydrogenering van SBA worden katalysatoren zoals platina op aluminiumoxide, koper of chroom, en koper en zink op aluminiumoxide aanbevolen, vooral wanneer SBA aanzienlijke hoeveelheden water bevat.
Commerciële katalysatoren worden gereactiveerd door oxidatie met lucht na 3-6 maanden gebruik. Reactivering wordt noodzakelijk wanneer de alcoholconversiesnelheid in de loop van de tijd afneemt vanwege verontreiniging van de actieve katalytische plaatsen door water, afzettingen van buteenoligomeren en di-sec-butylether. Hogere temperaturen en oxidatie worden gebruikt om deze verontreinigingen te verwijderen.
Commerciële katalysatoren vertonen doorgaans een levensduur van meerdere jaren of langer. Deutsche Texaco heeft een procestechnologie ontwikkeld voor de productie van methylethylketon op basis van de dehydrogenering van watervrije sec-butylalcohol met behulp van een op koper gebaseerde precipitatiekatalysator bij temperaturen van 240-260 °C onder normale druk.
Bij deze technologie wordt sec-butylalcohol geproduceerd door directe hydratatie van n-butenen, gekatalyseerd door een temperatuurgestabiliseerde zure ionenwisselaarhars. Ondanks deze verbeterde heterogene procedure blijft geconcentreerd zwavelzuur wereldwijd de belangrijkste katalysator voor SBA-productie via een indirecte route.
Bij de indirecte route wordt het resulterende intermediaire mono- of di-sec-butylsulfaat uit de eerste reactiestap gehydrolyseerd in een daaropvolgende reactiestap.
De vloeibare sec-butylalcohol wordt verdampt in een verdamper en de resulterende gasvormige alcoholstroom wordt naar een multitube-reactor geleid, waar dehydrogenering plaatsvindt op een koperkatalysator. De gasvormige productstroom verlaat de reactor en wordt, na afkoeling tot omgevingstemperatuur, gescheiden in een vloeibare fase van ruw methylethylketon en een gasvormige waterstoffase.
De vloeibare stroom bevat nog steeds wat niet-omgezet SBA, samen met 5-methyl-3-heptanon, hogere ketonen en water, naast het gewenste methylethylketon. De vorming van 5-methyl-3-heptanon, hogere ketonen en water vindt plaats door autocondensatie van twee of meer methylethylketonmoleculen.
Het 2-butanon wordt gezuiverd door drie opeenvolgende destillatiestappen onder atmosferische druk. In de eerste stap wordt een azeotrope butanon-waterstroom verzameld als een overheadproduct, dat verder wordt gezuiverd in een aparte batchdestillatiekolom.
De tweede kolom levert het gewenste zuivere methylethylketon (meestal met een zuiverheid van meer dan 99%) op, samen met SBA gemengd met hogere ketonen als een bodemproduct. In de laatste destillatiestap wordt het niet-omgezette SBA afgedestilleerd als een overheadproduct en teruggevoerd naar de procestoevoertank. De bodemproducten van deze stap bestaan uit de hogere ketonen die als bijproducten zijn gevormd tijdens het syntheseproces.
3.2. Butanon als bijproduct van het Fischer-Tropsch-kolen-naar-vloeistofproces
In het Fischer-Tropsch-proces vindt een katalytische omzetting van koolmonoxide en waterstof, bekend als synthesegas, plaats om vloeibare koolwaterstoffen te produceren. Dit proces levert een breed scala aan koolwaterstofketenlengtes en een aanzienlijke hoeveelheid verschillende bijproducten op.
Het Fischer-Tropsch-proces, oorspronkelijk ontwikkeld in de jaren 1920 door de Duitse onderzoekers Franz Fischer en Hans Tropsch, wordt sinds 1955 commercieel gebruikt en verder verbeterd door SASOL Ltd., een Zuid-Afrikaans bedrijf, voor de productie van synthetische brandstoffen uit steenkool.
Het proces omvat een techniek in twee stappen. Eerst wordt minerale steenkool vergast om synthesegas te genereren, dat vervolgens grondig wordt gezuiverd door absorptie in scrubbersystemen, waarbij gebruik wordt gemaakt van Rectisol-technologie. Het gezuiverde synthesegas wordt vervolgens katalytisch omgezet in koolwaterstoffen.
Naast de primaire producten zoals olefinen, synthetische brandstof en wassen, wordt een breed scala aan in water oplosbare zuurstofhoudende verbindingen geproduceerd als bijproducten, goed voor ongeveer 3-6% selectiviteit in de waterstroom tijdens de reactie.
Traditionele scheidingstechnologieën worden gebruikt om deze zuurstofhoudende verbindingen, waaronder alcoholen, organische zuren, aldehyden, butanon en andere ketonen, te zuiveren tot hoogwaardige oplosmiddelproducten.
3.3. Productie van butanon door oxidatie van n-butaan in de vloeistoffase
Bij de oxidatie van n-butaan in de vloeistoffase tot azijnzuur is 2-butanon een bijproduct van de reactie. Dit proces omvat de auto-oxidatie of directe oxidatie van n-butaan in de vloeistoffase via een radicale reactieroute.
De initiële oxidatie produceert methylethylketon als een tussenproduct, dat bij verdere oxidatie methylethylketonhydroperoxide vormt. Het methylethylketonhydroperoxide wordt vervolgens gesplitst in twee moleculen, wat resulteert in het gewenste azijnzuur als eindproduct.
Union Carbide Corp. heeft een continu plug-flowproces ontwikkeld dat de gedeeltelijke verzameling van het tussenproduct butanon mogelijk maakt. Dit proces omvat niet-gekatalyseerde oxidatie in de vloeistoffase bij 180 °C en 5,3 MPa, met enige terugmenging. Door dit proces worden zowel methylethylketon als azijnzuur verkregen.
Onder continue oxidatieomstandigheden met plug-flow bij 150 °C, 6,5 MPa en een verblijftijd van 2,7 minuten worden methylethylketon en azijnzuur gevormd in massaverhoudingen tot 3/1.
Celanese Corp. gebruikt azijnzuur als oplosmiddel, met behulp van een homogeen opgelost oxidatiekatalysatorsysteem bestaande uit kobaltacetaat en natriumacetaat. Dit batchproces wordt uitgevoerd bij temperaturen tussen 160 en 165 °C en bij een druk van 5,7 MPa. De resulterende producten zijn butanon en azijnzuur, met een massaverhouding van 0,4/1,0.
3.4. Productie van butanon door oxidatie van sec-butylbenzeen
De SPAM-technologie van Hock Phenol Synthesis Shell, die fenol, aceton en butanon combineert, is gebaseerd op de oxidatie van een mengsel van sec-butylbenzeen en cumeen tot hun respectievelijke hydroperoxideverbindingen. Deze hydroperoxiden worden vervolgens conventioneel gesplitst met behulp van een anorganisch zuur, bij voorkeur zwavelzuur, wat resulteert in een mengsel van fenol, methylethylketon en aceton als de gewenste producten.
In het proces wordt de ruwe ketonstroom gescheiden van fenol door middel van destillatie en vervolgens gezuiverd om de gewenste zuivere ketoncomponenten te verkrijgen. De katalytische splitsing van sec-butylbenzeenhydroperoxide (sBHP) met een anorganisch zuur om fenol en butanon te produceren, is al vele jaren een bekend proces.
Ondanks de industriële betekenis van 2-butanon in vergelijking met aceton, is deze alternatieve route echter niet gecommercialiseerd vanwege een grote uitdaging die zich voordoet tijdens de oxidatiestap. De snelheid van de autokatalytische oxidatie van sec-butylbenzeen is meerdere malen langzamer dan die van cumeen, wat leidt tot ongewenste nevenreacties die de totale opbrengst van de gewenste producten negatief beïnvloeden.
Volgens het onderzoek van Shell wordt de afname van de reactiesnelheid tijdens de oxidatie van sec-butylbenzeen toegeschreven aan de vorming van gesplitste producten die fungeren als radicalenvangers in het reactiemengsel, aanwezig in concentraties van delen per miljoen (ppm). Deze scavengerzuren omvatten mierenzuur, azijnzuur en fenol.
Om de negatieve impact op de reactiesnelheid te overwinnen, zijn de volgende opties voorgesteld:
- Een mengsel van sec-butylbenzeen en cumeen gebruiken om initiële hoeveelheden cumeenhydroperoxide in de eerste reactiestap te vestigen, die als initiator fungeert.
- De vorming van methanol of ethanol als gesplitste producten in recyclestromen verminderen, waardoor de productie van de eerder genoemde scavengerzuren wordt geminimaliseerd.
- Toevoegen van een waterige oplossing van ammoniak tot op zekere hoogte, waardoor de zuren hun ammoniumzouten kunnen vormen, terwijl fasesplitsing wordt vermeden.
3.5. Productie van butanon door directe oxidatie van n-butenen (Hoechst-Wacker-proces)
Het Hoechst-Wacker-proces omvat de directe oxidatie van n-butenen, waarbij zuurstof in een homogene fase wordt overgedragen met behulp van een redoxzoutpaar, PdCl2/2 CuCl. Vervolgens ondergaat het zoutpaar een reoxidatie.
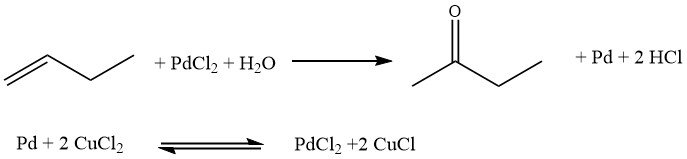
Dit proces heeft echter bepaalde nadelen. Het leidt tot de vorming van gechloreerde butanonen en n-butanal, wat ongewenste bijproducten zijn. Bovendien kunnen er corrosieproblemen ontstaan door de aanwezigheid van vrije zuren.
Bij dit proces wordt zuurstof overgebracht met behulp van een waterige oplossing van palladiumsulfaat en ferrisulfaat. Soortgelijke principes voor zuurstofoverdracht zijn gebruikt in andere processen die zijn ontwikkeld door het Consortium for Electrochemistry en Eastman Kodak.
4. Toepassingen van butanon
Butanon, ook bekend als methylethylketon, is een waardevol oplosmiddel met vergelijkbare eigenschappen als aceton. Het biedt verschillende voordelen in vergelijking met andere oplosmiddelen met vergelijkbare verdampingssnelheden:
- Hoog oplossend vermogen: butanon vertoont een sterk vermogen om verschillende stoffen op te lossen.
- Hoge verhouding van opgeloste materie tot viscositeit: het kan een grote hoeveelheid materiaal oplossen terwijl het een gunstige viscositeit behoudt.
- Mengbaarheid met koolwaterstoffen: butanon kan mengen met talrijke koolwaterstoffen zonder het vastestofgehalte of de viscositeit te beïnvloeden.
- Gunstige volume-tot-massaverhouding: Door de lage dichtheid biedt het een gunstige balans tussen volume en massa.
2-Butanon heeft het vermogen om een breed scala aan natuurlijke stoffen, kunststoffen en harsen op te lossen, waaronder colofonium, esterharsen, nitrocellulose, cellulosederivaten (zoals celluloseacetaat en celluloseacetobutyraat), epoxyharsen, alkydharsen, fenolharsen, vinylacetaatpolymeren en vele anderen.
Het kan echter cellulosetriacetaat, hoogmoleculair celluloseacetaat, poly(vinylchloride), poly(vinylbutyral), polysulfiderubber en schellak slechts gedeeltelijk oplossen.
Het oplosmiddel vindt toepassingen in verschillende industrieën zoals de productie van verf, lak en vernis, evenals in verfverdunners, kleefstoffen, cementen, kitten, magneetbanden, kunstleer, transparant papier, drukinkten, reinigingsmiddelen voor elektronische apparatuur, cosmetica, farmaceutica, ontvetten van metalen oppervlakken en extractieprocessen.
Butanon wordt ook gebruikt als synthetische smaakstof in voedingsmiddelen en farmaceutica, als sterilisator voor chirurgische instrumenten en tandheelkundige apparatuur en bij de productie van rookloos poeder.
Hoewel het voornamelijk als oplosmiddel wordt gebruikt, is butanon van beperkt belang als chemische grondstof. Het kan echter verschillende reacties ondergaan, zoals condensatie met formaldehyde om methylisopropenylketon te produceren, autocondensatie om ethylamylketon te vormen en gemengde condensatie met aceton om methylamylketon te verkrijgen.
Methylethylketon wordt gebruikt bij de productie van parfums, antioxidanten, katalysatoren, peroxiden en diacetalen. Methylethylketoxime wordt in een kleine toepassing gebruikt als anti-huidmiddel in lakken.
Bovendien dient butanonperoxide als polymerisatie-initiator voor onverzadigde polyesters.
In de parfumindustrie reageert 2-butanon met citral om geurcomponenten zoals methylpseudoionon te produceren. Bovendien is het sinds 1962 goedgekeurd als alcoholdenatureermiddel in de Bondsrepubliek Duitsland (zoals bepaald door de Bundesmonopolverwaltung in Offenbach).
Referentie
- 2-Butanone, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_475.pub2
