Benzoëzuur: productie, reacties en toepassingen
Wat is benzoëzuur?
Benzoëzuur is een witte kristallijne vaste organische verbinding met de chemische formule C6H5COOH. De naam “benzoëzuur” is afgeleid van gombenzoë, een harsachtige substantie die wordt verkregen uit de styraxplant die inheems is in Zuid-Azië.
Benzoëzuur komt van nature voor in sommige soorten fruit en groenten, zoals veenbessen, pruimen, pruimen, appels, kaneel en kruidnagel. Het werd voor het eerst geëxtraheerd door SCHEELE in 1775 en de chemische structuur werd vervolgens opgehelderd door LIEBIG en W€OHLER in 1832.
De eerste methoden voor het produceren van benzoëzuur werden ontwikkeld in de late jaren 1800, waarbij gebruik werd gemaakt van de hydrolyse van benzotrichloride of de decarboxylering van ftalaatzuuranhydride.
De meest gebruikte methode voor de productie van benzoëzuur is momenteel de oxidatie van tolueen met lucht. Dit proces heeft de eerdere oxidatietechnieken met dichromaat en salpeterzuur vervangen.
Inhoudsopgave
1. Productie van benzoëzuur
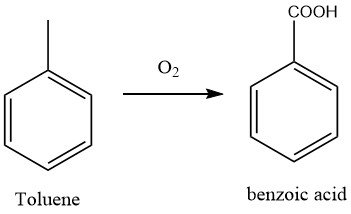
De vloeibare fase oxidatie van tolueen met moleculaire zuurstof werd ontwikkeld tijdens de Tweede Wereldoorlog door I.G. Farbenindustrie in Duitsland. De fabriek gebruikte een bubble-column oxidatiereactor gemaakt van aluminium bekleed staal, met een luchtinlaatbuis, een separator en een absorber voor tolueenwinning.
De reactie werd gekatalyseerd met kobaltnaftenaat (0,1%) en de reactor was uitgerust met warmtewisselaars om de warmte die tijdens de reactie werd gegenereerd, af te voeren. De reactie werd uitgevoerd bij 140 °C en ca. 0,2 MPa gedurende 30 uur, wat resulteerde in een tolueenconversie van 50%, waarvan 80% werd omgezet in benzoëzuur.
De aanwezigheid van zwavelverbindingen, stikstofverbindingen, fenolen en olefinen als onzuiverheden was cruciaal, omdat ze de oxidatiereactie remden. Andere in olie oplosbare kobaltzouten werden ook gebruikt als katalysatoren.
Na de oxidatiereactie werd het ruwe product geneutraliseerd met natriumcarbonaat om natriumbenzoaat te verkrijgen en werd het niet-gereageerde tolueen teruggewonnen door destillatie. Het oxidatieproces was een vrije-radicalenketenproces en peroxiden waren reactie-intermediairen.
Hoewel kobalt en mangaan zich op vergelijkbare wijze gedroegen als katalysatoren, had koper een negatief effect op de reactie. Hoge druk vertraagde de reactie ook, vooral bij lagere katalysatorconcentraties. Bij temperaturen boven 130 °C werd de reactiesnelheid bepaald door zuurstofdiffusie en verzamelden fenolische verbindingen zich geleidelijk tijdens de reactie, waardoor deze uiteindelijk werd geremd.
In moderne processen wordt de oxidatie uitgevoerd bij 165 °C en 0,9 MPa en wordt de reactiewarmte verwijderd door externe circulatie van de inhoud van de reactor.
De druk van de vloeistof die uit de reactor wordt afgevoerd, wordt verlaagd tot atmosferisch en niet-gereageerd tolueen wordt teruggewonnen.
Benzoëzuur wordt gezuiverd door rectificatie en het bodemresidu wordt geëxtraheerd om de kobaltkatalysator terug te winnen. Het uitlaatgas wordt gekoeld om het grootste deel van het tolueen terug te winnen, gezuiverd en geventileerd.
De oxidatiereactor kan een bellenkolom of een geroerde tank zijn, met roestvrij staal als het voorkeursconstructiemateriaal.
Het product is verontreinigd met kleine hoeveelheden ftaalzuur, koolmonoxide en kooldioxide in het uitlaatgas, en de opbrengst van benzoëzuur varieert met de omzetting van tolueen, met een selectiviteit voor benzaldehyde en benzylalcohol die 10% overschrijdt bij lagere omzettingen.
Om producten van hogere kwaliteit te produceren, zijn verdere verwerkingen zoals sublimatie, herkristallisatie en neutralisatie noodzakelijk.
Methylbifenylen zijn verantwoordelijk voor de geur van het product, en voor hun verwijdering, extractie en behandeling in een inerte gasstroom zijn voorgesteld.
De katalytische oxidatie van alkylaromatische koolwaterstoffen kan worden verbeterd door broomverbindingen toe te voegen aan de kobaltkatalysator in azijnzuur.
Deze methode wordt nu veel gebruikt bij de productie van tereftaalzuur en is ook toepasbaar op het benzoëzuurproces.
Een ander type kobaltkatalysatoractivator is een gemakkelijk oxideerbare carbonylverbinding zoals methylethylketon of acetaldehyde. Deze additieven zorgen voor een aanzienlijke verlaging van de reactietemperatuur, maar vanwege hun hoge verbruik lijkt de technologie niet praktisch.
Dampfaseoxidatie van tolueen bij hogere temperaturen is een ander potentieel proces, waarbij verschillende katalysatoren worden gebruikt zoals vanadium, wolfraam, uranium, molybdeen en zilver. De opbrengsten waren echter niet vergelijkbaar met die van het vloeistoffaseproces.
2. Chemische reacties van benzoëzuur
De stabiliteit van benzoëzuur ten opzichte van veelvoorkomende oxidatiemiddelen zoals lucht, permanganaat, chroomzuur, hypochloriet en verdund salpeterzuur is goed gedocumenteerd.
Bij temperaturen boven de 220 °C reageert benzoëzuur met koper(II)zouten om fenol en zijn derivaten te produceren. Deze reactie, die wordt gevolgd door koper(II)regeneratie op basis van moleculaire zuurstof, is de basis voor de industriële productie van fenol uit benzoëzuur.
Onder vergelijkbare omstandigheden reageert benzoëzuur met ammoniak om aniline te produceren.
Bij verhitting tot 150 °C treedt dehydratie op, wat resulteert in de vorming van benzoëzuuranhydride.
Bij verhitting boven 370 °C of zo laag als 245 °C in aanwezigheid van katalysatoren treedt decarboxylatie op, wat leidt tot de vorming van benzeen en een kleine hoeveelheid fenol. Het gebruik van koper- en cadmiumpoeder katalyseert het decarboxyleringsproces.
Wanneer kaliumbenzoaat reageert met koolstofdioxide, disproportioneert het tot tereftalaat en benzeen, met behulp van cadmium- en zinkzouten als katalysatoren.
Gefuseerde kaliumhydroxide blijkt benzoëzuur om te zetten in hydroxybenzoëzuren.
Benzoëzuur kan direct worden gehydrogeneerd met behulp van moleculaire waterstof, wat resulteert in de productie van benzaldehyde in een kwantitatieve opbrengst. De reactie wordt gekatalyseerd door zirkonium en andere metaaloxiden.
Hydrogenering op edelmetaalkatalysatoren leidt tot de vorming van cyclohexaancarbonzuur (hexahydrobenzoëzuur).
Bovendien levert chlorering 3-chloorbenzoëzuur op, nitrering vormt 3-nitrobenzoëzuur en sulfonering vormt 3-sulfobenzoëzuur.
3. Toepassingen van benzoëzuur
Het overgrote deel van het benzoëzuur wordt intern verbruikt voor de productie van fenol, met slechts een kleine hoeveelheid die op de open markt komt.
In het jaar 2006 was het gebruik van natrium- en kaliumbenzoaat als conserveermiddelen goed voor 41% van de wereldwijde consumptie van benzoëzuur.
Benzoëzuur wordt ook gebruikt bij de productie van benzoaatweekmakers, alkydharsen en benzylchloride.
Glycolesters afgeleid van benzoëzuur worden gebruikt als weekmakers in vinylharsen, met een toegenomen vraag in de VS vanwege hun vervanging van butylbenzylftalaat in poly(vinylacetaat) emulsielijmen.
Natriumbenzoaat is een belangrijke markt voor conserveermiddelen en anticorrosieve middelen.
Benzoëzuur vindt toepassing in gemodificeerde alkydharsen voor het verbeteren van de oppervlakte-eigenschappen van autolaklakken.
Bovendien wordt het gebruikt als tussenproduct voor de productie van parfums, farmaceutische producten en cosmetica.
Referentie
- “Benzoic Acid and Derivatives”, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_555
