1-Butanol: Eigenschappen, Reacties, Productie en Toepassingen
Wat is 1-butanol?
Butanol, ook bekend als n-butanol of butan-1-ol, is een primaire alcohol met de chemische formule C4H9OH. Het is een kleurloze vloeistof met een sterke, onaangename geur, vergelijkbaar met die van verbrande whisky.
Butanol bestaat van nature in gebonden vormen en geconcentreerd in fermentatie-afgeleide fusel-oliën. De industriële productie begon in 1912 met de ontdekking van Clostridium acetobutylicum Weizmann, een bacterie die koolhydraten omvormt tot voornamelijk aceton en 1-butanol.
De toenemende vraag naar 1-butanol stimuleerde de ontwikkeling van nieuwe productiemethoden, waaronder:
- Hydrogenering van crotonaldehyde: gevormd via aceetaldehyde aldolisatie.
- Reppe-synthese (propeencarbonylering).
- Hydrogenering van n-butyraldehyde: eenvoudig verkregen door propeenhydroformylering, wat momenteel de dominante methode is.
Inhoudsopgave
1. Fysieke eigenschappen van 1-butanol
n-butanol is een kleurloze vloeistof met een karakteristieke geur. De dampen irriteren de slijmvliezen en worden bij hoge concentraties narcotisch. Het is volledig mengbaar met gangbare organische oplosmiddelen.
Tabel 1 bevat de belangrijkste karakteristieke fysische eigenschappen van n-butanol.
| Eigenschap | Waarde |
|---|---|
| Molaire massa | 74,12 g/mol |
| Smeltpunt | -89,3 °C |
| Kookpunt | 117,7 °C |
| Dichtheid (20 °C) | 0,8098 g/cm³ |
| Breukindex (20°C) | 1,3991 |
| Viscositeit (20°C) | 3,0 mPa·s |
| Soortelijke warmte (30–80°C) | 2,437 J g⁻¹ K⁻¹ |
| Verdampingswarmte | 591,64 J/g |
| Smeltwarmte | 125,2 J/g |
| Verbrandingswarmte | 36,111 kJ/g |
| Kritische druk | 44,2 hPa |
| Kritische temperatuur | 289 °C |
| Oppervlaktespanning (kamertemperatuur) | 22,3 mN/m |
| Diëlektrische constante (kamertemperatuur) | 17,8 |
| Verdampingsgetal (ether = 1) | 33 |
| Oplosbaarheid in water (20 °C, wt%) | 7,7 wt% |
| Oplosbaarheid in water (30°C, wt%) | 7,08 wt% |
| Oplosbaarheid van water in 1-butanol (20°C, wt%) | 20 wt% |
| Oplosbaarheid van water in 1-butanol (30°C, wt%) | 20,62 wt% |
| Vlampunt | 34 °C |
| Ontstekingsgrenzen in lucht, vol% | 1,4–11,3 |
| Ontstekingstemperatuur | 380 °C |
2. Chemische eigenschappen van 1-butanol
Als primaire alcohol is 1-butanol een reactieve chemische stof die dient als startmateriaal voor een breed scala aan reacties.
2.1. Dehydratie van 1-butanol
1-butanol kan worden gedehydrateerd tot een mengsel van butenen (1-buteen, cis-2-buteen en trans-2-buteen) met behulp van katalysatoren zoals γ-Al2O3 bij hoge temperaturen (300-350 °C). Bij lagere temperaturen en in aanwezigheid van dehydratiekatalysatoren wordt dibutylether geproduceerd.

2.2. Oxidatie van 1-butanol
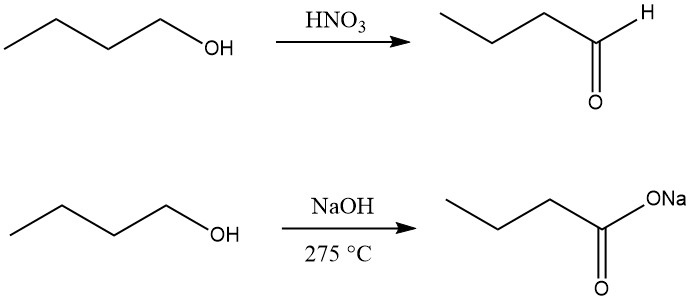
1-butanol kan worden gedehydrogeneerd tot 1-butanal (butanal) met behulp van oxidatiemiddelen zoals mangaan(IV)oxide in zwavelzuur, salpeterzuur, chroomzuur of seleniumdioxide bij lage temperatuur of met alleen geschikte katalysatoren bij hoge temperaturen.
Oxidatie van n-butanol tot carbonzuur kan worden bereikt door reactie met natriumhydroxide bij 275 °C, waarbij het natriumzout van boterzuur wordt gevormd samen met waterstof en 2-ethylhexanol.
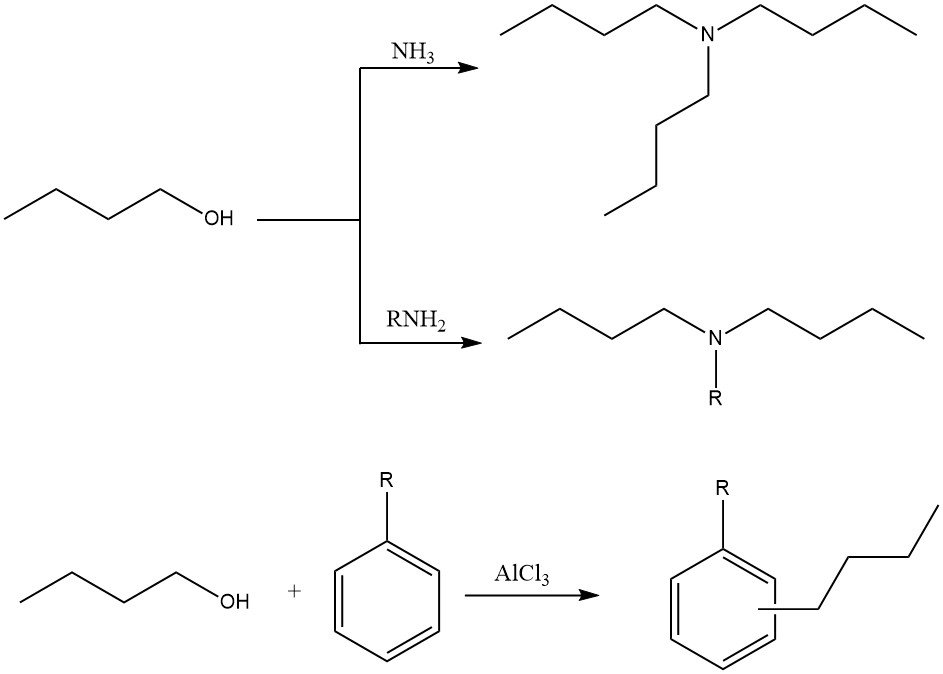
2.3. Alkylering
1-Butanol kan worden gebruikt in verschillende alkyleringsreacties om N-alkyl-, N,N-dialkyl-, of N,N,N-trialkylamines te produceren met ammoniak en aminen. Het kan ook worden gebruikt in ringalkylering van aromatische koolwaterstoffen met Friedel-Crafts-katalysatoren.
2.4. Verestering van 1-butanol
1-butanol reageert met anorganische en organische zuren om butylesters te vormen, meestal gekatalyseerd door zuren. Het kan ook esters produceren met zuurchloriden en zuuranhydriden.
3. Productie van 1-butanol
Van de verschillende routes om 1-butanol te produceren, domineren de volgende drie de industrie:
- Propeenhydroformylering (oxosynthese)
- Reppe-synthese
- Hydrogenering van crotonaldehyde
3.1. Productie van 1-butanol door oxosynthese
De primaire methode die wordt gebruikt bij de productie van 1-butanol is de hydroformylering van propeen, gevolgd door hydrogenering van de resulterende aldehyden. Bij de hydroformylering worden koolmonoxide en waterstof toegevoegd aan de dubbele binding van propeen in de vloeibare fase met behulp van katalysatoren zoals hydrocarbonylen of gesubstitueerde hydrocarbonylen van Co, Rh of Ru.
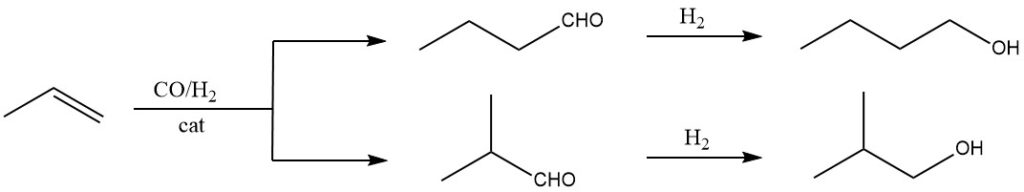
Deze eerste stap levert aldehyden op met één extra C-atoom vergeleken met de oorspronkelijke olefinen. Isomere mengsels van aldehyden worden doorgaans verkregen, zoals 1-butanal en 2-methylpropanal in het geval van propeen.
Er bestaan verschillende hydroformyleringsprocessen met verschillende reactieomstandigheden (druk, temperatuur) en katalysatorsystemen.
De traditionele hogedrukmethode, die tot begin jaren 70 bestond, werkt bij een druk van 20–30 × 106 Pa CO/H2 en temperaturen van 100–180 °C, waarbij Co als katalysator wordt gebruikt. Dit proces levert ongeveer 75% 1-butanol en 25% 2-methyl-1-propanol op.
Recente ontwikkelingen hebben geleid tot nieuwe procesvariaties. Methoden met lagere druk (1–5 × 106 Pa) met gemodificeerde Rh-katalysatoren resulteren in isomere verhoudingen van ongeveer 92:8 of 95:5 voor 1-butanol tot 2-methyl-1-propanol. Het gebruik van ongemodificeerde Rh kan echter het percentage 2-methyl-1-propanol verhogen tot ongeveer 50%.
De katalytische hydrogenering van aldehyden is de volgende stap, die leidt tot de vorming van de overeenkomstige alcoholen. In 2010 waren BASF, Oxea Group en de Dow Chemical Company belangrijke producenten van butanol.
3.2. Productie van 1-butanol door Reppe-proces
Een alternatieve methode voor de productie van 1-butanol is de carbonylering van propeen, een techniek die in 1942 door REPPE is uitgevonden. In dit proces ondergaan olefinen, koolmonoxide en water een reactie onder druk in aanwezigheid van een katalysator zoals het tertiaire ammoniumzout van polynucleaire ijzercarbonylhydriden.

Dit proces gebruikt andere reactieomstandigheden dan conventionele co-gekatalyseerde hydroformylering. Bij een lagere temperatuur (ongeveer 100 °C) en verlaagde druk (0,5–2 × 106 Pa) wordt butanol direct gevormd uit propeen.
Net als bij de oxosynthese kan koolmonoxide worden toegevoegd aan beide C-atomen van de dubbele binding. Wanneer propeen als uitgangsmateriaal wordt gebruikt, worden 1-butanol en 2-methyl-1-propanol verkregen in een verhouding van 86:14.
De gebruikte katalysator, carbonyltriferraat, is gevoelig voor zowel lucht als verhoogde temperaturen. In aanwezigheid van water en CO2 ontleedt het tot ijzercarbonaat.
Om voldoende reactiesnelheden te behouden, moet de katalysator aanwezig zijn in concentraties van ongeveer 10% in de reactieoplossing, een conditie die wordt bereikt door het gebruik van oplosmiddelen zoals N-alkylpyrrolidine.
Ondanks gunstige n-iso-verhoudingen in de resulterende producten en mildere reactieomstandigheden, heeft het Reppe-proces niet hetzelfde succesniveau bereikt als propeenhydroformylering met Co-katalysatoren vanwege de hogere kosten van de betrokken procestechnologie.
3.3. Productie van 1-butanol door hydrogenering van crotonaldehyde
Tot het midden van de 20e eeuw was de productie van 1-butanol uit crotonaldehyde de voorkeursmethode, maar deze heeft zijn belang verloren door de ontwikkeling van meer concurrerende processen.

Dit proces omvatte reacties in meerdere stappen, als volgt:
- Aldolcondensatie: Acetaldehyde ondergaat aldolcondensatie bij omgevingstemperatuur en -druk, wat acetaldol oplevert met ~95% selectiviteit en ~60% conversie. Niet-gereageerde acetaldehyde kan worden teruggewonnen voor verder gebruik.
- Dehydratie: Verzuring van acetaldol met azijnzuur of fosforzuur bevordert de eliminatie van water en de vorming van crotonaldehyde. Deze stap bereikt een bijna kwantitatieve opbrengst van crotonaldehyde als primair destillaat.
- Hydrogenering: Verschillende gas- en vloeistoffaseprocessen gebruiken koperkatalysatoren voor de efficiënte hydrogenering van crotonaldehyde tot 1-butanol. Een opbrengst van ~1000 kg 1-butanol per 1350 kg acetaldehyde is haalbaar.
De economische levensvatbaarheid van deze route hangt af van de kosten van de grondstoffen. Omdat ruwe olie, de primaire grondstof voor de oxosynthese, schaars en duur wordt, kan ethanol afkomstig van fermentatie een concurrerend alternatief worden.
De overvloed en betaalbaarheid van biomassa in tropische landen en ontwikkelingslanden zonder oliereserves maken deze route bijzonder aantrekkelijk. Ethanol kan worden gedehydrogeneerd tot acetaldehyde, wat dient als het uitgangsmateriaal voor dit proces.
3.4. Productie van 1-butanol door fermentatie van biomassa
De productie van 1-butanol via biomassafermentatie was een prominent industrieel proces dat de 20e eeuw domineerde. Beginnend met Chaim Weizmann’s isolatie van Clostridium acetobutylicum in 1914, werd de zogenaamde ABE-fermentatie (aceton, butanol, ethanol) het op één na grootste biotechnologische proces, alleen overtroffen door ethanolfermentatie.
Andere butanolproducerende Clostridium-stammen, zoals C. beijerinckii en C. saccharoperbutylacetonicum, ontstonden ook en werden gebruikt.
De klassieke ABE-fermentatie maakte gebruik van een batchproces dat 40-60 uur duurde, waarbij zetmeelhoudende biomassa zoals maïsmeel of melasse als substraten werd gebruikt. Producten werden gewonnen en gefractioneerd door destillatie, wat een totale opbrengst opleverde van 25-33 kg/100 kg substraat.
Oplosmiddelconcentraties bereikten 12-20 g/l, met een maximale butanolconcentratie van 14 g/l. Lage ruwe olieprijzen en hoge substraatkosten leidden eind 20e eeuw echter tot de teloorgang van industriële ABE-fermentatie, waarbij de laatste fabrieken in Zuid-Afrika en China in 2004 sloten.
Toenemende interesse in biobrandstoffen en chemicaliën zorgde echter voor een commerciële interesse in ABE-fermentatie, met name voor butanol. Nieuwe fermentatiefabrieken zijn in Brazilië en China ontstaan, terwijl bedrijven als Gevo en Butamax actief onderzoek doen naar butanolproductie uit hernieuwbare grondstoffen.
Onderzoeksinspanningen richten zich op het maximaliseren van de butanolopbrengst als het enige fermentatieproduct, het verbeteren van de butanoltolerantie van het producerende organisme en het verkennen van alternatieve, niet-voedselsubstraten zoals cellulose en hemicellulose.
Theoretisch gezien kan C. acetobutylicum 0,41 g butanol per gram glucose genereren op basis van zijn fermentatiepaden. Onderzoekers onderzoeken verbeterde stammen en groeiomstandigheden om de butanol/aceton-verhouding te verhogen, waarbij ze metabolische engineering en genoverdracht gebruiken om de butanolproductie in andere organismen zoals E. coli te verbeteren.
Bovendien omvat het overwinnen van de lage butanoltolerantie van C. acetobutylicum stamselectie en fermentatiemodificaties zoals gasstripping of absorptie.
Het eerdere succes en de recente opleving van ABE-fermentatie benadrukken het potentieel voor duurzame butanolproductie. Doorlopend onderzoek om opbrengsten, tolerantie en substraatgebruik te optimaliseren, baant de weg voor een vernieuwde biobased butanolindustrie.
4. Toepassingen van 1-butanol
In de VS wordt ~85% van 1-butanol primair gebruikt in oppervlaktecoatings. Het dient direct als oplosmiddel voor lakken of wordt omgezet in afgeleide oplosmiddelen of monomeren. Het wordt gemengd met tolueen, ethanol of specifieke esters voor de productie van nitrocelluloselakken en alleen gebruikt als verdunner.
1-Butanol wordt toegevoegd in een concentratie van 5-10% om “blozen” (ongewenste witte opaciteit) te voorkomen die wordt veroorzaakt door verdunners, met name vluchtige.
Het helpt de viscositeit te reguleren en verbetert de vloei-eigenschappen van lakken, en vermindert strepen in in alcohol oplosbare gom/harsverven en -lakken.
1-Butanol wordt gebruikt als een mengsel van maximaal 20% om gangbare oplosmiddelen (voornamelijk verzadigde carbonzuuresters, met name acetaten) te verdunnen voor polystyreen en gechloreerd rubber.
1-Butanol acryl ester is een belangrijk onderdeel van latexverven dat sinds de jaren 90 aan belang heeft gewonnen vanwege de duurzaamheid en kosteneffectiviteit.
Butyl esters van ftaalzuur, adipinezuur, sebacinezuur, oliezuur, azelaïnezuur, stearinezuur en fosforzuur dienen als weekmakers en additieven in oppervlaktecoatings, waarbij di-1-butylftalaat (DBP) de belangrijkste is. Het DBP-verbruik is echter sinds 2000 in sommige landen gestagneerd of licht gedaald.
1-Butanol wordt gebruikt bij de productie van butylamines, met name in de VS, Duitsland en België. Het fungeert ook als een coagulatiebad voor het spinnen van acrylvezels en bij het verven van poly(vinylalcohol)vezels.
5. Toxicologie van 1-butanol
Acute toxiciteit:
- 1-butanol vertoont matige toxiciteit, waarbij de laagste gerapporteerde dodelijke doses 790 mg/kg (oraal, rat) en 3400 mg/kg (dermaal, konijn) zijn.
- Inademing van hoge concentraties kan irritatie van de luchtwegen en ogen, coördinatiestoornissen en narcose veroorzaken. De laagste gepubliceerde dodelijke concentratie is 24,3 mg/l (ratten, ingeademd, 4 uur).
- Direct oogcontact met 1-butanol veroorzaakt ernstige irritatie van het hoornvlies.
- Huidirritatie is licht tot matig bij konijnen.
- Genetische tests (Ames-test) duiden op niet-mutagene eigenschappen.
Chronische effecten:
- Beroepsmatige blootstelling aan 1-butanoldampen bij 200 ppm en hoger is in verband gebracht met hoornvliesontsteking, branderig gevoel, wazig zicht en gehoorverlies.
- Herhaalde blootstelling bij 100 ppm kan milde oogirritatie veroorzaken.
- Lagere concentraties (25 ppm) veroorzaken bij sommige personen lichte irritatie en hoofdpijn.
- Dermatitis van de vingers en handen kan optreden bij direct huidcontact.
Blootstellingslimieten:
- Drempelwaarde (TLV) plafondlimiet: 50 ppm (huid) [ACGIH]
- Maximum Toegestane Concentratie (MAK-waarde): 100 ml/m³ [Duitse Commissie voor de Bepaling van Gevaarlijke Stoffen]
- TRGS 900-waarde: 100 ml/m³ [Duitse Technische Regels voor Gevaarlijke Stoffen]
Referenties
- Butanolen; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_463.pub3
- Butylalcoholen; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0221202502091212.a01.pub2
