Metodi di produzione dell’idrazina
La maggior parte dei potenziali percorsi per ottenere idrazina sono limitati a causa della disponibilità di materie prime e dei costi di produzione. Azoto e ammoniaca si distinguono come gli unici materiali di partenza praticabili per un processo più semplice.
Una valutazione della variazione di energia libera standard ΔF°(g) (298 K) all’interno del sistema gassoso H2-N2-NH3-N2H4 indica che la sintesi diretta di idrazina da azoto e idrogeno è energeticamente sfavorevole. L’energia libera di formazione favorisce fortemente la produzione di ammoniaca.
Nonostante gli sforzi in corso, attualmente non esiste una soluzione pratica o conveniente per ridurre selettivamente l’azoto. Pertanto, l’ammoniaca rimane l’unica fonte di azoto preziosa per la produzione di idrazina.
Sulla carta, l’accoppiamento di due molecole di ammoniaca con la produzione simultanea di idrogeno sembra essere un processo allettante. Tuttavia, è sia endotermico che altamente inefficiente.
Ad esempio, vari metodi come la scarica elettrica, la fotolisi o la radiolisi utilizzati per decomporre l’ammoniaca producono solo piccole quantità di idrazina. Un approccio alternativo è l’ossidazione degli atomi di idrogeno separati dall’ammoniaca.
In un contesto industriale, solo tre ossidanti sono significativi: cloro, ossigeno e perossido di idrogeno.
Un’ulteriore sfida deriva dal fatto che l’idrazina, un agente riducente molto più forte dell’ammoniaca, può anche reagire con l’agente ossidante.
Il cloro è stato ampiamente utilizzato nel processo Raschig, che è ancora in funzione. Per impedire un’ulteriore ossidazione dell’idrazina da parte del cloro, devono essere utilizzate condizioni altamente diluite, con conseguenti rese non superiori al 60%.
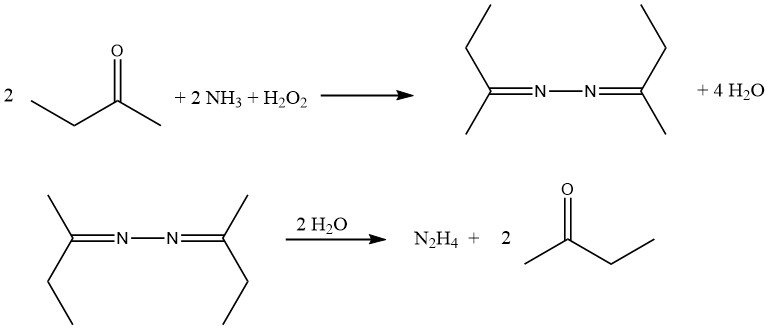
L’idrolisi delle azine derivate da acetone e butanone sotto pressione offre un mezzo per produrre idrazina rigenerando il chetone.
Bayer ha notevolmente migliorato le rese introducendo l’acetone nel processo Raschig.
Negli anni ’70, PCUK (ora Atochem) ha sviluppato un nuovo processo efficiente ed ecologico basato sull’ossidazione dell’ammoniaca da parte del perossido di idrogeno in presenza di un chetone. Attualmente, la maggior parte dell’idrazina viene prodotta attraverso il processo della chetozina, che prevede l’ossidazione dell’ammoniaca con cloro o perossido di idrogeno.
Sommario
1. Processo Raschig
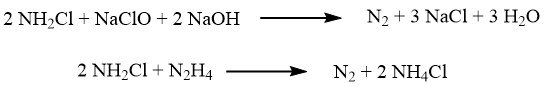
Nel processo Raschig, l’ossidazione dell’ammoniaca viene ottenuta utilizzando ipoclorito di sodio, che si ottiene facendo reagire il cloro con l’idrossido di sodio.
L’ossidazione avviene in due fasi. Nella prima fase, eseguita a circa 5 °C, una reazione rapida forma cloramina:
Successivamente, la miscela di reazione viene combinata con un eccesso significativo di ammoniaca (con un rapporto di 40:1), e la lenta reazione che porta all’idrazina avviene a temperature comprese tra 130 e 150 °C, sotto una pressione di 3,0 MPa:
Possono verificarsi diverse reazioni collaterali degne di nota, tra cui:
All’uscita dal reattore, la soluzione di reazione contiene circa l’1% di idrato di idrazina e circa il 4% di cloruro di sodio. La pressione viene quindi ridotta a livelli atmosferici utilizzando una serie di evaporatori.
L’ammoniaca viene condensata, concentrata e riciclata. La soluzione raccolta sul fondo delle colonne di stripping subisce la rimozione del sale in un evaporatore di salatura a circolazione forzata convenzionale. Il distillato risultante viene ulteriormente concentrato per ottenere il 100% di idrato di idrazina.
Per ottenere rese ragionevoli in questo processo, è importante utilizzare soluzioni diluite e mantenere un elevato rapporto tra ammoniaca e ipoclorito. Tuttavia, i costi associati all’evaporazione rimangono elevati, anche con potenziali risparmi di vapore.
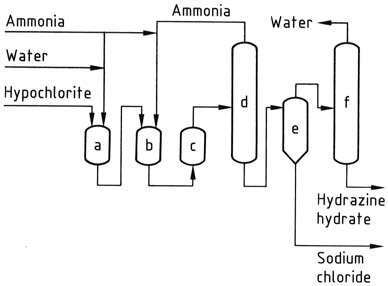
a) Reattore di cloramina; b), c) Reattori di idrazina; d) Evaporatore di ammoniaca; e) Separatore idrazina – cloruro di sodio; f) Concentratore di idrato di idrazina
2. Processo Olin Raschig
Nel processo Olin Raschig, per la produzione di idrazina anidra in applicazioni aerospaziali, viene esercitato un controllo preciso sulla generazione di ipoclorito di sodio. Viene impiegata una bassa temperatura per prevenire la decomposizione e la formazione di clorato, mantenendo al contempo un eccesso minimo di idrossido di sodio.
La soluzione di ipoclorito di sodio viene combinata con una quantità di ammoniaca tre volte superiore a 5 °C per creare cloramina. Questa cloramina viene quindi rapidamente introdotta in un eccesso di ammoniaca anidra 30 volte superiore sotto pressione (20-30 MPa) e riscaldata a 130 °C.
La miscela di reazione risultante, contenente l’1-2% di idrato di idrazina, subisce un trattamento simile al processo Raschig convenzionale per ottenere l’idrato di idrazina. L’idrazina anidra si ottiene eliminando l’acqua tramite distillazione azeotropica con anilina in una colonna che opera a pressione atmosferica.
La condensazione del vapore produce un distillato con due strati, in cui la fase acquosa viene rimossa e la fase di anilina viene fatta rifluire verso la parte superiore della colonna. L’idrazina anidra viene recuperata come miscela con anilina, che può quindi essere separata tramite distillazione.
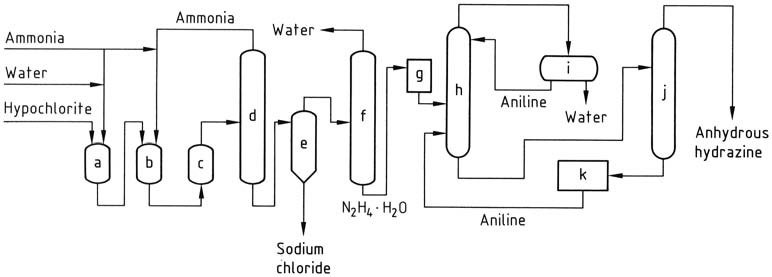
a) Reattore di cloramina; b), c) Reattori di idrazina; d) Evaporatore di ammoniaca; e) Separatore di idrazina – cloruro di sodio; f) Concentrazione di idrato di idrazina; g) Stoccaggio di idrato di idrazina; h) Disidratazione di idrato di idrazina; i) Decantazione di anilina – acqua; j) Distillazione di idrazina anidra; k) Stoccaggio di anilina
3. Processo dell’urea
L’urea può fungere da fonte alternativa di ammoniaca nel processo Raschig. Sebbene non sia attualmente impiegata per la produzione commerciale di idrato di idrazina, questo approccio è stato utilizzato su scala commerciale.
Inizialmente, si è rivelato il metodo più conveniente per volumi di produzione più piccoli. Tuttavia, con l’aumento delle dimensioni degli impianti, il tradizionale processo Raschig è diventato più favorevole, rendendo obsoleto il metodo basato sull’urea.
Dal 1990, in Asia sono state prodotte quantità significative di idrazodicarbonammide utilizzando la miscela di reazione grezza di urea e ipoclorito di sodio come fonte di idrazina.
Tuttavia, questo particolare processo comporta la generazione sostanziale di sottoprodotti e richiede un costoso trattamento degli effluenti. Di conseguenza, è probabile che diventi obsoleto nel tempo.
4. Processo Bayer Ketazine
Il processo Bayer è una versione modificata del processo Raschig che prevede la reazione della cloramina con ammoniaca in presenza di acetone a un intervallo di pH di 12-14:
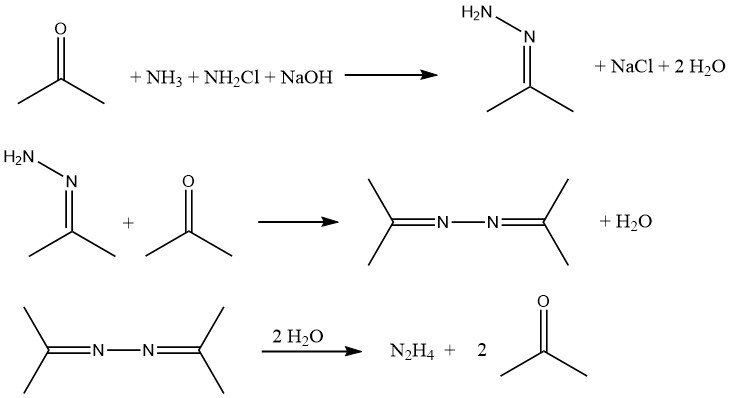
Simultaneamente e ininterrottamente, ipoclorito di sodio, acetone e una soluzione acquosa al 20% di ammoniaca (rispettivamente in un rapporto molare di 1:2:20) vengono introdotti in un reattore a circa 35 °C e 200 kPa.
L’ammoniaca in eccesso viene rimossa dalla miscela di reazione tramite stripping, quindi raffreddata con acqua e riciclata nuovamente nel reattore come soluzione acquosa.
La soluzione acquosa risultante contenente dimetilchetazina, con acetone residuo, cloruro di sodio e impurità organiche, viene immessa in una colonna di distillazione. In questa colonna, la dimetilchetazina viene recuperata come azeotropo acquoso (costituito dal 55% di dimetilchetazina) a pressione atmosferica (punto di ebollizione di 95 °C a 101,3 kPa).
L’introduzione di acetone nella colonna di distillazione ha lo scopo di prevenire l’idrolisi prematura della chetazina. Il sottoprodotto ottenuto dall’alambicco è una soluzione di cloruro di sodio che contiene tracce di idrazina e composti organici. Questa soluzione richiede un trattamento prima dello smaltimento o del riciclaggio per elettrolisi.
Successivamente, la dimetilchetazina subisce idrolisi in una colonna di distillazione pressurizzata (operante a 0,8-1,2 MPa), producendo acetone, che viene riciclato nel reattore, e una soluzione acquosa al 10% di idrazina. La soluzione di idrazina viene quindi concentrata fino a un contenuto di idrazina del 64%.
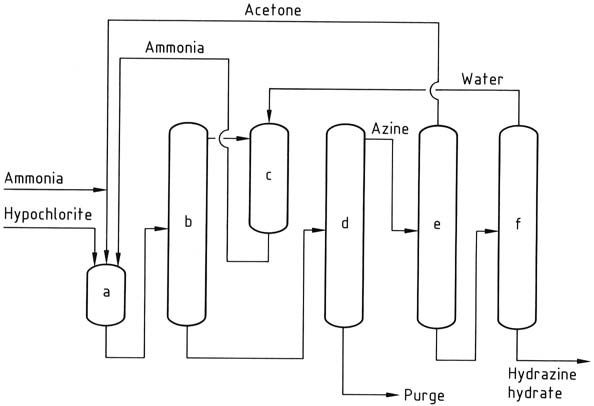
a) Reattore azina; b) Strippaggio dell'ammoniaca; c) Spegnimento dell'ammoniaca; d) Distillazione dell'azina; e) Idrolisi dell'azina; f) Concentrazione dell'idrato di idrazina
5. Processo Fisons
Il processo, inizialmente implementato da Whiffen and Sons, è stato ulteriormente sviluppato da Fisons ed è diventato operativo negli anni ’60. In questo processo, il metil etil chetone è stato impiegato al posto dell’acetone per catturare l’idrazina e la fase di idrolisi ha comportato l’uso di acido solforico.
Tuttavia, questo particolare processo non è più in funzione.
6. Processo al perossido
Il più recente processo all’idrazina, sviluppato da PCUK e attualmente impiegato da ATOFINA in Francia e Mitsubishi Gas in Giappone, utilizza il perossido di idrogeno come agente ossidante. La reazione avviene a pressione atmosferica e 50 °C in presenza di metil etil chetone (MEK), con un rapporto di H2O2:MEK:NH3 di 1:2:4.
Per attivare il perossido di idrogeno, ATOFINA impiega acetamide e fosfato di idrogeno disodico, mentre Mitsubishi Gas utilizza un composto di arsenico. La reazione complessiva porta alla formazione di metil etil chetazina con elevata resa.
Il meccanismo di reazione comporta l’attivazione sia dell’ammoniaca che del perossido di idrogeno poiché questi due reagenti non reagiscono naturalmente tra loro, a differenza dell’ammoniaca e dell’ipoclorito nel processo Bayer. La reazione procede attraverso la formazione di un intermedio di ossaziridina, che è in grado di ossidare l’ammoniaca in un derivato dell’idrazina.
A causa dell’insolubilità della metil etil chetazina nella miscela di reazione, può essere facilmente separata tramite decantazione. La ketazina separata viene quindi purificata tramite distillazione. Sotto pressione (0,8-10 MPa), la ketazina purificata viene idrolizzata, con conseguente idrazina acquosa concentrata e metil etil chetone di testa, che viene riciclato.
Lo strato acquoso contenente l’attivatore viene concentrato per rimuovere l’acqua e successivamente riciclato nei reattori dopo aver eliminato le impurità idrosolubili tramite una purga. Il processo al perossido offre diversi vantaggi rispetto ad altri metodi, tra cui l’assenza di sottoprodotti salini, rese elevate, basso consumo energetico, eccesso molare minimo e nessuna necessità di trattamento degli effluenti acquosi.
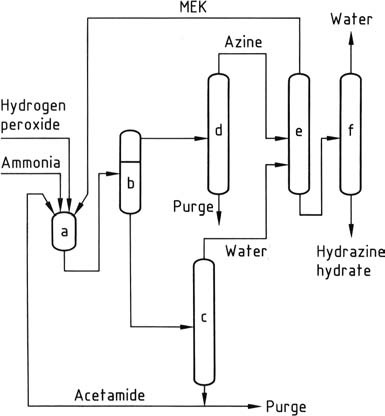
a) Reattore di azina; b) Separatore di fase; c) Concentrazione della fase acquosa; d) Purificazione di azina; e) Idrolisi di azina; f) Concentrazione di idrato di idrazina
Riferimento
- Hydrazine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_177
