Etilammina: proprietà, reazioni, produzione e usi
Cos’è l’etilammina?
L’etilammina, nota anche come etanamina, è un’ammina alifatica primaria con formula chimica C2H5NH2. È un gas infiammabile a temperatura ambiente con un odore simile all’ammoniaca.
L’etilammina si trova naturalmente in frutta e verdura, cereali, caffè, formaggi e frutti di mare. È anche un componente del fumo di tabacco.
Sommario
1. Proprietà fisiche dell’etilammina
L’etilammina è un liquido o gas incolore e infiammabile, a seconda della temperatura ambiente. È una base debole con un odore simile all’ammoniaca, con una soglia di percezione dell’odore compresa tra 0,027 ppm e 3,5 ppm. È miscibile con acqua, etanolo ed etere.
La combustione dell’etilammina produce ossidi di azoto tossici. Commercialmente, l’etilammina viene venduta come soluzione acquosa al 70% o come gas compresso.
Le proprietà fisiche dell’etilammina sono elencate nella seguente tabella:
| Proprietà | Valore |
|---|---|
| Numero CAS | [75-04-7] |
| Formula chimica | C2H5NH2 |
| Massa molecolare | 45,09 g/mol |
| Punto di fusione | -80,6 °C |
| Punto di ebollizione | 16,6 °C |
| Densità a 20 °C | 0,6829 g/cm3 |
| pKb a 25 °C | 3,25 |
| Indice di rifrazione | 1,3663 |
| Densità di vapore | 1,56 |
| Pressione di vapore, a 20 °C | 121 kPa |
| Punto di infiammabilità | -52 °C |
| Temperatura di autoaccensione | 385 °C |
| Calore di combustione a 25 °C (liquido) | -1713,3 kJ/mol |
| Calore di vaporizzazione | 6.845,1 g cal/g.mol |
| Tensione superficiale a 25 °C | 19,20 mN/m |
2. Reazioni dell’etilammina
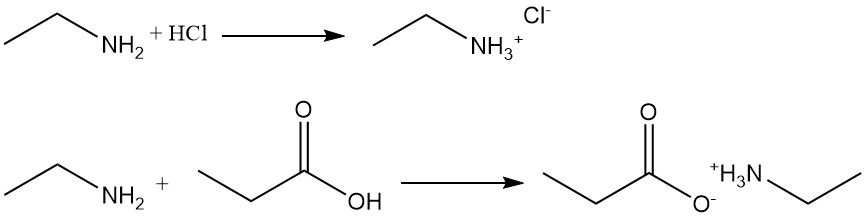
L’etilammina è un’ammina primaria debole che si dissolve in acqua formando una soluzione basica. È una base più forte dell’ammoniaca che reagisce con acidi organici o inorganici formando sali molto solubili in acqua ma insolubili in solventi organici.
Ad esempio, la reazione dell’etilammina con acido cloridrico produce cloruro di etilammonio e con acido propanoico forma propionato di etilammonio.
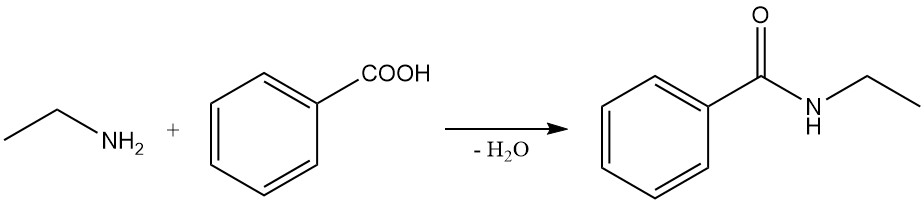
L’etilammina reagisce con acidi carbossilici e i loro esteri, cloruri e anidridi per dare le corrispondenti ammidi. La reazione con i cloruri degli acidi carbossilici è una reazione altamente esotermica che produce ottime rese. La reazione con gli acidi carbossilici forma spesso sale di ammonio, che necessita di riscaldamento per produrre le ammidi.
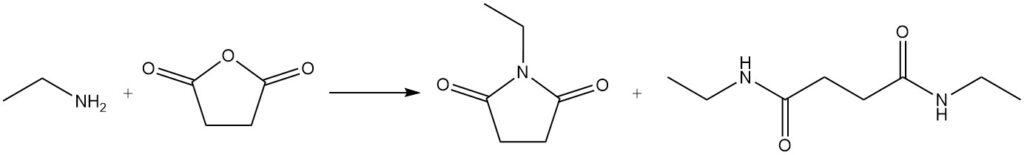
Esempi di queste reazioni includono la reazione di acido benzoico ed etilammina per formare N-etilbenzammide e la reazione di etilammina con anidride succinica per produrre 1-etilpirrolidin-2,5-dione e N1,N4-dietilsuccinammide.
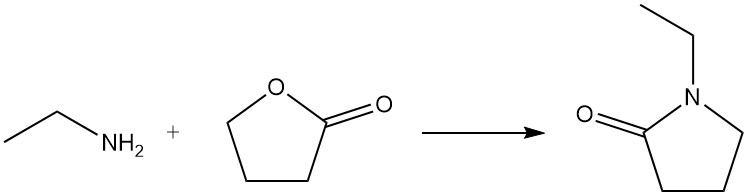
Quando l’etilammina reagisce con un lattone, si forma un lattame; ad esempio, l’1-etil-2-pirrolidone si prepara da etilammina e γ-butirrolattone.
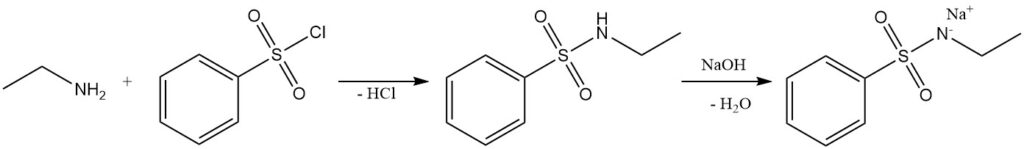
La reazione dell’etilammina con il cloruro di benzenesolfonile (test di Hinsberg) forma l’N-etil benzensolfonammide alcali-solubile.
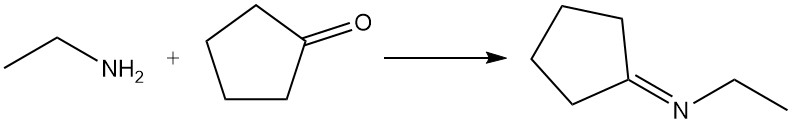
A seconda delle condizioni di reazione, aldeidi e chetoni reagiscono con l’etilammina per formare immine (basi di Schiff) o enammine; questi prodotti possono essere idrogenati per dare ammine più fortemente alchilate. Le aldeidi reagiscono generalmente più rapidamente dei chetoni. Un esempio comune è la reazione di etilammina e ciclopentanone per produrre N-etilciclopentanimmina.
L’etilcicloesilammina, un’importante ammina utilizzata in molti settori industriali, viene prodotta dalla reazione dell’etilammina con il cicloesanone seguita da idrogenazione.
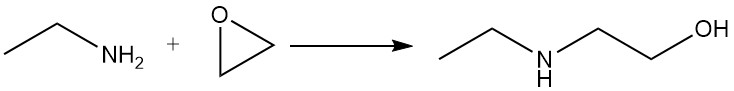
L’etilammina reagisce con gli epossidi per dare una miscela di derivati mono- e diossietilici.
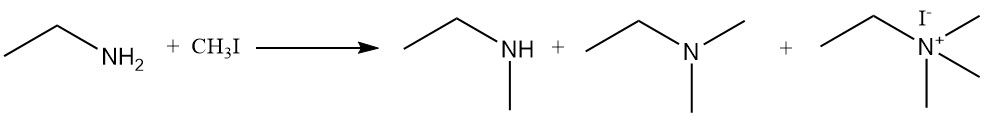
La reazione dell’etilammina con alogenuri alchilici e dialchilsolfati produce una miscela di ammine secondarie e terziarie e composti di ammonio quaternario. Un esempio è la reazione di etilammina e ioduro di metile per formare una miscela di N-metiletanamina, N,N-dimetiletanamina e ioduro di N,N,N-trimetiletilammonio.
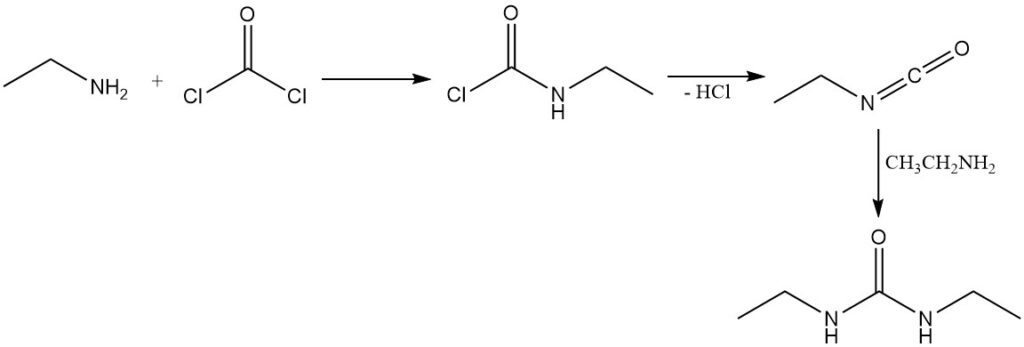
La reazione del fosgene con l’etilammina porta inizialmente alla formazione di cloruro etilcarbammico; la successiva eliminazione dell’acido cloridrico dà isocianatoetano. L’eccesso di etilammina reagisce quindi con l’isocianatoetano per produrre 1,3-dietilurea.
L’etilammina reagisce con il cloroformio in condizioni basiche (idrossido di potassio o idrossido di sodio) per formare etilisonitrile.

L’aggiunta di etilammina all’acrilonitrile forma 3-(etilammino)propanitrile, che può essere facilmente idrogenato nella corrispondente N-etil-1,3-propandiammina.

L’ossidazione dell’etilammina con perossido di idrogeno, utilizzando zeoliti drogate con tungsteno come catalizzatori, produce acetaldeide ossima.
La deidrogenazione dell’etilammina produce acetonitrile.
3. Produzione di etilammina
3.1. Produzione di etilammina da ammoniaca ed etanolo
La reazione catalitica dell’etanolo con ammoniaca è il metodo predominante per la sintesi dell’etilammina. Questo processo genera contemporaneamente dietilammina e trietilammina come sottoprodotti a causa della reattività dell’etilammina con l’etanolo.
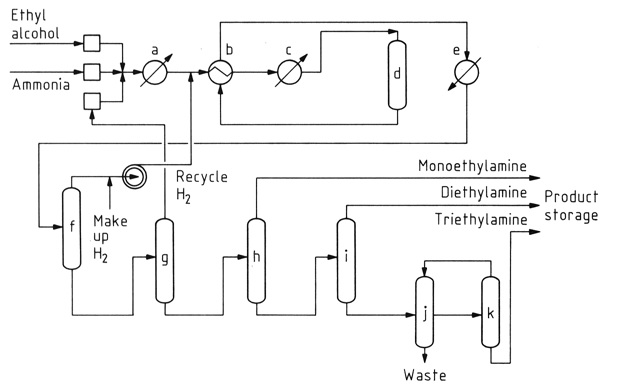
a) Vaporizzatore; b) Scambiatore di calore; c) Surriscaldatore; d) Convertitore catalitico; e) Refrigeratore del prodotto; f) Separatore di gas; g) Colonna di ammoniaca; h) Colonna di monoetilammina; i) Colonna di dietilammina; j) Decanter; k) Colonna di trietilammina
Mentre la conversione iniziale dell’etanolo in etilammina è pressoché neutra dal punto di vista energetico, la formazione di ammine secondarie e terziarie è esotermica, il che ne favorisce la produzione termodinamica. Le condizioni di reazione, tra cui temperatura, eccesso di ammoniaca e tempo di residenza, influenzano la distribuzione del prodotto.
Storicamente, venivano utilizzati catalizzatori di disidratazione (ad esempio, allumina, silice), ma recentemente sono diventati predominanti i catalizzatori a base metallica. Vengono comunemente impiegati catalizzatori a base di nichel, cobalto, rame e ferro, mentre platino e palladio risultano meno selettivi a causa della potenziale scissione dei legami C-C o C-N durante la reazione.
Promotori come argento, zinco, indio, manganese, molibdeno e metalli alcalini migliorano le prestazioni del catalizzatore. Questi componenti attivi sono tipicamente supportati su allumina, silice o zirconia, con le zeoliti che mostrano una maggiore selettività per le ammine primarie.
Questa reazione avviene in un reattore a letto fisso a 0,5-25 MPa e 100-250 °C, a seconda del tipo di catalizzatore e della fase (liquida o gassosa).
Il meccanismo prevede la deidrogenazione dell’etanolo ad acetaldeide come fase determinante della velocità. La successiva aggiunta di ammoniaca, l’eliminazione dell’acqua e la formazione di immina o enammina sono seguite dall’idrogenazione ad etilammina.
Le reazioni collaterali includono il disproporzionamento dell’ammina (soprattutto a temperature più elevate), la condensazione aldolica di aldeidi intermedie, la formazione di basi di Schiff e la formazione di nitrili in condizioni specifiche.
Un eccesso di ammoniaca da due a otto volte sposta l’equilibrio verso la formazione di etilammina.
3.2. Produzione di etilammina da acetaldeide
L’acetaldeide, facilmente accessibile tramite sintesi oxo, è un precursore preferito dell’etilammina rispetto all’etanolo per i suoi vantaggi economici. Questo processo prevede una reazione in due fasi: formazione iniziale di un’immina (base di Schiff) da acetaldeide e ammoniaca, seguita dall’idrogenazione a etilammina.

Questo processo impiega un catalizzatore a letto fisso e una miscela di reazione contenente acetaldeide, ammoniaca e idrogeno. In alternativa, può essere vantaggioso un processo a due stadi, separando la formazione di immina dalla successiva idrogenazione.
È comune operare in fase vapore a 100-160 °C e a pressione atmosferica o leggermente elevata. È possibile utilizzare condizioni di alta pressione con sistemi efficaci di rimozione del calore, come reattori a riciclo elevato o multitubolari. Temperature di reazione inferiori rispetto all’amminazione alcolica potrebbero potenzialmente consentire una maggiore selettività.
I catalizzatori sono generalmente simili a quelli utilizzati nell’amminazione alcolica. L’etilammina grezza viene purificata per distillazione.
Sebbene esistano reagenti riducenti alternativi, l’idrogeno rimane la scelta industriale principale a causa di considerazioni di gestione e costi.
3.3. Altri processi
L’etilammina può essere prodotta aggiungendo ammoniaca all’etilene utilizzando catalizzatori zeolitici acidi come l’H-mordenite. Sebbene la conversione per l’amminazione diretta dell’etilene sia bassa, essendo limitata da fattori cinetici e dall’equilibrio termodinamico, la selettività per la monoetilammina è eccellente.
L’etilammina può anche essere preparata selettivamente per elettroriduzione dell’acetonitrile a temperatura e pressione ambiente, utilizzando nanoparticelle di Cu come elettrocatalizzatore. Tuttavia, questo metodo non ha importanza a livello industriale.
4. Usi dell’etilammina
L’etilammina è utilizzata principalmente come precursore degli erbicidi triazinici mediante reazione con il cloruro cianurico. L’atrazina, l’erbicida triazinico predominante, è impiegata per il controllo delle infestanti a foglia larga e graminacee, principalmente nella coltivazione di mais e sorgo da granella. La simazina, un’altra triazina derivata dall’etilammina, è utilizzata nella coltivazione di agrumi e canna da zucchero.
Oltre agli erbicidi, l’etilammina è utilizzata nella sintesi di vari prodotti chimici. Reagisce con il cloruro di metallile per formare etilmetallilammina, un intermedio chiave nella produzione dell’erbicida dinitroanilinico etalfluralin. Inoltre, l’etilammina funge da precursore dell’etilcicloesilammina, che viene successivamente convertita nel cicloato dell’erbicida tiocarbammato.
Viene utilizzata anche nell’industria delle resine, nella raffinazione del petrolio e nella produzione di prodotti farmaceutici, inibitori di corrosione, catalizzatori poliuretanici e agenti tessili.
Inoltre, l’etilammina viene impiegata come agente di estrazione con solvente, intermedio di coloranti, stabilizzante del lattice di gomma e reagente di laboratorio. È un intermedio nella preparazione di detergenti, coloranti fotografici, emulsionanti e sverniciatori. L’etilammina è stata identificata come un metabolita umano.
La domanda di atrazina è in calo a causa di preoccupazioni ambientali, che hanno portato a divieti in alcune regioni.
5. Tossicologia dell’etilammina
L’etilammina è un composto volatile e alcalino, facilmente assorbibile per via cutanea e respiratoria. Nonostante la sua efficiente escrezione urinaria a seguito di metabolismo parziale, l’esposizione può indurre effetti negativi sulla salute. La sua principale azione tossica è attribuita alle sue proprietà corrosive.
Tossicità acuta e a breve termine
L’etilammina è un grave irritante per la pelle, gli occhi e le vie respiratorie. Il contatto prolungato provoca danni tissutali corrosivi.
La LD50 orale acuta nei ratti è di 400 mg/kg, mentre la LD50 cutanea nei conigli è di 270 mg/kg. La LC50 per inalazione nei ratti è di 5540 ppm (esposizione di 1 ora). L’applicazione cutanea di una soluzione acquosa al 70% su cavie ha causato gravi ustioni cutanee e necrosi.
L’instillazione oculare di una soluzione all’1% nei conigli ha indotto grave irritazione. L’inalazione a breve termine di 50 ppm ha causato irritazione corneale nei conigli.
Le esposizioni industriali hanno provocato irritazione oculare ed edema corneale negli esseri umani. Esistono segnalazioni di disturbi visivi transitori (glaucopsia) simili a quelli causati dall’esposizione alla trietilammina, sebbene il nesso causale con l’etilammina non sia chiaro.
Tossicità cronica
I conigli esposti a 50 ppm di etilammina mostrano danni polmonari e lesioni corneali. Una concentrazione più elevata di 100 ppm ha indotto danni renali. I ratti presentano una minore sensibilità, con solo una lieve irritazione a 100 ppm. Irritazione e lesioni nasali si sono verificate a 500 ppm dopo 24 settimane di esposizione.
Non sono disponibili studi a lungo termine che valutino il potenziale cancerogeno. Non sono disponibili nemmeno studi sullo sviluppo fetale.
Non esistono dati sull’esposizione cronica all’etilammina nell’uomo.
Genotossicità
Sono stati osservati risultati positivi nei test di genotossicità su colture cellulari in vitro. L’etilammina non ha alterato la sintesi del DNA nei roditori.
Ecotossicità
L’etilammina presenta una tossicità acuta da moderata a bassa per gli organismi acquatici, con valori di LC50 compresi tra 40 e 1000 ppm per i pesci rossi e valori di EC50 compresi tra 100 e 200 ppm per la Daphnia magna.
Altri pericoli
L’etilammina è altamente infiammabile e può formare miscele di vapori esplosive. È un grave irritante per gli occhi, il naso e le vie respiratorie.
Riferimenti
- Amines, Aliphatic. Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a02_001.pub2
- Ethylamine. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543005042
- https://www.sciencedirect.com/science/article/abs/pii/B9780128243152001949
- https://patents.google.com/patent/US20070112218A1/en
- https://www.nature.com/articles/s41467-021-22291-0
- https://products.basf.com/global/en/ci/ethylamine-solution-70
