Acrilonitrile: proprietà, reazioni, produzione e usi
Cos’è l’acrilonitrile?
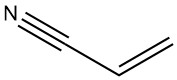
L’acrilonitrile è un composto chimico con formula chimica C3H3N. È un liquido limpido e incolore a temperatura ambiente e possiede un gruppo funzionale nitrile legato a un doppio legame carbonio-carbonio. L’acrilonitrile è un intermedio essenziale nell’industria chimica e funge da elemento costitutivo per vari prodotti.
È noto con vari nomi, tra cui 2-propenenitrile, propenenitrile, nitrile dell’acido acrilico, nitrile di propilene, cianuro di vinile e nitrile dell’acido propenoico.
La sintesi commerciale dell’acrilonitrile impiega il processo di ammossidazione del propilene, noto anche come processo SOHIO. Questo metodo, introdotto per la prima volta nel 1960, prevede la reazione di propilene, ammoniaca e ossigeno utilizzando un catalizzatore eterogeneo:
C3H6 + NH3 + 1,5 O2 → C3H3N + 3 H2O
Prima della scoperta del processo di ammossidazione del propilene, l’acrilonitrile veniva prodotto prevalentemente tramite il processo di etilene cianidrina.
L’implementazione del processo SOHIO ha comportato una significativa riduzione del costo di produzione dell’acrilonitrile, determinando un aumento sostanziale della domanda di questo composto in un ampio spettro di prodotti chimici e polimerici.
La fibra acrilica rimane l’applicazione principale per l’acrilonitrile, mentre i mercati per le resine acrilonitrile-butadiene-stirene (ABS), adiponitrile e acrilammide hanno anch’essi registrato una rapida crescita. Di conseguenza, la capacità produttiva annuale globale per l’acrilonitrile supera ora i 5 milioni di t/a.
Sommario
1. Proprietà fisiche dell’acrilonitrile
L’acrilonitrile è un liquido limpido e incolore a temperatura ambiente. Questa molecola possiede una natura polare dovuta al gruppo funzionale nitrile elettronegativo, che è coniugato con un doppio legame carbonio-carbonio.
In termini di solubilità, l’acrilonitrile dimostra miscibilità con diversi solventi organici, come acetone, benzene, tetracloruro di carbonio, etere dietilico, acetato di etile, etilencianidrina, etere di petrolio, toluene, alcuni cheroseni e metanolo.
La seguente tabella elenca alcune proprietà fisiche dell’acrilonitrile.
| Proprietà | Valore |
|---|---|
| Massa molare | 53,064 g/mol |
| Densità | 0,81 g/cm³ |
| Punto di fusione | -83,5 °C |
| Punto di ebollizione | 77,3 °C |
| Indice di rifrazione | 1,391 |
| Miscibilità in acqua | 7,30% in peso |
| Viscosità | 0,35 cP (a 20 °C) |
| Pressione critica | 35,3 MPa |
| Temperatura critica | 245,8 °C |
| Temperatura di autoaccensione | 481 °C |
2. Reattività chimica dell’acrilonitrile
La reattività chimica distintiva dell’acrilonitrile deriva dalla presenza di due siti reattivi, vale a dire il doppio legame carbonio-carbonio e il gruppo funzionale nitrile.
Le principali reazioni chimiche a cui è sottoposto sono la polimerizzazione e l’idratazione. L’acrilonitrile polimerizza facilmente ed esotermicamente in assenza di un inibitore dell’idrochinone, specialmente sotto esposizione alla luce.
Questo processo di polimerizzazione è avviato da radicali liberi, catalizzatori redox o basi e può avvenire in fase liquida, solida o gassosa. La polimerizzazione in fase liquida è particolarmente adatta per produrre omopolimeri e copolimeri.
Quando l’acrilonitrile subisce idratazione con acido solforico, forma solfato di acrilammide (C3H5NO·H2SO4), che può essere convertito in acrilammide tramite neutralizzazione con una base e l’idratazione completa porta alla formazione di acido acrilico.
L’acrilammide può anche essere generata direttamente dall’acrilonitrile tramite idratazione parziale con catalizzatori a base di rame, che è diventata la via commerciale preferita per la produzione di acrilammide.
Esteri acrilici di importanza industriale si formano dalla reazione del solfato di acrilammide con alcoli organici.
La produzione commerciale di acrilato di metile comporta l’aggiunta di metanolo al solfato di acrilammide.
Inoltre, l’acrilonitrile è coinvolto in altre reazioni, tra cui l’addizione di Diels-Alder ai dieni, che danno origine a prodotti ciclici.
L’idrogenazione su catalizzatori metallici produce propionitrile e propilammina. Inoltre, una significativa reazione industriale è l’idrodimerizzazione dell’acrilonitrile, che produce adiponitrile.
Inoltre, l’acrilonitrile può subire l’addizione di alogeni attraverso il doppio legame per generare dialopropionitrili. Partecipa anche a reazioni di cianoetilazione con alcoli, aldeidi, esteri, ammidi, nitrili, ammine, solfuri, solfoni e alogenuri.
3. Produzione di acrilonitrile
L’acrilonitrile è prodotto industrialmente tramite un processo catalitico in fase vapore chiamato ammossidazione del propilene, sviluppato da SOHIO. Il processo impiega un reattore a letto fluido in cui propilene, ammoniaca e aria reagiscono con un catalizzatore solido a temperature di 400-510 °C e pressioni di 50-200 kPa gauge.
La reazione è a passaggio singolo, con circa il 98% di conversione del propilene. I catalizzatori altamente selettivi hanno portato a un consumo inferiore di propilene, circa 1,1 kg per chilogrammo di acrilonitrile prodotto.
Insieme all’acrilonitrile, il processo produce utili coprodotti come HCN (utilizzato nella produzione di metilmetacrilato e cianuro di sodio) e acetonitrile (un solvente prezioso in applicazioni farmaceutiche e industriali).
Nella produzione commerciale di acrilonitrile, l’effluente caldo del reattore viene raffreddato con acqua in un assorbitore controcorrente e l’ammoniaca non reagita viene neutralizzata con acido solforico. Il solfato di ammonio risultante viene recuperato e utilizzato come fertilizzante.

a) Reattore a letto fluido; b) Assorbitore controcorrente; c) Colonna di recupero; d) Seconda colonna di recupero; e) Colonne di frazionamento
Il gas di scarico dell’assorbitore, contenente N2, CO, CO2 e propilene non reagito, viene scaricato direttamente o fatto passare attraverso un inceneritore per bruciare idrocarburi e CO. La soluzione contenente acrilonitrile viene quindi elaborata in colonne di recupero per ottenere acrilonitrile grezzo e acetonitrile grezzo, con ulteriore purificazione per acrilonitrile di qualità per fibre acriliche.
La redditività commerciale della produzione di acrilonitrile da propilene e ammoniaca è stata raggiunta nel 1959 quando SOHIO ha sviluppato un catalizzatore con elevata selettività per l’acrilonitrile. I miglioramenti nel corso degli anni sono stati dovuti principalmente allo sviluppo di nuovi catalizzatori con rese di acrilonitrile aumentate dal propilene.
Gli ossidi metallici misti multicomponenti, basati principalmente su ossido di bismuto-molibdeno, sono stati i catalizzatori chiave, con vari miglioramenti ottenuti tramite l’incorporazione di ferro, cobalto, nichel e metalli alcalini.
I catalizzatori a base di molibdato sono predominanti, ma anche i catalizzatori all’antimonato sono usati commercialmente. Gli sforzi di ricerca si sono concentrati sulla comprensione della chimica della reazione superficiale e dei meccanismi allo stato solido dei catalizzatori a base di bismuto-molibdato.
Studi cinetici hanno dimostrato che la fase di determinazione della velocità comporta l’estrazione di un atomo di idrogeno dal propilene per formare un complesso p-allile sulla superficie, portando alla formazione di acroleina e, infine, acrilonitrile.
Varie tecniche, come l’analisi spettroscopica Raman, i raggi X, la diffrazione di neutroni, la spettroscopia di assorbimento dei raggi X, gli studi cinetici a impulsi e le indagini sulle molecole sonda, hanno fornito una comprensione più approfondita dei complessi meccanismi allo stato solido e di superficie coinvolti nell’ammossidazione del propilene su catalizzatori a base di molibdato di bismuto.
4. Usi dell’acrilonitrile
L’acrilonitrile trova importanti utilizzi finali in vari settori, tra cui fibra acrilica, resine acrilonitrile-butadiene-stirene (ABS), adiponitrile, acrilammide, gomme nitriliche e fibre di carbonio. Tra queste applicazioni, la fibra acrilica è il più grande utilizzo commerciale.
| Prodotto | % |
|---|---|
| Fibra acrilica | 42 |
| Resine ABS | 34 |
| Adiponitrile | 8 |
| Acrilamide | 7 |
| Gomma nitrilica | 5 |
| Fibra di carbonio | 2 |
| Altro | 2 |
Tuttavia, si prevede che ABS e acrilammide saranno le applicazioni in più rapida crescita per l’acrilonitrile, con le fibre di carbonio in aumento, in particolare nelle applicazioni ad alta resistenza e leggere nei settori delle compagnie aeree e dell’automobile.
La fibra acrilica è utilizzata principalmente nella produzione di abbigliamento e arredamento per la casa. Tuttavia, la sua crescita di mercato è rallentata rispetto ad altri usi dell’acrilonitrile, con gran parte della capacità produttiva di fibre acriliche che si sposta dagli Stati Uniti e dall’Europa all’Asia, soprattutto in Cina.
L’ABS, un polimero speciale ad alte prestazioni, guadagna popolarità grazie alla sua eccellente resistenza, alle proprietà coloranti e alla facilità di lavorazione. Trova applicazioni in vari settori, tra cui automobilistico, edile, degli elettrodomestici e dell’elettronica. I copolimeri SAN, noti per la loro trasparenza ottica, sono utilizzati negli imballaggi, nelle fibre ottiche e nei contenitori per alimenti, tra le altre applicazioni.
L’adiponitrile funge da materia prima per la produzione di esametilendiammina (HMDA, C6H16N2) tramite elettroidrodimerizzazione. L’HMDA viene poi utilizzato per produrre nylon-6,6.
L’acrilammide è prodotta dall’acrilonitrile tramite un processo catalizzato dal rame. Dopo la polimerizzazione, trova ampio utilizzo nel trattamento delle acque reflue, nella produzione di petrolio, nella lavorazione dei minerali e nella fabbricazione della carta.
Le gomme nitriliche, che sono copolimeri butadiene-acrilonitrile, sono molto apprezzate nel settore per la loro resistenza chimica, all’olio e all’ozono, insieme a un’eccellente flessibilità, stabilità e resistenza al calore. Sono comunemente utilizzate nella produzione di guarnizioni, tenute, tubi flessibili, cinghie e guaine per cavi elettrici.
5. Tossicologia e salute sul lavoro
L’acrilonitrile presenta significativi rischi di tossicità se ingerito, inalato o assorbito attraverso la pelle. Nella sua forma liquida o di vapore concentrato, è corrosivo e può causare ustioni cutanee simili a ustioni di secondo grado.
La sovraesposizione ai suoi vapori può causare gravi irritazioni congiuntivali e respiratorie, nonché sintomi quali mal di testa, nausea, vomito, debolezza e vertigini.
L’esposizione prolungata può causare sonnolenza, convulsioni, allucinazioni, perdita di coscienza e persino la morte. L’insorgenza di questi effetti tossici può essere ritardata, verificandosi da pochi minuti a diverse ore dopo l’esposizione.
Inoltre, l’acrilonitrile è considerato un sospetto rischio cancerogeno, con il rischio di cancro che dipende dal livello e dalla durata dell’esposizione. Studi in vitro hanno mostrato deboli proprietà mutagene, mentre studi in vivo non hanno confermato questo effetto.
Studi sugli animali hanno rivelato effetti dannosi sullo sviluppo fetale e sulla riproduzione quando esposti a livelli tossici di acrilonitrile. Sono stati osservati effetti embriotossici e teratogeni negli animali quando le loro madri sono state esposte a dosi elevate.
Studi condotti su lavoratori dell’acrilonitrile in Cina hanno riportato tassi più alti del previsto di effetti riproduttivi e sviluppo fetale anomalo. Tuttavia, l’affidabilità di questi studi è stata messa in discussione a causa di incertezze riguardanti la metodologia di raccolta dati, esposizioni chimiche, influenze sociali e di stile di vita e incongruenze con altre informazioni.
Studi epidemiologici sulla relazione tra esposizione all’acrilonitrile e tumori specifici non hanno fornito prove chiare.
Sebbene i dati sui livelli occupazionali di esposizione umana non indichino una correlazione definitiva tra acrilonitrile e cancro, è comunque prudente trattare l’acrilonitrile come un potenziale cancerogeno. I livelli di esposizione devono essere ridotti al minimo e il contatto con l’acrilonitrile liquido deve essere evitato.
Durante la combustione, l’acrilonitrile produce sottoprodotti altamente tossici, tra cui acido cianidrico, biossido di azoto e monossido di carbonio.
Per proteggere i lavoratori, l’Amministrazione per la sicurezza e la salute sul lavoro negli Stati Uniti regola l’acrilonitrile come un pericolo cancerogeno (29 CFR 1910.1045). Il limite di esposizione ammissibile (PEL) è fissato a 2 ppm nell’aria in media su un periodo di 8 ore (media ponderata nel tempo – TWA).
Il limite massimo (CL) è di 10 ppm in media su un periodo di 15 minuti. L’odore dell’acrilonitrile è un segnale di avvertimento debole per l’esposizione poiché la sua soglia di odore è compresa tra 13 e 20 ppm, ben al di sopra sia del PEL che del CL.
I livelli di tossicità per l’acrilonitrile sono stati definiti come segue:
- Tossicità orale: ratto LD50 81 mg/kg
- Tossicità per inalazione: ratto LC50 557 ppm/4 h, 946 ppm/4 h (da naso/seni); ratto LCL0 > 1008 ppm/1 h
- Tossicità cutanea: coniglio LD50 226–250 mg/kg
Riferimento
- Acrylonitrile; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_177.pub3
