Acilazione dei composti aromatici
1. Acilazione di Friedel-Crafts
L’acilazione di Friedel-Crafts comporta la produzione di un chetone aromatico mediante la reazione tra un composto aromatico e un agente acilante, che potrebbe essere un alogenuro acilico, un’anidride acida, un acido o un estere. Questa reazione avviene in presenza di un catalizzatore acido.
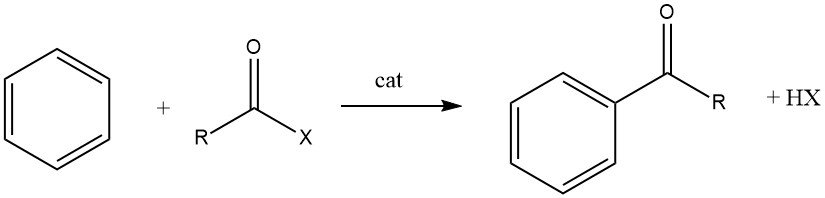
Table of Contents
L’acilazione di substrati aromatici ha una notevole importanza industriale in quanto viene utilizzata per la sintesi di intermedi aromatici ampiamente impiegati nella produzione di prodotti farmaceutici, insetticidi, plastificanti, coloranti, profumi e vari altri prodotti commerciali. Questi composti speciali sono in genere prodotti su scala più piccola rispetto ai prodotti alchilati.
| Agente acilante | Composto aromatico | Prodotto | Uso finale |
|---|---|---|---|
| Anidride acetica | Benzene | Acetofenone | Profumi, prodotti farmaceutici, solventi, plastificanti |
| Anidride acetica | Toluene | 4-metilacetofenone | Profumi |
| Acetico anidride | anisolo | 4-metossiacetofenone | profumi |
| anidride acetica | isobutilbenzene | 4-isobutilattofenone | prodotti farmaceutici |
| cloruro di dicloroacetile | 1,2-diclorobenzene | α,α,2,4-tetracloroacetofenone | insetticidi |
| cloruro di clorobutirrico | fluorobenzene | cloropropil 4-fluorofenil chetone | prodotti farmaceutici |
| Tetraclorometano | benzene | benzofenone | prodotti farmaceutici, insetticidi, profumi |
| cloruro di benzoile | benzene | benzofenone | |
| fosgene | N,N-dimetilanilina | 4,4'-bis-dimetilamminobenzofenone | coloranti |
| Anidride ftalica | Benzene | Acido 2-benzoilbenzoico | Antrachinone |
L’acilazione dimostra una notevole versatilità, dando origine a prodotti diversi, tra cui aldeidi aromatiche, alchil aril chetoni, diaril chetoni simmetrici e asimmetrici, nonché prodotti di ciclizzazione.
Gli agenti acilanti mostrano generalmente una maggiore reattività rispetto agli agenti alchilanti, consentendo di condurre le acilazioni in condizioni relativamente miti. I substrati aromatici con sostituenti donatori di elettroni come gruppi alchilici, idrossilici o alcossilici mostrano una maggiore reattività.
Al contrario, i composti aromatici contenenti sostituenti che attraggono elettroni come gruppi nitro, acile, carbossilico o nitrile sono significativamente più difficili da far reagire, anche con agenti acilanti altamente attivi.
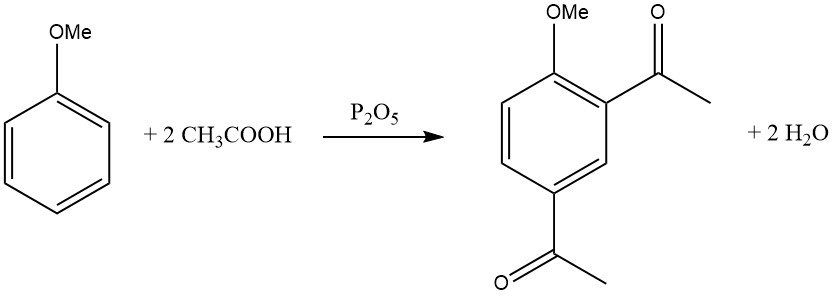
L’introduzione del primo gruppo acile inibisce l’ingresso di un secondo gruppo acile, rendendo rara la disostituzione nello stesso anello. Esistono tuttavia alcune eccezioni, come la diacilazione di mesitilene, durene e anisolo utilizzando una miscela di acido acetico glaciale e pentossido di fosforo.
I sostituenti donatori di elettroni facilitano l’acilazione e il miglioramento della reattività dovuto alla polisostituzione è notevole.
Oltre al benzene e ai suoi derivati, anche i composti aromatici carbociclici polinucleari come naftalene, difenile, antracene, fenantrene e pirene possono fungere da substrati nelle reazioni di acilazione.
Gli eterocicli ricchi di elettroni come pirrolo, furano e tiofene, insieme ai loro derivati policiclici, mostrano un’elevata reattività.
Al contrario, piridina e chinolina non reagiscono a meno che non vengano attivate dai sostituenti. I substrati aromatici non benzenoidi attivi nell’acilazione includono azuleni, ferroceni e indolizine.
Nonostante condivida alcune somiglianze con l’alchilazione di Friedel-Crafts, l’acilazione mostra differenze caratteristiche.
Ad esempio, il consumo del catalizzatore acido è in genere almeno stechiometrico, sebbene vi siano casi in letteratura in cui vengono utilizzate quantità substechiometriche di acidi di Lewis. La reazione procede con maggiore regioselettività e più uniformità rispetto all’alchilazione di Friedel-Crafts, con conseguenti meno isomerizzazioni e reazioni collaterali.
1.1. Catalizzatori di acilazione
I catalizzatori impiegati nell’alchilazione di Friedel-Crafts possono essere utilizzati anche per reazioni di acilazione. Il catalizzatore di scelta nella maggior parte dei casi è AlCl3. Le impurità presenti in AlCl3, come FeCl3 o tracce di acqua, migliorano le rese di reazione e la reattività del sistema, in particolare nei casi in cui le reazioni sono altrimenti lente.
Tuttavia, in alcuni casi, l’elevata attività di AlCl3 può portare a reazioni collaterali indesiderate, come la decomposizione di eterocicli reattivi come il benzofurano, la decomposizione dell’etere o i riarrangiamenti del gruppo alchilico.
Per moderare l’attività di AlCl3 in tali casi, solventi complessanti come nitrobenzene possono essere utilizzati per formare addotti 1:1. Inoltre, BF3 e SnCl4 sono catalizzatori acilanti adatti per eterocicli sensibili.
Quando vengono impiegati agenti acilanti come anidridi, esteri o acidi carbossilici, possono essere applicati anche acidi protonici forti come acido solforico, acido perclorico, acido ortofosforico e acido polifosforico.
L’acido polifosforico, che inizialmente era utilizzato principalmente per reazioni di ciclizzazione intramolecolare, ora viene sempre più utilizzato nelle acilazioni intermolecolari.
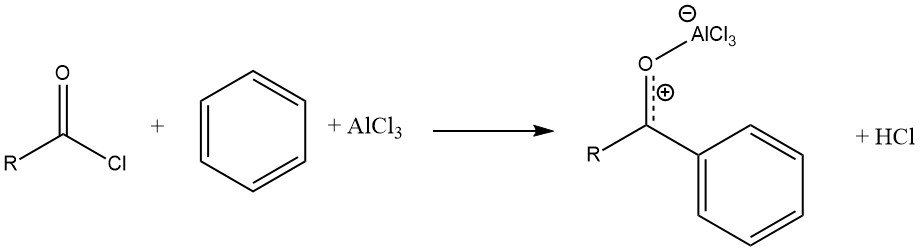
La reazione di un alogenuro acilico con un substrato aromatico, catalizzata da AlCl3, determina la formazione di un complesso stabile dell’acido di Lewis con il chetone aromatico. Il prodotto viene quindi liberato tramite idrolisi.
A differenza delle alchilazioni di Friedel-Crafts, il catalizzatore deve essere in genere applicato in quantità almeno stechiometriche rispetto all’alogenuro acilico. Tuttavia, ci sono alcune eccezioni in cui vengono utilizzate quantità “veramente catalitiche” (substechiometriche) di acidi di Lewis, come cloruro ferroso, ossidi di zinco o ferro, cloruro di cobalto e triflati di metalli delle terre rare.
Per agenti acilanti come acidi carbossilici o esteri, è richiesta almeno il doppio della quantità di catalizzatore e, nel caso di anidridi, il triplo della quantità (ma 1,5 moli per mole di prodotto).
Il fluoruro di idrogeno a volte in combinazione con il fluoruro di boro è un catalizzatore importante a livello industriale. Offre il vantaggio del recupero del catalizzatore tramite distillazione, riducendo così la formazione di rifiuti.
Questa tecnologia è utilizzata commercialmente per l’acilazione dell’isobutilbenzene a 4-isobutyacetofenone, un intermedio nella produzione di ibuprofene, un farmaco antinfiammatorio ampiamente utilizzato.
1.1.1. Catalizzatori eterogenei
Sebbene la classica sintesi di Friedel-Crafts con catalizzatori omogenei rimanga il metodo principale per preparare chetoni aromatici, presenta diversi svantaggi:
- Spesso richiede quantità stechiometriche o addirittura eccessive di “catalizzatore” a causa della formazione di complessi stabili con i prodotti. Questi catalizzatori, come AlCl3, agiscono più come reagenti che come veri catalizzatori, contribuendo in modo significativo ai costi di produzione. Devono essere separati e lavati via dal prodotto e non possono essere facilmente riciclati.
- Il sistema di reazione è altamente corrosivo, rendendo necessari costosi reattori e attrezzature per la purificazione dei gas di scarico, che contengono non solo HCl ma anche idrocarburi clorurati.
- Il catalizzatore deve essere neutralizzato e smaltito insieme a un grande volume di acque reflue, aumentando l’impatto ambientale.
Negli ultimi anni, sono stati fatti degli sforzi per sostituire i catalizzatori omogenei con catalizzatori eterogenei. I catalizzatori eterogenei offrono vantaggi come il non richiedere quantità stechiometriche, essere non corrosivi, una facile separazione senza neutralizzazione e la possibilità di riciclarli o utilizzarli in processi continui a letto fisso.
I catalizzatori di acilazione eterogenei devono essere acidi forti di Lewis o di Brønsted. Alcune importanti classi di acidi solidi che possono catalizzare questa reazione sono:
1. Zeoliti: allumino-silicati microporosi e cristallini con forti centri di Brønsted o di Lewis. Sistemi a pori medi come H-ZSM-5 o sistemi a pori grandi come zeolite HY, zeolite beta o mordenite sono stati utilizzati con successo per reazioni di acilazione con composti aromatici ricchi di elettroni.
2. Argille modificate: i minerali argillosi, se modificati, possono aumentare il numero di siti acidi. Le argille trattate con acido (catalizzatori acidi di Brønsted) e le argille scambiate con ioni (catalizzatori acidi di Lewis) sono utilizzate commercialmente per varie reazioni catalizzate da acido.
3. Superacidi solidi: acidi forti più forti dell’acido solforico al 100%, inclusi ossidi solfatati come ZrO2, TiO2, HfO2, Fe2O3 e SnO2, sono stati studiati come superacidi solidi per reazioni di acilazione.
4. Varie: altri catalizzatori come eteropoliacidi, acidi montati in superficie (acidi protonici o di Lewis su un supporto) e Nafion sono stati anch’essi studiati per reazioni di acilazione, ma non sono ancora in uso commerciale.
Utilizzando catalizzatori eterogenei, i ricercatori mirano a superare i limiti dei catalizzatori omogenei e a sviluppare processi più sostenibili ed efficienti per la sintesi di chetoni aromatici.
1.2. Solventi nella reazione di acilazione
Per le reazioni di acilazione che utilizzano un sistema catalizzatore alogenuro acilico – acido di Lewis, la scelta del solvente gioca un ruolo cruciale. Solventi non polari come CCl4 o CS2, così come solventi di media polarità come diclorometano o 1,2-dicloroetano, possono essere utilizzati come substrato aromatico.
Con AlCl3 come catalizzatore, si formano sistemi eterogenei in questi solventi. Tuttavia, utilizzando solventi come nitrometano o nitrobenzene si ottengono soluzioni omogenee e una reattività ridotta a causa della formazione di complessi. La scelta del solvente può anche influenzare la regioselettività della reazione di acilazione.
Un rischio da considerare è che gli addotti di AlCl3 e nitrobenzene possono decomporsi in modo esplosivo a temperature elevate.
Esistono tre procedure comuni per eseguire l’acilazione utilizzando un sistema catalizzatore alogenuro acilico – acido di Lewis:
1. L’agente acilante viene aggiunto a una soluzione o sospensione raffreddata del catalizzatore in un solvente, seguito dall’aggiunta del substrato aromatico al complesso acilante preformato (metodo Perrier).
2. Tutti i reagenti vengono miscelati e raffreddati e il catalizzatore viene aggiunto lentamente (metodo Elbs).
3. Il substrato aromatico funge da solvente per il catalizzatore e l’agente acilante viene quindi aggiunto lentamente (metodo Bouveault).
Il metodo Perrier è spesso preferito in quanto mantiene un rapporto costante tra catalizzatore e agente acilante durante tutta la reazione.
Se si utilizza acido solforico come catalizzatore, è necessario un grande eccesso di acido e i reagenti vengono aggiunti ad esso. Per evitare reazioni di solfonazione o aldolizzazione dell’anello, la temperatura deve essere mantenuta al di sotto di 100 °C.
1.3. Agenti acilanti
L’acilazione di Friedel-Crafts mostra una notevole versatilità dovuta alla variazione sistematica che può essere introdotta sia nell’agente acilante che nel substrato aromatico. La reattività degli agenti acilanti segue un andamento come segue:
[RCO]+[BF4]− > [RCO]+[ClO4]− > RCOO-SO3H > RCOX (RCO)2O > RCO2R’ > RCONR’2
Gli acil perclorati ionici e i tetrafluoroborati sono agenti potenti, mentre gli esteri acidi e le ammidi sono quasi inattivi senza catalizzatori. La reattività degli alogenuri acilici diminuisce nell’ordine: RCOI > RCOBr > RCOCl > RCOF.
La reattività degli alogenuri acilici è anche influenzata dal sostituente R, che può essere alchilico o arilico e può contenere gruppi alogeni, alchilici, alcossilici o nitro. La reattività è ulteriormente influenzata dal tipo di substrato aromatico e dal catalizzatore utilizzato.
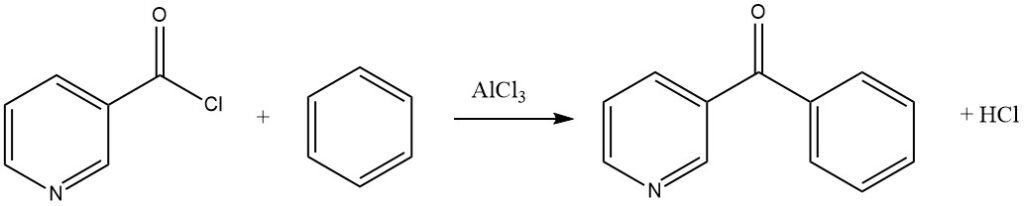
Gli alogenuri acilici aromatici possono contenere sostituenti nitro o essere di tipo piridinico, come dimostrato nella sintesi di 3-benzoilpiridina da benzene e cloruro di nicotinile.
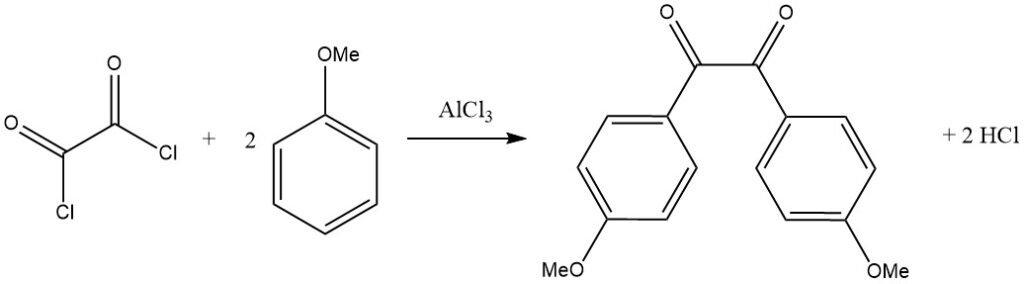
Gli alogenuri acilici bifunzionali possono anche agire come agenti acilanti, come si vede nella reazione del cloruro di ossalile con un substrato aromatico attivato come l’anisolo, che porta al corrispondente derivato benzilico.
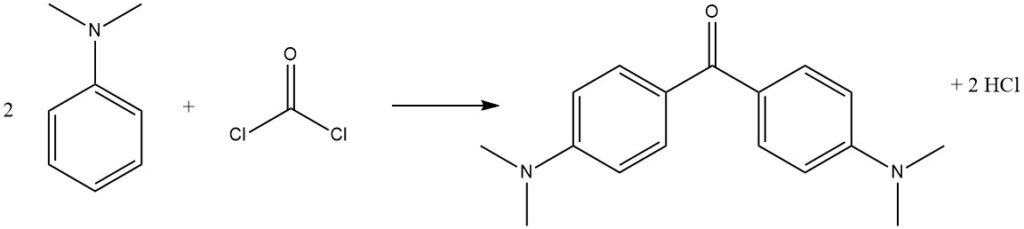
Il fosgene, un reagente di importanza commerciale, può reagire con la N,N-dimetilanilina per produrre 4,4′-bis(dimetilammino)benzofenone (chetone di Michler), utilizzato nella produzione di coloranti.
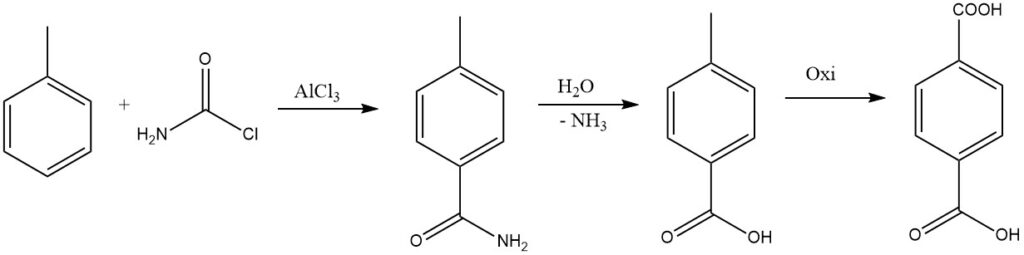
Sostituendo un alogeno del fosgene con un gruppo ammidico, l’ammide risultante può essere idrolizzata per formare l’acido, che viene preso in considerazione per la sintesi industriale dell’acido tereftalico.
Anche isocianati, isotiocianati e CO2 possono fungere da agenti acilanti in presenza di AlCl3 per produrre acidi carbossilici aromatici o loro derivati.
Agenti acilanti bifunzionali asimmetrici, come cloruri acidi contenenti un gruppo estere, reagiscono selettivamente con il gruppo acilico più attivo.
Analogamente, anidridi acide, come anidridi succiniche, glutariche o maleiche, in presenza di 2 moli di AlCl3 per mole di anidride, possono produrre acidi 4-aril-4-ossobutanoici, che sono intermedi nella sintesi di Haworth di aromatici polinucleari.
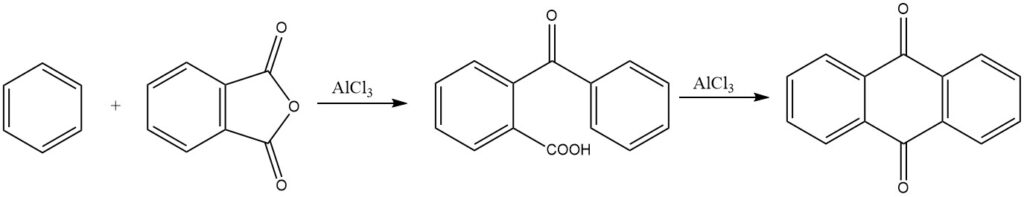
La sintesi di antrachinone da anidride ftalica e benzene è di importanza commerciale. In condizioni fortemente acide, può anche formarsi 3,3-difenilftalide.
Con i catalizzatori zeolitici, gli acidi carbossilici non attivati possono essere utilizzati nella fase liquida per reagire con il toluene, producendo p-aciltolueni con rese elevate. Questo processo ha mostrato grandi promesse, con rese che raggiungono fino al 96%.
2. Acilazione di benzene e derivati del benzene
2.1. Acilazione del benzene
L’acilazione industriale del benzene con anidride acetica, utilizzando AlCl3 come catalizzatore e mantenendo una temperatura di 30 °C tramite raffreddamento, produce acetofenone con una resa dell’85%. Tuttavia, l’acetofenone è ora prodotto prevalentemente industrialmente tramite l’ossidazione di etilbenzene o cumene.
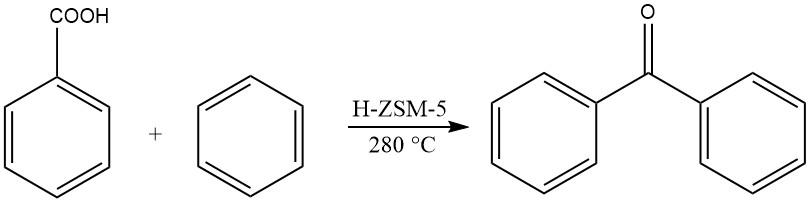
Un altro metodo prevede l’acilazione in fase gassosa del benzene con acido benzoico a temperature elevate, producendo benzofenone.
2.2. Acilazione del toluene
L’acilazione del toluene, utilizzando cloruro di acetile e cloruro di alluminio come catalizzatore, determina la formazione di 4-metilacetofenone con un’impressionante selettività del 97,6%. Questo composto trova applicazione nella produzione di profumi.
2.3. Acilazione di substrati disattivati
I composti aromatici benzenoidi contenenti sostituenti nitro, carbossilici, nitrili e acilici presentano un ostacolo alla sostituzione elettrofila. Tuttavia, l’acilazione di questi composti diventa fattibile solo in presenza di un secondo sostituente attivante, come un gruppo idrossilico o alcossilico.
D’altro canto, substrati disattivati come il clorobenzene possono essere sottoposti ad acilazione per formare p-clorobenzofenoni, utilizzando catalizzatori eterogenei commerciali come zeoliti o zirconia solfatata, noti per le loro proprietà di superacidi solidi.
2.4. Acilazione di substrati attivati
L’acilazione di substrati attivati, come il fenolo, può essere realizzata utilizzando vari catalizzatori, tra cui acido carbossilico – ZnCl2, acido carbossilico – BF3 o acido carbossilico – acido polifosforico. L’acilazione dei fenoli dimostra fino al 25% di selettività per la sostituzione orto, con il rapporto orto-para fortemente influenzato dalla scelta di catalizzatori e solventi.
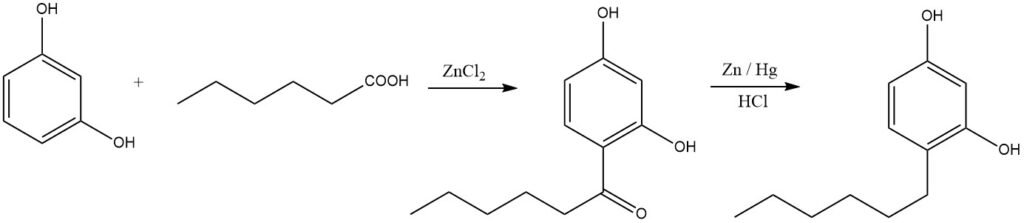
Gli alchilfenoli lineari possono essere sintetizzati tramite acilazione seguita da riduzione. Un esempio illustrativo è la produzione di esilresorcinolo, ampiamente utilizzato come disinfettante:
Sia i fenoli che gli eteri fenilici sono substrati altamente reattivi e mostrano reattività in condizioni relativamente miti. Ad esempio, l’anisolo può essere convenientemente acilato a 40-50 °C in presenza di acido polifosforico. Gli eteri fenilici, d’altro canto, subiscono acilazione prevalentemente in posizione 4.
Un’alternativa ecologica ai sistemi di acilazione convenzionali Friedel-Craft evita la formazione di sali di scarto e sottoprodotti. Questo approccio prevede l’uso di anidridi miste di acido trifluoroacetico, che vengono generate in situ reagendo con acidi carbossilici. Basse concentrazioni di H3PO4 fungono da catalizzatore e l’acido trifluoroacetico può essere riciclato dopo la disidratazione.
2.5. Acilazione di ammine aromatiche
Dopo la N-acilazione, le ammine aromatiche mostrano un modello di reattività simile ai composti alchilaromatici nelle reazioni di acilazione. Le ammine aromatiche terziarie, come la N,N-dimetilanilina, possono subire acilazione in posizione 4, impiegando P2O5 come catalizzatore. Ciò è ben noto nella sintesi del chetone di Michler.
2.6. Reazioni di ciclizzazione
Il 6-metossi-1-tetralone si ottiene con un’impressionante resa del 96% facendo reagire l’acido 4-(3-metossifenil)butirrico.
Le ciclizzazioni intermolecolari sono ampiamente dimostrate nelle reazioni dell’anidride ftalica con il benzene e i suoi derivati, che danno origine rispettivamente ad antrachinone e antrachinoni sostituiti.
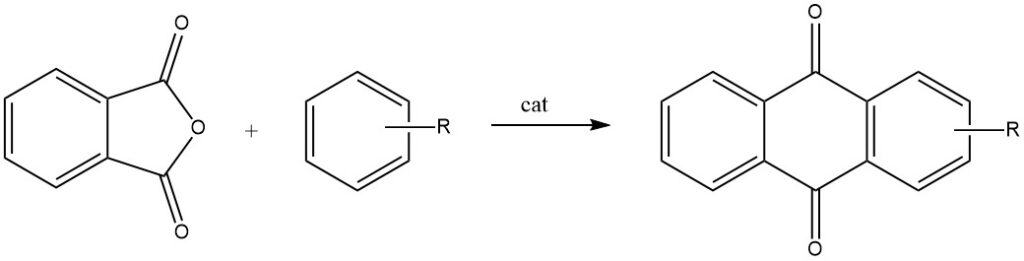
Quando l’anidride ftalica reagisce con il toluene o il clorobenzene, subisce un processo in due fasi, che porta alla formazione di antrachinoni 2-sostituiti.
Al contrario, la reazione con il 4-clorofenolo produce direttamente 1,4-diidrossiantrachinone (chinizarina). La successiva ossidazione, nitrazione, clorurazione o aminazione di questi prodotti genera intermedi essenziali per prodotti chimici fini.
Inoltre, l’acilazione di Friedel – Crafts dell’etilbenzene con anidride ftalica produce, attraverso un processo in due fasi, 2-etilantrachinone, un componente significativo utilizzato nella sintesi di H2O2.
3. Acilazione di composti aromatici polinucleari
3.1. Acilazione del naftalene
L’acilazione del naftalene in genere produce miscele di derivati 1- e 2-acilici e le proporzioni relative di questi derivati sono influenzate principalmente dalla scelta del solvente. Quando vengono utilizzati solventi non polari come CS2 o CCl4, l’acilazione avviene principalmente nella posizione 1. Al contrario, in solventi polari come CH3NO2 o C6H5NO2, è favorita la formazione di 2-acetilnaftaleni.
3.2. Acilazione di naftaleni sostituiti
L’acilazione di naftaleni sostituiti spesso produce miscele complesse di prodotti. In genere, l’anello più altamente attivato è più incline all’acilazione. Tuttavia, la regioselettività può essere controllata dalla selettività di forma delle zeoliti.
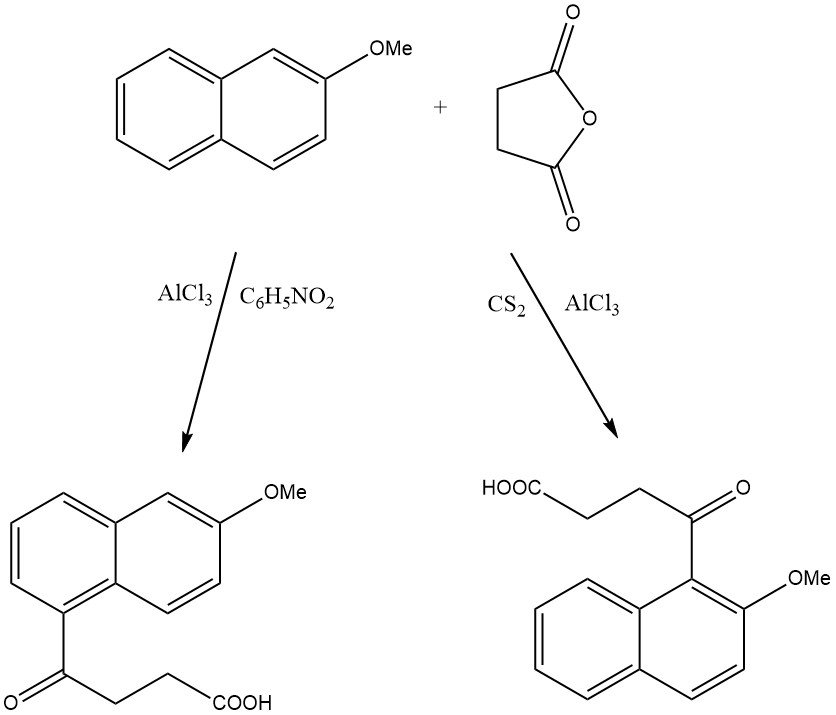
Ad esempio, quando il 2-metossinaftalene viene acilato sulla zeolite HY, si produce solo l’1-acetil-2-metossinaftalene, mentre sulla zeolite beta si forma il 2-acetil-6-metossinaftalene.
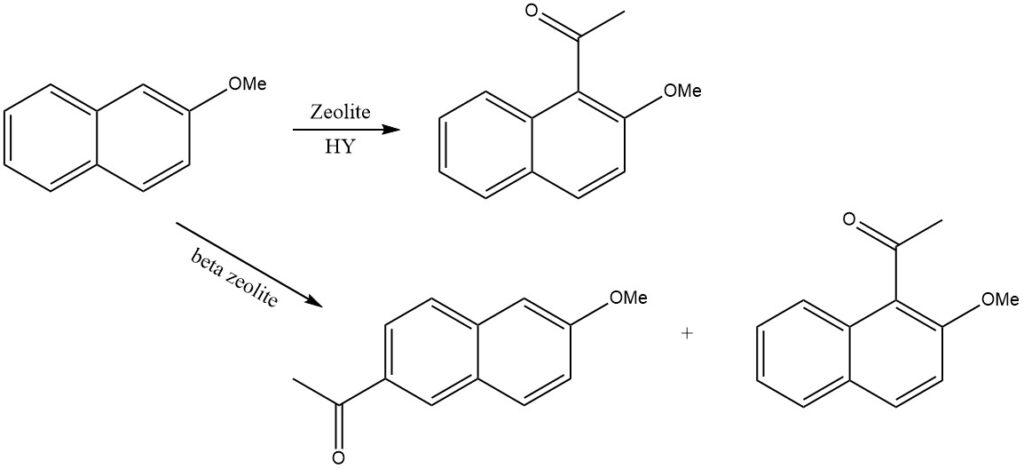
La 1,5-diacilazione richiede condizioni più severe, come si vede nella sintesi del 1,5-dibenzoilnaftalene. Questo composto può essere ulteriormente fuso in cloruro di sodio e alluminio per produrre dibenzopirenequinone, un colorante commercializzato come Indanthren Goldgelb GK.
Quando il naftalene reagisce con composti diacilici, spesso si formano prodotti 1,8-diacilati.
3.3. Acilazione dei bifenili
Quando un anello di una molecola di bifenile viene disattivato da un sostituente elettron-attrattore, l’altro anello diventa più reattivo e può subire acilazione in posizione 4. La disattivazione di un anello aumenta la reattività dell’altro anello, rendendolo più suscettibile alla sostituzione elettrofila e, quindi, l’acilazione avviene preferibilmente in posizione 4.
3.4. Acilazione dell’antracene
In presenza di cloruro di alluminio e in condizioni miti in solventi non polari (0 °C, benzene), l’antracene subisce acilazione nella posizione 9 più reattiva. L’isomerizzazione del complesso chetone-AlCl3 è impedita dalla precipitazione.
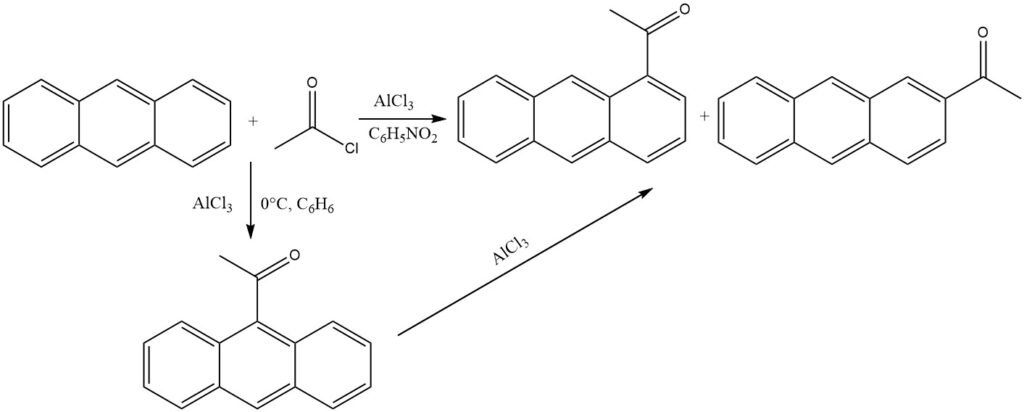
Tuttavia, quando si utilizzano solventi polari come il nitrobenzene, si forma una miscela composta principalmente da 1-acilantracene e un po’ di 2-acilantracene. Anche in questo scenario, il 9-acilantracene è probabilmente il prodotto iniziale, che successivamente subisce isomerizzazione.
3.5. Acilazione del fenantrene
Allo stesso modo, quando il fenantrene viene acilato nel nitrobenzene, i prodotti principali ottenuti sono gli isomeri 2 e 3-acilici. D’altro canto, l’utilizzo del solvente meno polare dicloroetano porta prevalentemente alla formazione dell’isomero 9-acilico come prodotto primario. La scelta del solvente svolge un ruolo cruciale nel determinare la regioselettività della reazione di acilazione per il fenantrene.
4. Acilazione di composti eteroaromatici
Il furano, il tiofene e il pirrolo possiedono un’elevata densità elettronica, che li rende altamente attivati nelle reazioni di sostituzione elettrofila, consentendone l’acilazione in condizioni di reazione blande.
4.1. Acilazione del furano
L’acilazione del furano determina rese significative del derivato 2-acilico, in particolare quando le anidridi fungono da agenti acilanti. L’eccellente reattività del furano consente l’uso del benzene come solvente. I catalizzatori adatti per questa reazione includono cloruro di zinco, trifluoruro di boro e acido fosforico. Inoltre, l’acilazione può avvenire anche in posizione 5.
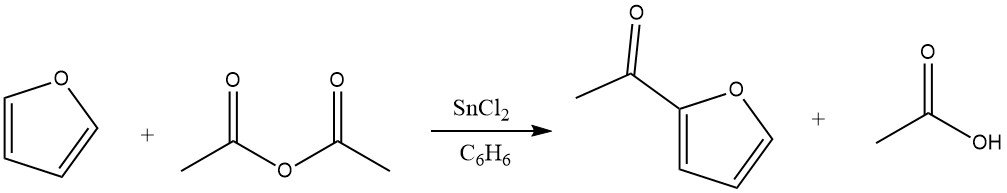
4.2. Acilazione del tiofene
La reattività del tiofene può essere paragonata a quella dell’anisolo. Il tiofene può essere efficacemente acilato, producendo alte rese dei prodotti desiderati, quando gli alogenuri acilici vengono utilizzati in presenza di SnCl4 o le anidridi vengono impiegate con acido fosforico o ZnCl2 come agente acilante.
4.3. Acilazione del pirrolo
L’acilazione del pirrolo può avvenire anche in assenza di catalizzatori, sebbene ZnCl2, BF3 e AlCl3 siano comunemente utilizzati insieme alle anidridi come agenti acilanti. Generalmente, l’acilazione avviene nella posizione 2 dell’anello pirrolico, ma è fattibile anche la 2,5-diacilazione. Tuttavia, la 3-acilazione si osserva solo quando entrambe le posizioni 2 e 5 sull’anello pirrolico sono bloccate.
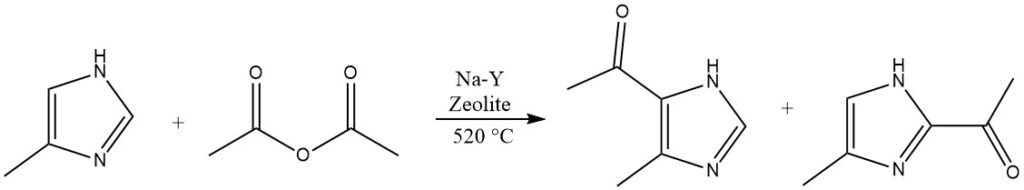
4.4. Acilazione di imidazoli
Gli eterocicli che sono altamente disattivati e non possono essere acilati in fasi liquide omogenee, come l’imidazolo o i pirazoli, sono in grado di reagire su Na-Y-zeoliti a temperature elevate superiori a 500 °C.
4.5. Acilazione dei benzofurani
Gli eterocicli altamente reattivi possono subire acilazioni utilizzando zeoliti in un processo continuo in fase liquida. Ad esempio, l’acilazione del 2-metilbenzofurano con anidride acetica è un esempio rappresentativo:
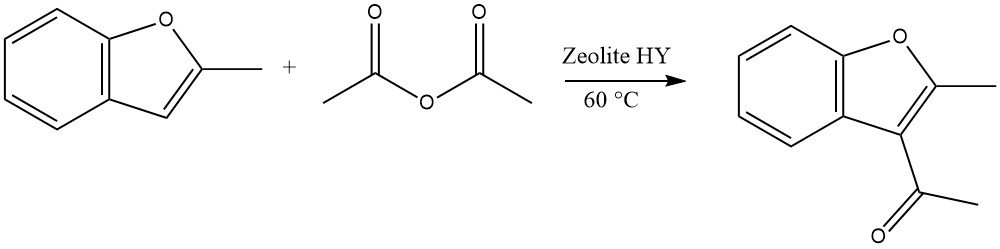
Nel caso di dibenzofurano e dibenzotiofene, l’acilazione o la diacilazione possono verificarsi in posizione 2 o 8. Per il carbazolo, l’acilazione o la diacilazione si verificano in genere in posizione 3 o 6.
4.6. Varie
I 4H-pironi sostituiti hanno dimostrato eccellenti rese nelle reazioni di acilazione quando l’acido trifluoroacetico viene utilizzato come catalizzatore. In particolare, sono realizzabili anche reazioni di diacilazione.
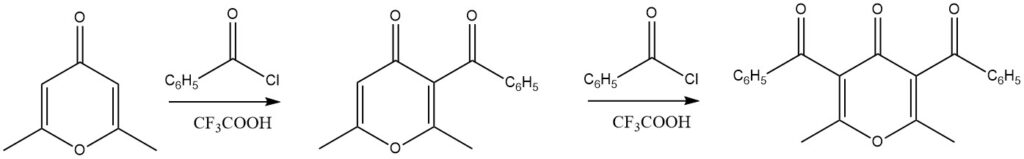
Un’ampia gamma di altri composti eteroaromatici, tra cui croman, xanteni, 1,3-benzodiossolo e dibenzodiossine, sono stati sottoposti con successo a reazioni di acilazione.
5. Acilazione di composti aromatici non benzenoidi
Il ferrocene subisce facilmente l’acilazione con alogenuri acilici in presenza di cloruro di alluminio, mostrando una reattività paragonabile ai fenoli. Anche le anidridi possono fungere da agenti acilanti. Con BF3 come catalizzatore, si può ottenere la monoacilazione del ferrocene. Quando viene utilizzato un eccesso sia di agente acilante che di cloruro di alluminio, la diacetilazione eteroanulare diventa la reazione predominante.
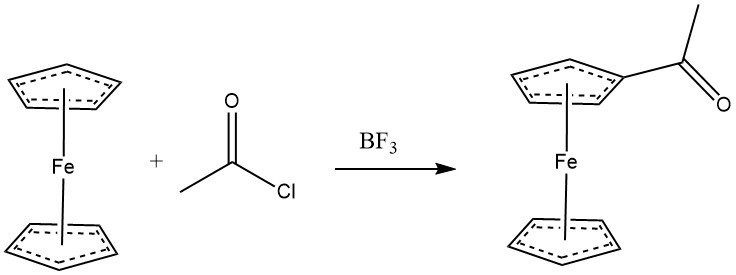
Vari derivati del ciclopentadienilico sono suscettibili di acilazione. La reattività di alcuni substrati aromatici segue questo ordine: C6H5OH•(C5H5)2Fe > C6H5OCH3 > CH3C5H4Mn(CO)3 > C5H5Mn(CO)3 > C6H6.
L’azulene reagisce dolcemente con l’anidride acetica in presenza di SnCl4 come catalizzatore, portando all’acilazione della parte ciclopentadienilica e dando origine a 1-acetilazulene. In condizioni più rigorose e in presenza di AlCl3 o SnCl4, si forma 1,3-diacetilazulene utilizzando cloruro di acetile o anidride acetica come agente acilante.
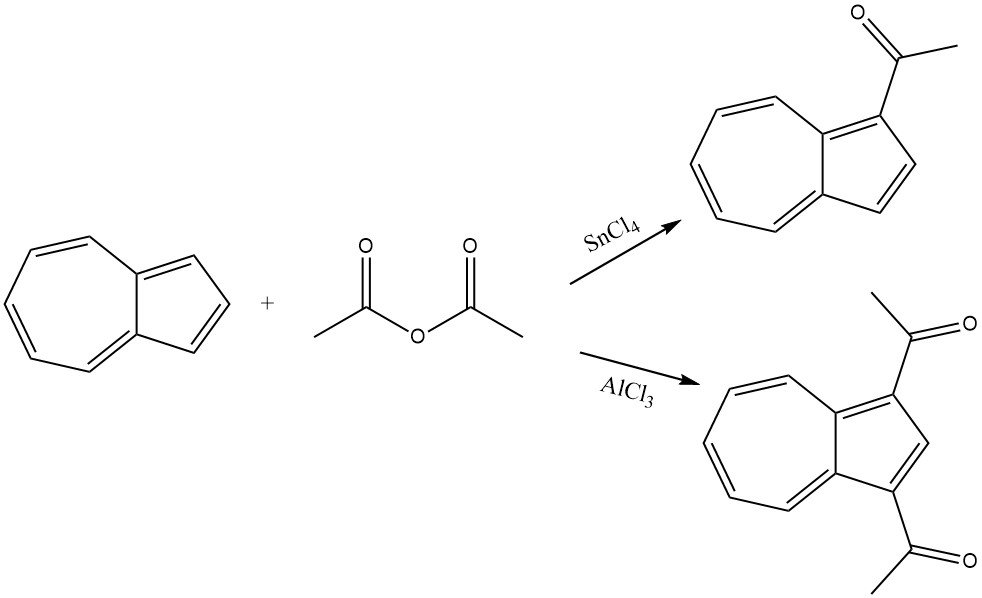
6. Reazioni di acilazione varie
Tra le numerose reazioni che portano a prodotti di C-acilazione aromatica, le reazioni di formilazione, la sintesi di Houben-Hoesch e il riarrangiamento di Fries sono particolarmente significative.
6.1. Formilazione
La formilazione di composti aromatici è un tipo specifico di reazione di acilazione che si verifica quando un alogenuro di formile o un’anidride formica reagisce con un composto aromatico in presenza di un catalizzatore di Friedel-Crafts, come AlCl3. Tuttavia, l’applicazione di questa reazione è limitata a causa dell’instabilità della maggior parte degli agenti formilanti.
La sintesi di Gattermann-Koch utilizza una miscela di cloruro di idrogeno e monossido di carbonio con AlCl3 e cloruro di rame (I) come agente formilante per composti aromatici. Il benzene, così come i benzeni sostituiti o gli aromatici policiclici, subiscono formilazione per produrre aldeidi aromatiche, con una preferenza per gli isomeri para.
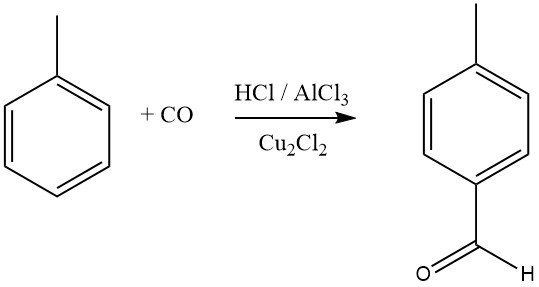
I composti aromatici con sostituenti meta-orientanti non reagiscono in questo processo di formilazione. Mitsubishi Gas Chemical sta esplorando una sintesi Gattermann-Koch modificata per la sintesi industriale dell’acido tereftalico.
In questo processo, il toluene reagisce con CO e HF-BF3 per produrre p-tolualdeide ad alta resa, che viene poi ossidata ad acido tereftalico. Studi recenti suggeriscono che l’agente acilante effettivo in queste reazioni è [CHO]+, formato dalla protonazione di CO o dei suoi complessi.
Per la sintesi dell’aldeide di Vilsmeier, i substrati aromatici ed eterociclici vengono formilati reagendo con dialchil- o arilalchilformammidi in presenza di POCl3. Questa reazione consente la formilazione di una varietà di composti, tra cui composti aromatici polinucleari reattivi, eteri fenolici, dialchilammine e N-eterocicli come pirrolo e indolo.
La regioselettività della formilazione segue i principi delle reazioni di Friedel-Crafts, che in genere portano alla formazione di composti aromatici 4-sostituiti. Inoltre, i substrati aromatici possono essere formilati utilizzando diclorometil metil etere o trialchil ortoformiato in presenza di TiCl4 o AlCl3, rispettivamente.
6.2. Sintesi di Houben-Hoesch
La sintesi di Houben-Hoesch, strettamente correlata alla reazione di Gattermann, comporta l’acilazione di substrati aromatici reattivi come fenoli, eteri fenilici, pirroli, tiofeni e indoli utilizzando nitrili. Queste reazioni avvengono in presenza di acido cloridrico e cloruro di zinco.
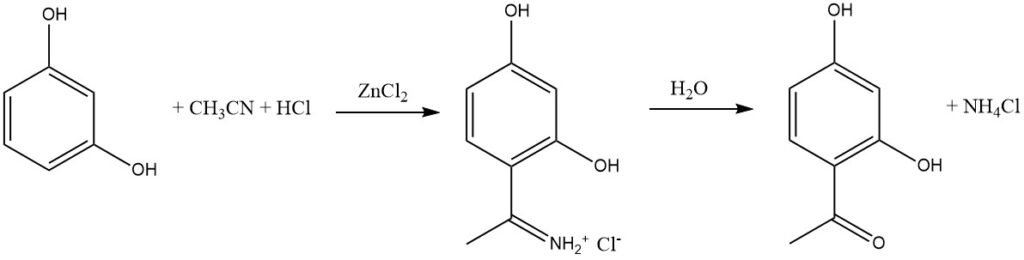
In questa sintesi, l’elettrofilo attivo è lo ione imminio, che si forma aggiungendo HCl al nitrile e poi complessato dall’acido di Lewis (ZnCl2). Questo ingombrante intermedio porta prevalentemente all’acilazione nella posizione 4 del substrato aromatico piuttosto che nella posizione 2.
Rispetto all’acilazione di Friedel-Crafts con alogenuri o anidridi aciliche, la sintesi di Houben-Hoesch è spesso un metodo più semplice per acilare i fenoli attivati.
6.3. Riarrangiamento di Fries
Il riarrangiamento di Fries degli esteri arilici, che può essere preparato tramite l’acilazione dei fenoli, è un metodo prezioso per sintetizzare chetoni fenolici utilizzati nella produzione di prodotti chimici fini. Questa reazione è ampiamente utilizzata nell’industria farmaceutica per la sintesi di farmaci come adrenalina, sinefrina, bufenina e acebutololo.
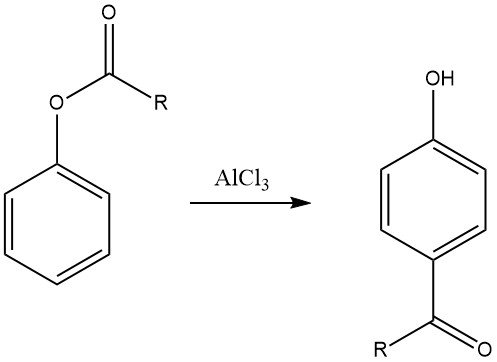
La regioselettività del riarrangiamento di Fries può essere controllata regolando le condizioni di reazione. In genere, la sostituzione para è favorita a basse temperature, mentre la sostituzione orto è favorita a temperature elevate. Tuttavia, anche la scelta del solvente e il tipo e la quantità di catalizzatori influenzano la regioselettività.
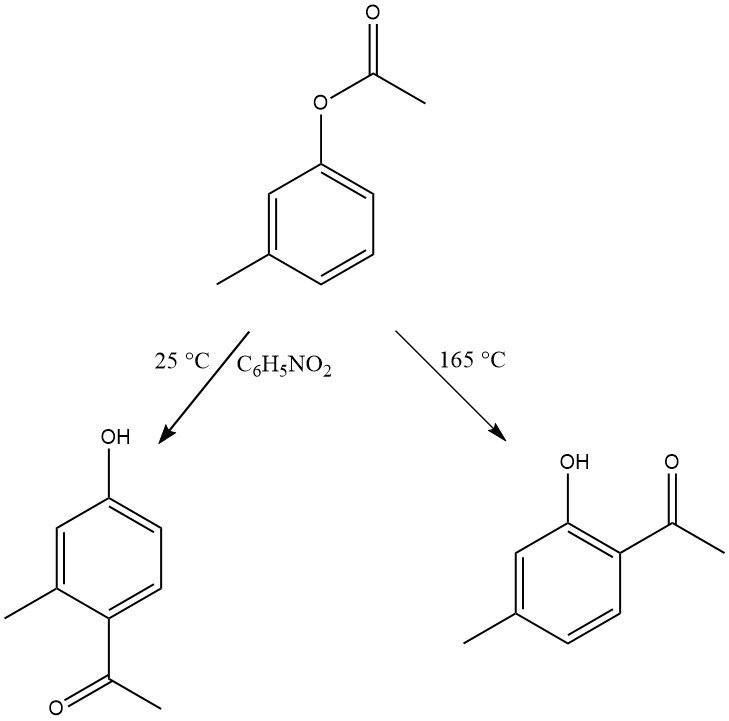
Un’ampia gamma di substrati con varie sostituzioni sia nelle frazioni fenoliche che acide può subire questa riorganizzazione. Anche i derivati fenolici con gruppi elettronattrattori, come il gruppo nitro, così come naftolo e idrossi- o diidrossifenil esteri, sono reattivi in questa trasformazione.
Anche le N-acilaniline possono essere riorganizzate per produrre 4-acilaniline a temperature elevate. La parte acida degli esteri può essere variata, consentendo l’uso di diversi acidi alchilici o arilici, inclusi esteri diaril dicarbossilici ed esteri di acido solfonico, che portano alla formazione di 4-idrossifenil solfoni.
AlCl3 è il catalizzatore comunemente utilizzato, sebbene anche SnCl4, TiCl4, FeCl3 e ZnCl2 siano efficaci e talvolta più convenienti. La riorganizzazione viene in genere eseguita riscaldando una miscela di esteri fenolici e il catalizzatore a temperature comprese tra 80 e 180 °C.
A seconda della reattività del substrato, la reazione può essere completata in pochi minuti o poche ore. È possibile condurre la reazione a temperature inferiori in solventi come C6H6NO2, (CH2Cl)2, CS2, C6H5Cl o etere di petrolio, ma ciò richiede tempi di reazione più lunghi.
In alternativa, la riorganizzazione può essere avviata in CS2, seguita da distillazione per rimuovere il solvente e quindi completata a temperature più elevate.
Per isolare l’isomero orto dalle miscele di prodotti, viene spesso impiegata la distillazione a vapore. D’altro canto, i prodotti volatili possono essere separati tramite distillazione frazionata e l’isomero para può essere ottenuto da miscele di prodotti non volatili tramite cristallizzazione.
Riferimento
- Acylation and Alkylation; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_185
