Acido Mandelico: Proprietà, Produzione e Usi
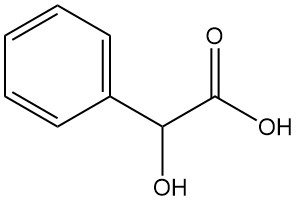
Cos’è l’acido mandelico?
L’acido mandelico, noto anche come acido α-idrossifenilacetico o acido fenilglicolico, è un alfa-idrossiacido aromatico con formula chimica C8H8O3. Si presenta come una polvere cristallina bianca dal leggero odore dolciastro.
L’acido mandelico fu scoperto per la prima volta nel 1831 dal farmacista tedesco Ferdinand Ludwig Winckler. Lo isolò riscaldando l’amigdalina, un composto presente nelle mandorle amare, con acido cloridrico diluito.
Il nome “acido mandelico” deriva dalla parola tedesca “Mandel”, che significa mandorla.
Sommario
1. Proprietà fisiche dell’acido mandelico
L’acido racemico (R,S)-mandelico è un solido cristallino incolore, facilmente solubile in etanolo ed etere dietilico, meno solubile in cloroformio e insolubile in etere di petrolio. Le soluzioni alcaline dissolvono l’acido mandelico nei sali corrispondenti.
L’acido racemico (R,S)-mandelico può essere separato nei suoi enantiomeri per reazione con cinconina in soluzione acquosa, che porta alla precipitazione dell’acido (S)-(+)-mandelico come sale, mentre l’acido (R)-(-)-mandelico rimane in soluzione.
In alternativa, l’utilizzo di S-(+)-amminodiolo per il processo di risoluzione porta alla cristallizzazione dell’acido (R)-(-)-mandelico, lasciando l’enantiomero (S)-(+)- in soluzione.
La Tabella 1 riassume le proprietà fisiche dell’acido mandelico.
| Proprietà | Acido (R,S)-mandelico | Acido (R)-(-)-mandelico |
|---|---|---|
| Numero CAS | [611-72-3] | [611-71-2] |
| Formula chimica | C8H8O3 | C8H8O3 |
| Peso molecolare | 152,15 g/mol | 152,15 g/mol |
| Punto di fusione | 118-121 °C | 132-135 °C |
| Punto di ebollizione | 321,8 °C | |
| Densità | 1,30 g/cm3 | |
| Indice di rifrazione | 1,5204 | |
| Solubilità in acqua | 15 g/100 mL | |
| pKa | 3,41 | |
| Punto di infiammabilità | 163 °C | |
| Rotazione specifica (c = 5) | [α]D20 = da -154 a -157° |
2. Reazioni chimiche dell’acido mandelico
L’acido mandelico assume una colorazione marrone se esposto alla luce. Reagisce con le basi formando sali, come il mandelato di sodio.
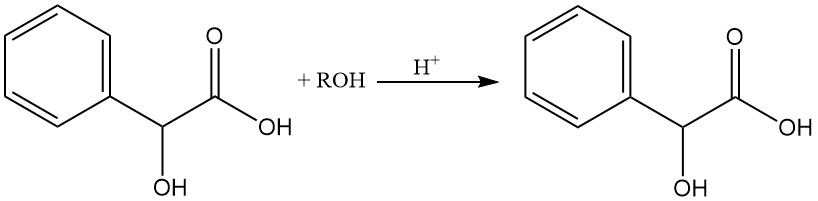
L’acido mandelico può essere esterificato facilmente con alcoli in presenza di acido cloridrico.
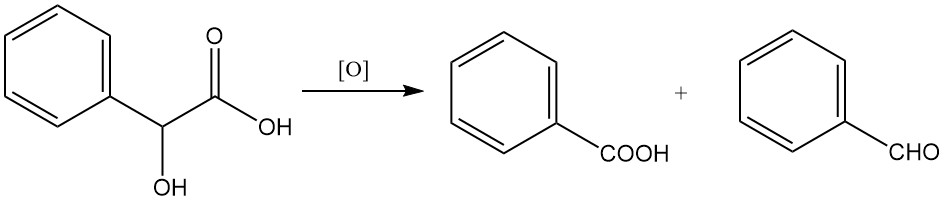
L’ossidazione con agenti ossidanti forti come il permanganato di potassio o l’acido cromico può portare alla formazione di benzaldeide o acido benzoico.
In condizioni specifiche, l’acido mandelico può essere decarbossilato per formare benzene.
L’acido mandelico può subire le tipiche reazioni di sostituzione aromatica come alogenazione, alchilazione, acilazione, nitrazione e solfonazione.
3. Produzione dell’acido mandelico
L’acido racemico (R,S)-mandelico viene prodotto per idrolisi del mandelonitrile con acido cloridrico.
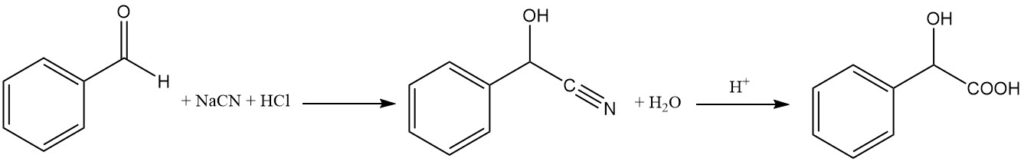
Il mandelonitrile viene preparato mediante la reazione di benzaldeide e acido cianidrico nascente (NaCN + HCl) a una temperatura inferiore a 10 °C. Il bisolfito di sodio viene utilizzato come catalizzatore. Il mandelonitrile risultante è un liquido oleoso che viene separato dalla fase acquosa.
Il mandelonitrile ottenuto viene trattato con acido cloridrico concentrato a temperatura ambiente per circa 12 ore, dopodiché l’acqua e l’acido cloridrico in eccesso vengono evaporati. Questo passaggio porta alla formazione di acido mandelico grezzo.
L’acido mandelico grezzo viene purificato mediante estrazione con benzene o etere. Il residuo solido contenente acido mandelico viene estratto più volte con benzene o etere caldi e cristallizzato per raffreddamento.
La resa tipica di acido mandelico puro è di circa il 50-52% rispetto alla benzaldeide.
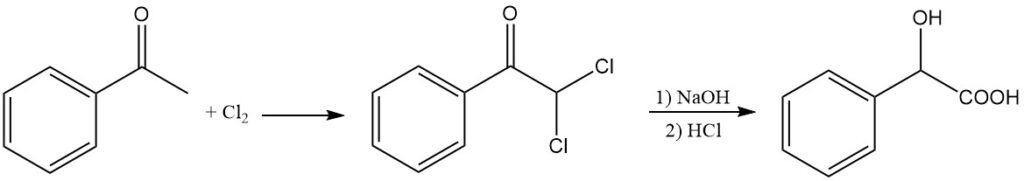
L’acido mandelico può essere sintetizzato in alternativa mediante idrolisi alcalina dell’α,α-dicloroacetofenone. L’acetofenone viene fatto reagire con cloro per produrre dicloroacetofenone, che subisce idrolisi alcalina con idrossido di sodio a 65 °C, seguita da acidolisi con HCl.
L’acido (R)-mandelico può essere prodotto mediante un processo di biosintesi che utilizza stirene, L-fenilalanina, glicerolo o glucosio come materiali di partenza. Combinando più passaggi enzimatici, l’acido (R)-mandelico può essere prodotto in modo efficiente da queste materie prime rinnovabili.
Inoltre, l’integrazione della biosintesi della L-fenilalanina nel processo consente la conversione diretta di glucosio o glicerolo in acido (R)-mandelico all’interno di un singolo organismo. Questo metodo biocatalitico offre un’alternativa promettente ai tradizionali metodi di sintesi chimica, ma è ancora in fase di sviluppo.
4. Usi dell’acido mandelico
L’acido mandelico è utilizzato principalmente per produrre i suoi esteri, che sono agenti analgesici, antireumatici e spasmolitici. Ad esempio, il cis-3,5,5-trimetilcicloesil mandelato è utilizzato come agente spasmolitico e vasodilatatore. L’estere tropinico dell’acido mandelico (omatropina-HBr) è utilizzato in oftalmologia per la dilatazione pupillare.
L’esametilentetrammina mandelato, nota anche come mandelammina, mandropina, diuramina o esidalina, è impiegata nel trattamento delle infezioni del tratto urinario.
L’acido mandelico è utilizzato anche nella cura della pelle per il trattamento dell’acne, l’esfoliazione, l’iperpigmentazione, l’anti-invecchiamento e il miglioramento della texture cutanea.
L’acido mandelico ha proprietà batteriostatiche ed è impiegato nel trattamento delle infezioni del tratto urinario. Somministrato per via orale come sali di ammonio o di calcio, inibisce efficacemente la crescita di batteri Gram-negativi e di alcuni microrganismi Gram-positivi.
Un’attività antimicrobica ottimale si osserva in condizioni di urina acida (pH inferiore a 5,5). Una soluzione di acido mandelico all’1% viene utilizzata come soluzione di lavaggio per la manutenzione dei cateteri urinari a permanenza.
5. Tossicologia dell’acido mandelico
Studi sulla tossicità orale acuta dell’acido mandelico nei ratti mostrano una LDLo (orale, ratto) di 3000 mg/kg.
L’inalazione di acido mandelico può causare irritazione respiratoria, con conseguente potenziale insorgenza di sintomi simil-asmatici, bronchite o pneumoconiosi in caso di esposizione prolungata. I soggetti con patologie respiratorie preesistenti sono a maggior rischio.
L’acido mandelico è un grave irritante oculare.
Il contatto cutaneo può indurre infiammazione cutanea o esacerbare una dermatite preesistente. Evitare il contatto con ferite aperte.
L’esposizione ripetuta o prolungata può provocare danni renali ed effetti cumulativi sulla salute.
Riferimenti
- Hydroxycarboxylic Acids, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_519
- Method for synthesizing mandelic acid. – https://patents.google.com/patent/CN112321410A/en
- https://bioresourcesbioprocessing.springeropen.com/articles/10.1186/s40643-021-00374-6
- https://www.orgsyn.org/demo.aspx?prep=CV1P0336
- https://pubs.rsc.org/en/content/articlelanding/2017/ra/c6ra25562k
- https://www.sciencedirect.com/science/article/abs/pii/S1075628002290072
- https://patents.google.com/patent/DE2936416A1/en
- https://www.lgcstandards.com/DE/en/Resources/Articles/Pharma_roots_mandelic_acid
- https://datasheets.scbt.com/sc-205481.pdf
