Acido L-ascorbico: proprietà, reazioni, produzione e usi
Cos’è l’acido L-ascorbico?
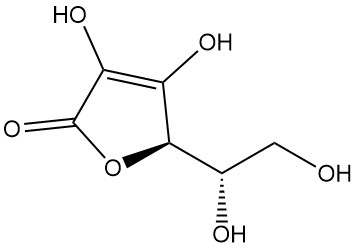
L’acido L-ascorbico, noto anche come (2R)-2-[(1S)-1,2-diidrossietil]-3,4-diidrossi-2H-furan-5-one, è la designazione IUPAC della vitamina C. Si presenta come una polvere o un cristallo bianco o inodore dal sapore acidulo, presente in natura e dotato di attività antiscorbutica, il che significa che previene lo scorbuto, una malattia causata dalla carenza di vitamina C.
L’acido L-ascorbico fu isolato per la prima volta nel 1928 e la sua struttura fu determinata cinque anni dopo. Oggi, l’acido L-ascorbico è la vitamina più prodotta a livello globale, con una produzione annua stimata di circa 150.000 tonnellate.
Una caratteristica fondamentale dell’acido L-ascorbico è la sua ossidazione reversibile ad acido deidro-L-ascorbico. Questo sistema redox consente all’acido L-ascorbico di agire come agente riducente. Tra i quattro diastereoisomeri dell’acido ascorbico, solo l’acido D-araboascorbico (noto anche come acido isoascorbico, acido eritorbico e γ-lattone dell’acido D-eritro-es-2-enoico) mostra una debole attività antiscorbutica (circa il 5% di quella dell’acido L-ascorbico).
Sommario
1. Proprietà fisiche dell’acido L-ascorbico
L’acido L-ascorbico è una polvere cristallina di colore da bianco a giallo molto chiaro, altamente solubile in acqua (1 g in 3 ml), moderatamente solubile in etanolo, glicole propilenico e glicerolo, e insolubile in etere, cloroformio, benzene, etere di petrolio, oli, grassi e solventi grassi.
Una sintesi delle proprietà fisiche dell’acido L-ascorbico è riportata nella tabella seguente.
| Proprietà | Valore |
|---|---|
| Numero CAS | [50-81-7] |
| Formula | C6H8O6 |
| Peso molecolare | 176,13 g/mol |
| Punto di fusione | 190–192 °C (decomposizione) |
| Densità | 1.65 g/cm3 |
| Rotazione ottica | [α]20H2O: da +20,5° a +21° (c = 1) |
| [α]20EtOH: +52° (c = 0,5) | |
| [α]20MeOH: +49,5° (c = 0,5) | |
| pH | 3 (5 g/L) 2 (50 g/L) |
| pK1 | 4,17 (3-OH) |
| pK2 | 11,57 (2-OH) |
| Potenziale redox | E = +0,127 V (pH=5) |
2. Proprietà chimiche dell’acido L-ascorbico
L’acido L-ascorbico esiste in almeno cinque forme tautomeriche. La forma più diffusa, il tautomero (1), rappresenta la struttura cristallina e domina in soluzioni acquose acide (pH = 2). Sia i gruppi 2-OH che 3-OH sono acidi, formando sali monobasici con le basi; tuttavia, i sali bibasici sono instabili.
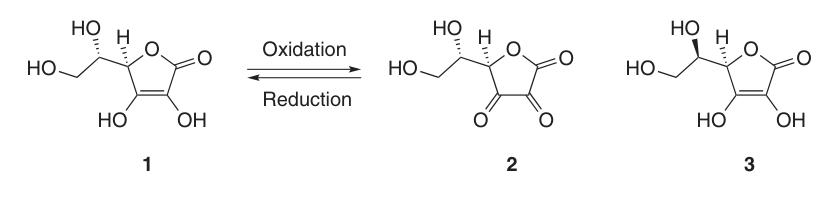
Nell’ascorbato di sodio e di calcio, lo ione metallico interagisce con l’atomo di ossigeno in posizione 3 (4a). La carica negativa del monoanione dell’ascorbato è delocalizzata all’interno del sistema π-elettronico, il che contribuisce alla stabilità del suo anello lattonico in ambienti alcalini.
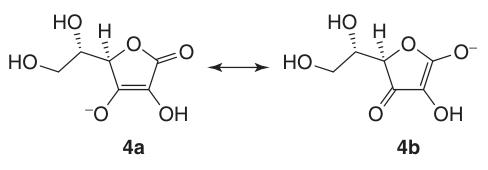
L’acido L-ascorbico subisce facilmente l’isomerizzazione ad acido L-isoascorbico tramite ebollizione in idrossido di potassio metanolico.
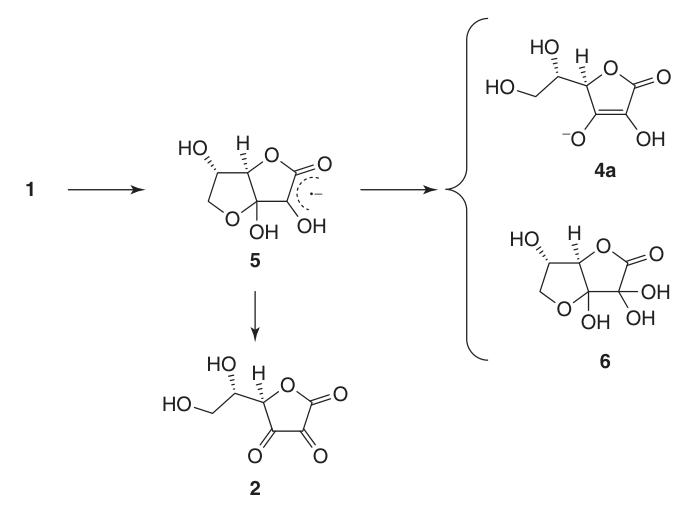
Grazie alla sua struttura enediolica, l’acido L-ascorbico agisce come un potente agente riducente. L’ossidazione dell’acido ascorbico (1) produce acido deidroascorbico (2), passando attraverso l’intermedio radicale anione, l’acido semideidroascorbico (5).
L’acido semideidroascorbico è un acido forte (pKa = 0,45) e un radical scavenger in grado di reagire con se stesso per rigenerare acido ascorbico e composto (6) o reagire con altri radicali liberi.
I metalli di transizione come Cu e Fe catalizzano l’autossidazione dell’acido ascorbico ad acido deidroascorbico (2). Questi metalli formano un complesso intermedio ternario con l’ossigeno, che si dissocia per produrre acido deidroascorbico (2), perossido di idrogeno e lo ione metallico.
Il processo di autossidazione viene accelerato a pH superiore a 7 e può essere inibito complessando gli ioni metallici con agenti chelanti come EDTA, acido metafosforico, acido citrico o acido ossalico.
Il trattamento dell’acido ascorbico con ossigeno in metanolo contenente carbone attivo forma un addotto sciropposo di metanolo che, dopo ulteriore lavorazione, fornisce acido deidroascorbico (2) come dimero cristallino con una resa del 64%.
A pH 2,5–5,5 in una soluzione acquosa e a 4 °C, il composto (2) è stabile per diversi giorni; tuttavia, agenti riducenti come acido solfidrico, ditiotreitolo o cisteina possono riconvertirlo quantitativamente in acido ascorbico.
Mentre l’acido deidroascorbico (2) mantiene l’attività della vitamina C, l’apertura irreversibile dell’anello lattonico per formare acido 2,3-dichetogulonico (8) porta alla completa perdita di questa attività.
L’acido L-ascorbico subisce degradazione in soluzioni acquose sia in condizioni aerobiche che anaerobiche. La velocità di decomposizione dipende da fattori come pH, temperatura, luce, concentrazione e presenza di catalizzatori a base di metalli pesanti.
La presenza di ossigeno accelera significativamente il processo di degradazione rispetto alle condizioni anaerobiche. I prodotti finali di ossidazione includono acido L-treonico (9) e acido ossalico. In condizioni anaerobiche, la degradazione porta alla formazione di furfurale (10) e CO2.
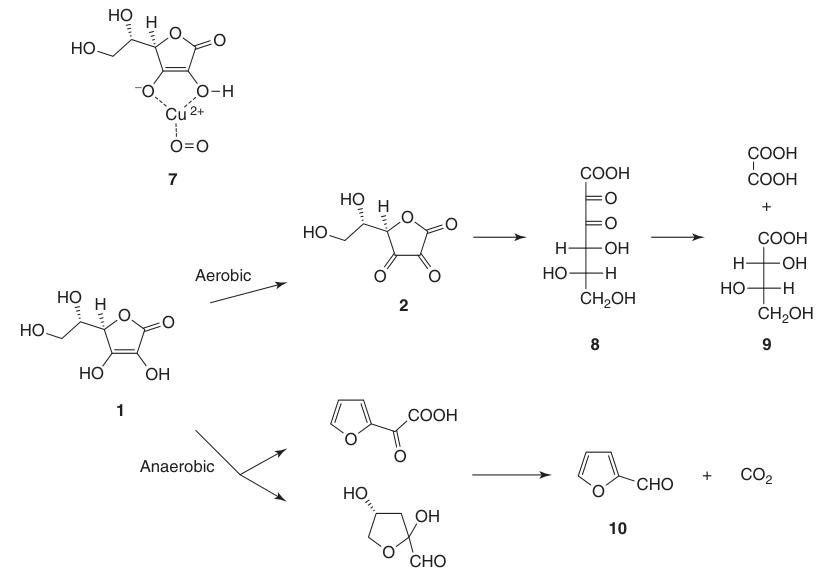
L’acido L-ascorbico solido è molto stabile a lungo in assenza di umidità e luce.
La protezione dalla degradazione ossidativa in applicazioni acquose può essere ottenuta mediante rivestimento con grassi e polimeri o mediante sostituzione chimica dei gruppi idrossilici dell’enediolo (L-ascorbato 2-solfato, L-ascorbato 2-fosfato e acido 2-O-metilascorbico).
3. Fonti naturali di vitamina C
L’acido ascorbico (vitamina C) è un composto ampiamente distribuito nelle piante e in alcuni animali. È particolarmente abbondante nelle piante verdi, con le concentrazioni più elevate osservate nei frutti tropicali e nelle foglie di gladiolo. La sua presenza nei lieviti e nei procarioti non cianobatterici rimane poco chiara.
Storicamente, durante i mesi invernali, l’assunzione di vitamina C si basava principalmente su ortaggi a radice come patate e cavoli. Oggi, con la disponibilità di frutta e verdura fresca tutto l’anno, le fonti alimentari di vitamina C sono più diversificate. Tuttavia, i processi di conservazione e cottura possono contribuire alla degradazione della vitamina C.
La distribuzione della vitamina C nei tessuti vegetali varia. In particolare, alcune piante, come le specie di Brassica e le specie di Elaeocarpus, immagazzinano la vitamina C in forme legate, note rispettivamente come ascorbigene ed elaeocarpusina.
La vitamina C è presente anche negli animali, ma a concentrazioni inferiori rispetto alle piante. I livelli più elevati si trovano negli organi endocrini dei mammiferi come i bovini (ipofisi e ghiandole surrenali).
Alcune specie animali, tra cui l’uomo, i primati, le cavie, i mammiferi volanti, alcuni uccelli, pesci e insetti, non sono in grado di sintetizzare la vitamina C e dipendono dall’assunzione alimentare.
| Gruppo alimentare | Vitamina C (mg/100 g) |
|---|---|
| Pesce | 0–4 |
| Asparagi | 7–25 |
| Carne (manzo, maiale) | 0–10 |
| Fagioli | 5–30 |
| Latte (mucca) | 1–2 |
| Broccoli | 20–100 |
| Frutta (mele, ciliegie, kiwi, arance) | 4–180 |
| Verdure (broccoli, cavoletti di Bruxelles, cavolfiore, spinaci, rape) | 20–90 |
| Ortaggi a radice (carote, patate) | 2–20 |
| Cereali (avena, segale, grano) | <1 |
| Riso | 0 |
4. Produzione industriale di acido L-ascorbico
La prima sintesi riuscita dell’acido L-ascorbico avvenne ancor prima che la sua struttura chimica completa fosse determinata. In questo processo, l’L-xilosone (11) venne fatto reagire con cianuro di potassio per formare l-xilonitrile (12), che, dopo lattonizzazione ed enolizzazione, produsse acido L-ascorbico in circa il 40%.
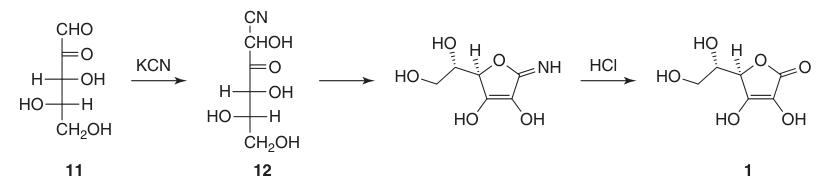
Tuttavia, uno svantaggio significativo di questa sintesi iniziale fu la difficoltà e il costo associati all’ottenimento dell’L-xilosone (11).
Fortunatamente, circa un anno dopo, Reichstein e Grüssner pubblicarono un metodo più pratico per la sintesi dell’acido L-ascorbico che utilizza il D-glucosio (13) (uno zucchero C6) facilmente reperibile come materiale di partenza, e divenne il metodo di produzione commerciale dominante per oltre 60 anni, con lievi perfezionamenti nel corso del tempo.
Dagli anni ’80, il processo di produzione ha subito un cambiamento significativo. Il sorbitolo è diventato il materiale di partenza preferito, con un’ossidazione fermentativa in due fasi utilizzata per produrre l’acido 2-chetogulonico.
Sebbene l’idrogenazione del glucosio rimanga un metodo per la produzione del sorbitolo, non viene sempre eseguita dal produttore finale di acido ascorbico.
Nonostante il passaggio alla fermentazione, il concetto generale alla base del processo moderno mantiene il suo legame con la sintesi di Reichstein originale. La differenza fondamentale risiede nell’uso dell’ossidazione microbica al posto dei metodi chimici.
4.1. Produzione di acido L-ascorbico mediante sintesi di Reichstein
La sintesi di Reichstein dell’acido L-ascorbico è una serie di reazioni chimiche semplici e ad alta resa che evitano la scissione o la formazione di legami carbonio-carbonio.
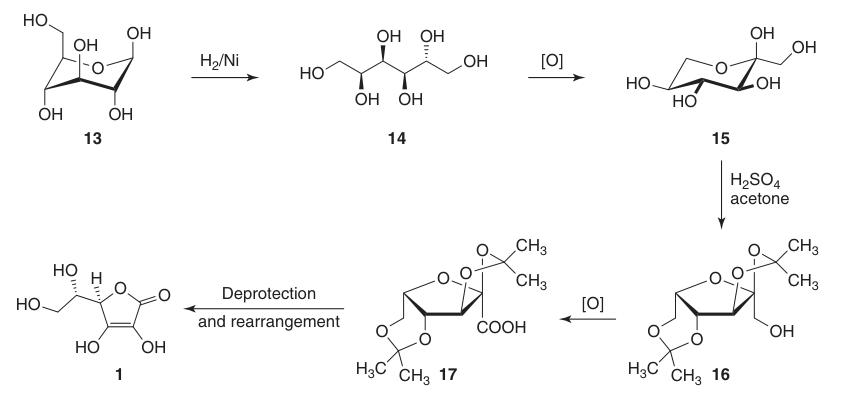
Riduce la posizione C-1 del D-glucosio (13) e ossida le posizioni 5 e 6, mantenendo la chiralità in C-2 e C-3. Questo porta infine alla configurazione L-treo desiderata in C-4 e C-5 nel prodotto finale.
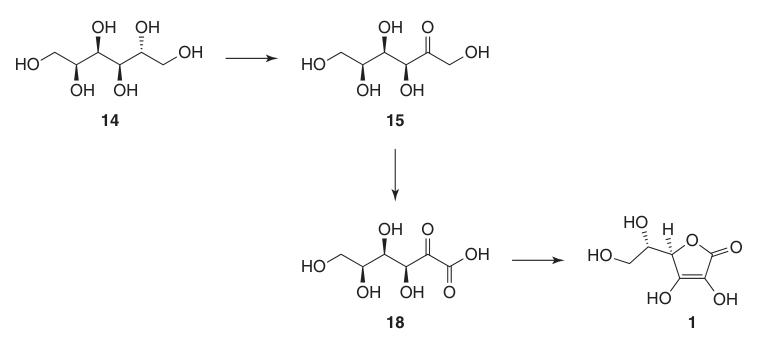
La sintesi classica di Reichstein-Grussner inizia riducendo il D-glucosio (13) a D-sorbitolo (14) mediante idrogenazione su un catalizzatore al nichel. Il D-sorbitolo viene ossidato microbiologicamente a L-sorbosio (15) dal batterio Acetobacter xylinum.
L’L-sorbosio (15) viene trattato con acetone e acido solforico a basse temperature per formare l’intermedio protetto 2,3:4,6-di-O-isopropilidene-α-L-sorbofuranosio (16).
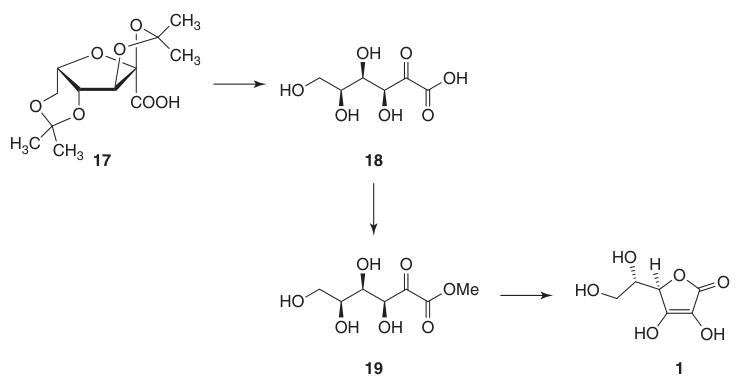
Questa protezione dei gruppi ossidrilici in C-2, C-3, C-4 e C-6 consente l’ossidazione ad alta resa ad acido di-O-isopropilidene-2-chetogulonico utilizzando permanganato di potassio in soluzione alcalina. La deprotezione con acqua calda produce acido 2-cheto-L-chetogulonico (18).
L’acido L-ascorbico viene prodotto riscaldando l’acido 2-cheto-L-gluconico (18) in acqua a 100 °C per ottenere una resa del 20% o per esterificazione seguita da acidificazione per ottenere una resa del 70%.
La resa complessiva di acido L-ascorbico da D-glucosio (13) con questo metodo è di circa il 15-18%.
4.2. Produzione industriale secondo il metodo Reichstein
La trasformazione del processo classico di Reichstein in un metodo commercialmente valido ha comportato una significativa ottimizzazione di ogni fase di reazione. Questi progressi hanno comportato modifiche sia tecniche che chimiche e hanno portato a rese per singola fase superiori al 90%, portando a una resa complessiva di acido L-ascorbico da D-glucosio (13) di circa il 60%.
I passaggi chiave e le ottimizzazioni sono:
1. D-sorbitolo (14)
L’idrogenazione ad alta pressione del D-glucosio (13) con un catalizzatore al nichel Raney a temperature elevate consente di ottenere rese quasi quantitative di D-sorbitolo (14) con una formazione minima di sottoprodotti come D-mannitolo e L-iditolo.
La soluzione di sorbitolo viene utilizzata direttamente nella fermentazione senza ulteriore purificazione, pertanto è necessario glucosio di partenza di alta qualità.
2. L-sorbosio (15)
L’ossidazione microbica di soluzioni sterili di D-sorbitolo (14) utilizzando ceppi come Gluconobacter oxydans produce efficacemente L-sorbosio (15) con una conversione superiore al 90%.
Le fermentazioni su larga scala richiedono un rigoroso controllo del pH (4-6), della temperatura (30-35 °C) e delle condizioni sterili per ridurre al minimo la perdita di prodotto durante l’ossidazione e la lavorazione mediante filtrazione e cristallizzazione.
3. 2,3:4,6-Di-O-isopropilidene-α-L-sorbofuranosio (16)
La protezione dei gruppi idrossilici 2,3- e 4,6-nell’L-sorbosio (15) si ottiene mediante formazione di chetali ciclici con acetone e acido solforico in eccesso come catalizzatori o agenti disidratanti a basse temperature (ad esempio, 4 °C).
Il prodotto principale è il 2,3:4,6-di-O-isopropilidene-α-L-sorbofuranosio (16), con derivati monoisopropilidenici come sottoprodotti recuperabili.
4. Acido 2,3:4,6-di-O-isopropilidene-2-cheto-L-gluconico (17)
In origine, l’ossidazione del 2,3:4,6-di-O-isopropilidene-α-L-sorbofuranosio (16) ad acido 2,3:4,6-di-O-isopropilidene-2-cheto-L-gluconico (17) utilizzava KMnO4 a temperature elevate in idrossido di sodio diluito, ottenendo circa il 90% del prodotto.
Sono state sviluppate alternative più economiche per processi continui, come l’ossidazione con ipoclorito con cloruro/solfato di nichel catalitico a 60 °C, che fornisce una resa superiore al 93%, e l’ossidazione elettrochimica utilizzando elettrodi di nichel/ossido di nichel in soluzione alcalina.
L’ossidazione con catalizzatore metallico (palladio o platino su carbone) con aria o ossigeno in soluzione alcalina è un altro metodo che offre buone rese.
5. Acido L-ascorbico (1)
La conversione dell’acido 2,3:4,6-di-O-isopropilidene-2-cheto-L-gulonico (17) in acido L-ascorbico può essere ottenuta attraverso due metodi:
- Deprotezione ad acido 2-cheto-L-gulonico (18), seguita da esterificazione con metanolo e ciclizzazione catalizzata da basi.
- Ciclizzazione diretta catalizzata da acidi dell’acido ascorbico dall’acido 2-cheto-L-gulonico protetto o deprotetto (18).
Il metodo catalizzato da basi utilizza il metil 2-cheto-L-gulonato (19), preparato dall’acido 2-cheto-L-gulonico (18) mediante reazione con metanolo in presenza di un acido. Successive reazioni con basi come il bicarbonato di sodio producono ascorbato di sodio ad alta resa.
La prima via acido-catalizzata per ottenere acido ascorbico è emersa poco dopo la scoperta del processo Reichstein.
4.3. Produzione moderna di acido ascorbico: sostituzione dell’ossidazione chimica con la fermentazione
La conversione diretta di L-sorbosio (15) in acido 2-cheto-L-gluconico (18) (2-KGA), un intermedio cruciale nella sintesi della vitamina C, è stata un importante obiettivo di miglioramento. Mentre l’ossidazione chimica con catalizzatori al platino o oro-platino ha ottenuto un certo successo, la fermentazione si è dimostrata un approccio più scalabile ed efficiente.
I primi tentativi esplorarono l’utilizzo di Gluconobacter per l’ossidazione fermentativa. Tuttavia, una svolta arrivò negli anni ’80 con la scoperta del Ketogulonicigenium vulgare da parte dell’Accademia Cinese delle Scienze.
Questo microrganismo offriva il potenziale per sostituire completamente i passaggi di ossidazione chimica nel processo di Reichstein. Oggi, praticamente tutta la produzione globale di vitamina C si basa sulla fermentazione di 2-KGA (18) da L-sorbosio (15) da parte del Ketogulonicigenium vulgare.
I passaggi iniziali di conversione da D-glucosio a L-sorbosio (15) rimangono sostanzialmente invariati rispetto al metodo Reichstein sviluppato negli anni ’30. La successiva conversione dell’L-sorbosio in acido L-ascorbico utilizza ora un processo di fermentazione in due fasi, ormai diffuso a livello mondiale:
- Il D-sorbitolo (14) disponibile in commercio viene fermentato con Gluconobacter oxydans per produrre L-sorbosio (15).
- Il brodo di L-sorbosio (15) sterilizzato subisce un’ulteriore ossidazione a 2-KGA (18) mediante una fermentazione mista che coinvolge Ketogulonicigenium vulgare e Bacillus megaterium. Bacillus megaterium svolge un ruolo di supporto, consentendo al Ketogulonicigenium, che ha un fabbisogno nutrizionale limitato, di prosperare su un terreno semplice ed economico.
Questo processo di fermentazione in due fasi consente un’ossidazione rapida ed efficiente dell’L-sorbosio (15) a 2-KGA (18), con titoli segnalati superiori a 100 g/L e rese di circa il 90% da L-sorbosio entro 40 ore.
Recenti progressi hanno eliminato la necessità di sterilizzazione intermedia dell’L-sorbosio in alcuni processi.
È stata esplorata la combinazione di entrambe le fasi di fermentazione in un unico serbatoio. Gluconobacter ossida prima il D-sorbitolo (14) a L-sorbosio (15), seguito dalla crescita del Ketogulonicigenium e dall’ossidazione dell’L-sorbosio a 2-KGA (18).
Questo approccio richiede un’attenta tempistica per prevenire l’ossidazione indesiderata del D-sorbitolo in C-1 da parte dell’enzima Ketogulonicigenium. Nonostante i risultati promettenti con titoli di 2-KGA (18) di 140 g/L e rese di conversione elevate, la fattibilità commerciale di questo processo a vasca singola rimane incerta.
Il passaggio dall’ossidazione chimica alla fermentazione ha rivoluzionato la produzione di vitamina C, offrendo un processo più efficiente, scalabile e potenzialmente più semplice.
4.4. Altri metodi per la produzione di acido ascorbico
Tutti i processi di produzione dell’acido L-ascorbico sono sintesi parziali in cui la chiralità in C-4 e C-5 deriva da zuccheri naturali, principalmente D-glucosio. La conversione da D-glucosio ad acido L-ascorbico si ottiene manipolando la stereochimica in C-4 e C-5 mediante inversione della catena carboniosa o inversione della configurazione C-5.
Storicamente, il processo Reichstein ha dominato la produzione industriale di acido L-ascorbico. Questo approccio chimico e fermentativo a più fasi è stato in seguito ampiamente sostituito dal più efficiente processo di fermentazione a 2-KGA (18).
Sebbene siano stati esplorati numerosi approcci alternativi, nessuno ha superato l’importanza economica del processo di fermentazione a 2-KGA (18). Queste alternative includono:
- Fermentazione alternativa 2-KGA (18) utilizzando microrganismi come Pseudomonas e ceppi di Gluconobacter ingegnerizzati.
- Produzione di acido L-ascorbico attraverso fasi di ossidazione e riduzione su acido D-gluconico.
- Fermentazione diretta dell’acido L-ascorbico utilizzando L-sorbosone deidrogenasi o lievito/microalghe ingegnerizzati.
- Esplorazione di opzioni più economiche come la pectina da flussi di scarti della lavorazione della frutta o amido.
- Conversioni chimiche in intermedi dell’acido L-ascorbico, come l’amido in L-gulono-1,4-lattone, per una potenziale combinazione con Biocatalisi.
L’attenzione per i progressi futuri si concentra sui processi fermentativi e biocatalitici per una produzione di acido L-ascorbico più semplice ed efficiente. Tra le aree promettenti figurano:
- Conversione biocatalitica diretta con enzimi che convertono 2-KGA (18) o L-sorbosone direttamente in acido L-ascorbico.
- Microrganismi geneticamente modificati come lieviti ingegnerizzati o microalghe.
- Materie prime alternative utilizzano materie prime più economiche e abbondanti come flussi di scarto di amido o pectina.
Nonostante il predominio del processo di fermentazione 2-KGA (18), la ricerca continua si impegna a sviluppare metodi più sostenibili, convenienti e semplificati per la produzione industriale di acido L-ascorbico.
4.5. Vitamina C da fonti naturali
Mentre la vitamina C sintetica domina il mercato grazie al prezzo accessibile e alla produzione su larga scala, dal 2010 è disponibile anche la vitamina C naturale ricavata dai frutti di acerola e rosa roxburghii, sebbene a un prezzo più elevato e con una minore capacità produttiva.
Questi frutti contengono naturalmente livelli eccezionalmente elevati di vitamina C, circa 2-3 g per 100 g di polpa.
I processi di estrazione producono prodotti con un contenuto di vitamina C che varia dal 10 al 25%, a seconda degli eccipienti aggiunti. La vitamina C naturale è commercializzata principalmente per l’alimentazione umana e per applicazioni di cura della persona.
5. Applicazioni industriali dell’acido L-ascorbico
5.1. Usi dell’acido L-ascorbico in prodotti farmaceutici e alimentari
Circa un terzo della produzione totale viene utilizzato per integratori vitaminici nell’industria farmaceutica. La parte rimanente serve principalmente come additivo per alimenti e mangimi per migliorare la qualità e la stabilità del prodotto.
L’acido L-ascorbico è un componente comune in varie formulazioni farmaceutiche, tra cui multivitaminici, compresse, sciroppi, elisir e compresse effervescenti. Le forme di dosaggio solide sono molto stabili, mentre le formulazioni liquide sono suscettibili alla degradazione e all’interazione con altri ingredienti.
L’industria alimentare rappresenta il settore applicativo più vasto, in particolare nella lavorazione di carne, frutta e farina. L’acido L-ascorbico agisce come antiossidante e vitamina essenziale, contribuendo a:
- Inibizione della formazione di nitrosammine nei salumi.
- Prevenzione dell’imbrunimento enzimatico in frutta e verdura trasformate.
- Ripristino e arricchimento del valore nutrizionale di alimenti e bevande.
- Miglioramento della qualità di farine e impasti.
- Ritardo dell’irrancidimento ossidativo di grassi e oli.
- Miglioramento della limpidezza di vino e birra.
- Effetti sinergici in combinazione con altri antiossidanti (ad es. tocoferoli).
L’acido L-ascorbico, i suoi sali e il palmitato o stearato di ascorbile sono additivi alimentari approvati nella Comunità Europea (E300 ff–304b) e classificati come GRAS (Generally Recognized As Safe) dalla FDA.
5.2. Usi dell’acido L-ascorbico nell’alimentazione animale
Sebbene non sia essenziale per polli da carne, tacchini e galline ovaiole a causa della loro produzione endogena, l’integrazione di vitamina C può avere un impatto positivo sulle prestazioni avicole migliorando l’aumento di peso, la conversione alimentare, la produzione di uova e la resistenza del guscio.
L’acido L-ascorbico contribuisce inoltre a migliorare la salute e la competenza immunitaria, in particolare in condizioni di stress (ad esempio, stress da calore), e ha effetti sinergici se combinato con la vitamina E.
La vitamina C migliora la morfologia della mucosa intestinale e protegge gli spermatozoi dai danni ossidativi nei maschi riproduttori, con conseguente aumento della fertilità.
I suini possono sintetizzare la vitamina C, ma l’efficienza dipende dall’età. I suinetti hanno una produzione limitata fino a 4-6 settimane, e possono trarre beneficio dall’integrazione per le prestazioni e la risposta immunitaria.
I pesci non possono sintetizzare la vitamina C e necessitano di assunzione tramite la dieta. L’acido ascorbico, o la sua forma più stabile, l’acido ascorbico 2-fosfato, viene utilizzato nell’acquacoltura per prevenire lo scorbuto e rafforzare il sistema immunitario.
L’integrazione alimentare con vitamina C può essere realizzata con acido ascorbico cristallino, che può essere utilizzato anche nell’acqua potabile.
Forme speciali come l’acido ascorbico rivestito in etilcellulosa o i sali di Na/Ca vengono utilizzate per i mangimi trattati con calore e umidità (pellet o estrusione).
Fare riferimento alla Tabella 3 per il fabbisogno dettagliato di vitamina C in diversi animali.
| Animale | Integrazione raccomandata |
|---|---|
| Galline ovaiole | 100-200 |
| Polli da carne da ingrasso (dall'inizio alla fine) | 100-200 |
| Polli da carne da riproduzione | 100-150 |
| Tacchini da ingrasso (dall'inizio alla fine) | 100-200 |
| Riproduttori di tacchini | 100-200 |
| Suinetti (prestarter e starter) | 100-200 |
| Riproduttori di suini | |
| Scrofe e scrofette | 200-300 |
| Verri | 200-500 |
| Vitelli | 200-500 |
| Cavalli (mg/capo/giorno) | |
| Puledri | 500-750 |
| Cavalli da corsa e da riproduzione | 1000-2000 |
| Salmone e trota | 150-250 |
| Pesce d'acqua calda (carpa e tilapia) | 150-250 |
| Orata e spigola | 150-250 |
| Gamberi | 250-500 |
| Cani | 100-200 |
| Gatti | 100-200 |
5.3. Altri usi
Fattori economici limitano l’applicazione dell’acido ascorbico in fitologia per la germinazione dei semi, la protezione dall’ozono, il supporto alla raccolta, la resistenza alle malattie e la regolazione della crescita.
Applicazioni minori esistono nell’industria dei polimeri, fotografica e cosmetica.
Riferimento
- Vitamins, 14. Vitamin C (l-Ascorbic Acid); Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.o27_o10.pub2
