Acido cianurico: proprietà, reazioni, produzione e usi
Cos’è l’acido cianurico?
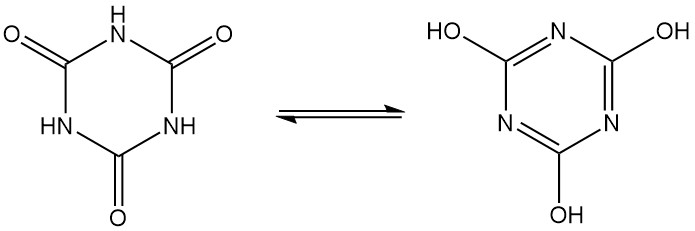
L’acido cianurico, noto anche come 1,3,5-triazina-2,4,6(1H,3H,5H)-trione, è un solido cristallino bianco inodore con formula molecolare C3H3N3O3. È un trimero ciclico che si interconverte tra diverse strutture tramite tautomeria lattame-lattim.
Sebbene l’acido cianurico sia noto dal 1776, ha acquisito importanza industriale solo negli anni ’50.
Sommario
1. Proprietà fisiche dell’acido cianurico
L’acido cianurico è un solido cristallino bianco che forma un diidrato cristallino incolore dall’acqua e perde acqua quando esposto all’aria secca. È un acido tribasico debole che è leggermente solubile in acqua e solventi organici come acetone, benzene, etere, etanolo, esano e alcol isopropilico.
La seguente tabella mostra la solubilità dell’acido cianurico in vari solventi a 25 °C (% in peso).
| Solvente | Solubilità (% in peso) |
|---|---|
| Dimetilsolfossido | 17,4 |
| Acido solforico (98% in peso) | 14,1 |
| Dimetilformammide | 7,2 |
| N-metil-2-pirrolidone | 6,3 |
| Dimetilacetammide | 3.0 |
| Piridina | 2.2 |
Le proprietà fisiche importanti dell’acido cianurico sono elencate nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Numero CAS | 108-80-5 |
| Formula | C3H3N3O3 |
| Peso molecolare | 129,07 g/mol |
| Punto di fusione | 320 – 330 °C (decomposizione) |
| Densità | 1,80 g/cm³ |
| pKa1 | 6,88 |
| pKa2 | 11,40 |
| pKa3 | 13,5 |
2. Reazioni dell’acido cianurico
L’acido cianurico reagisce con basi inorganiche e organiche per formare sali, che favoriscono l’idrossitautomero in soluzioni alcaline.
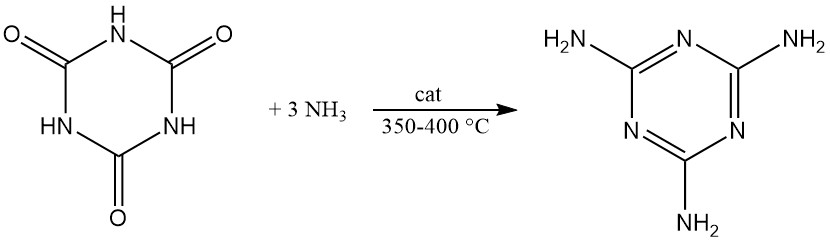
Sotto pressione e con un catalizzatore a 350–400 °C, l’acido cianurico reagisce con l’ammoniaca per produrre melammina.
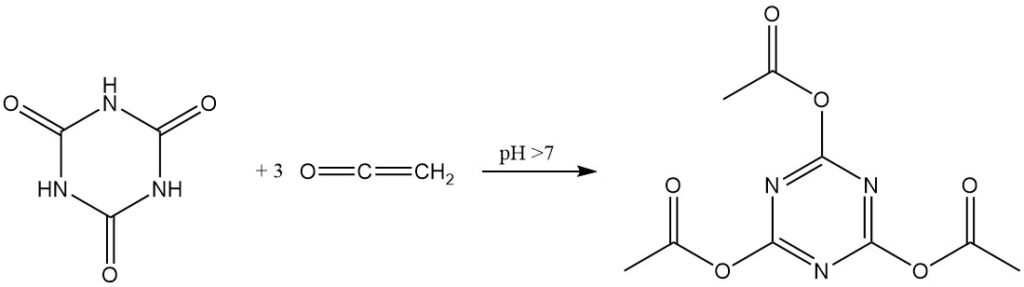
In presenza di catalizzatori alcalini, il chetene reagisce con l’acido cianurico per formare triacetilcianurato con elevata resa.
L’acido cianurico reagisce principalmente come un’immide ciclica. L’atomo di azoto isocianurato nucleofilo, spesso in forma anionica, attacca un atomo di carbonio polarizzato positivamente. Ciò porta in genere a prodotti trisostituiti.
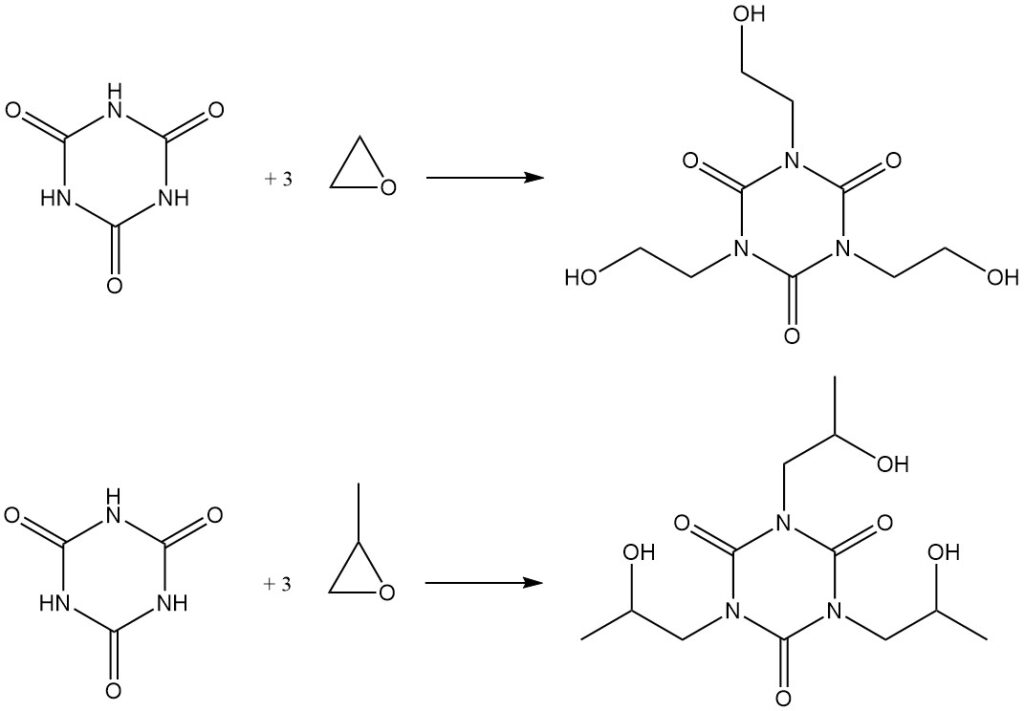
Il riscaldamento dell’acido cianurico con epossidi in DMF determina la formazione di idrossialchil isocianurati. Esempi includono la sintesi di tris (2-idrossietil) isocianurato da ossido di etilene e il corrispondente derivato idrossipropilico da ossido di propilene.
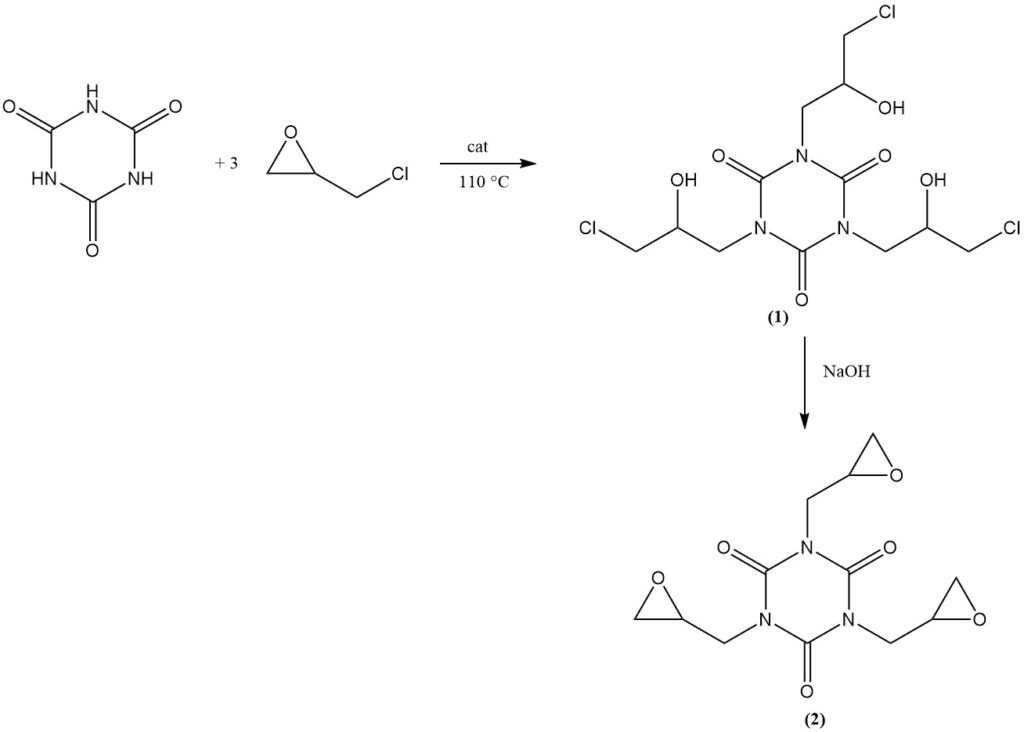
La reazione dell’acido cianurico con l’epicloridrina in presenza di un catalizzatore basico a 110 °C produce tris(3-cloro-2-idrossipropil) isocianurato (1). La successiva deidroclorurazione in una soluzione acquosa alcalina produce il prodotto commerciale tris(2,3-epossipropil) isocianurato (2).
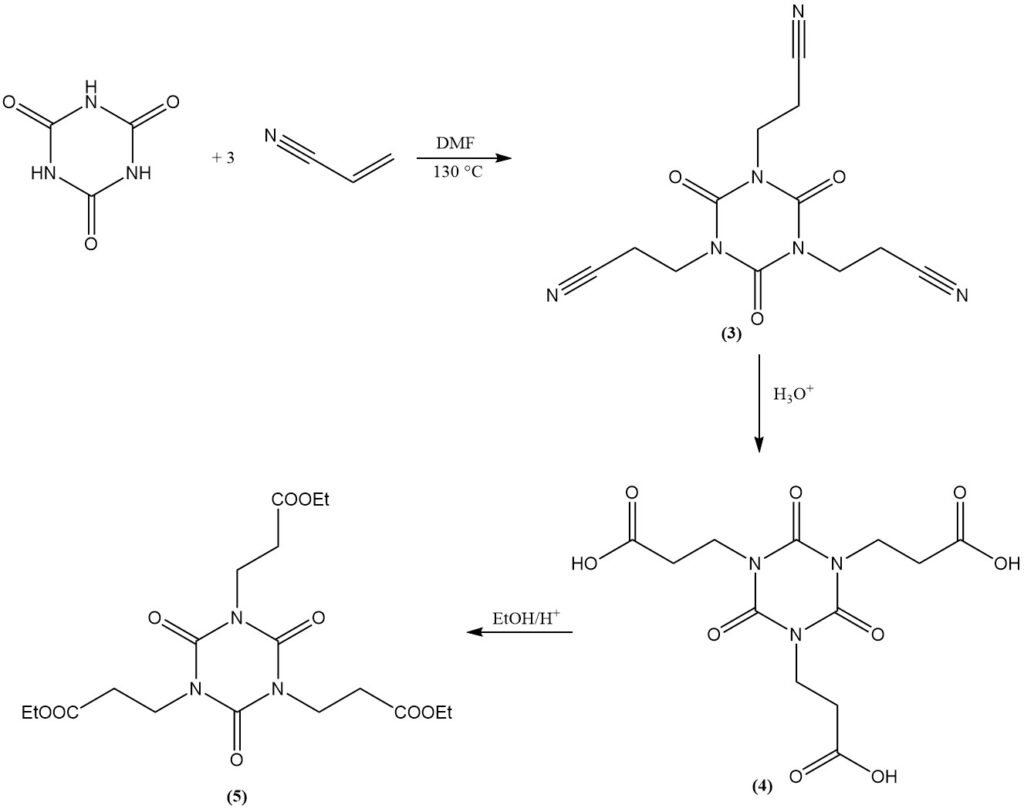
L’acido cianurico subisce reazioni di addizione con doppi legami. Un esempio è la formazione di isocianurati bis(2-cianoetile) e tris(2-cianoetile) da acrilonitrile in DMF a 130 °C. L’isocianurato di tris(2-cianoetile) (3) può essere saponificato per produrre isocianurato di tris(2-carbossietil) (4).
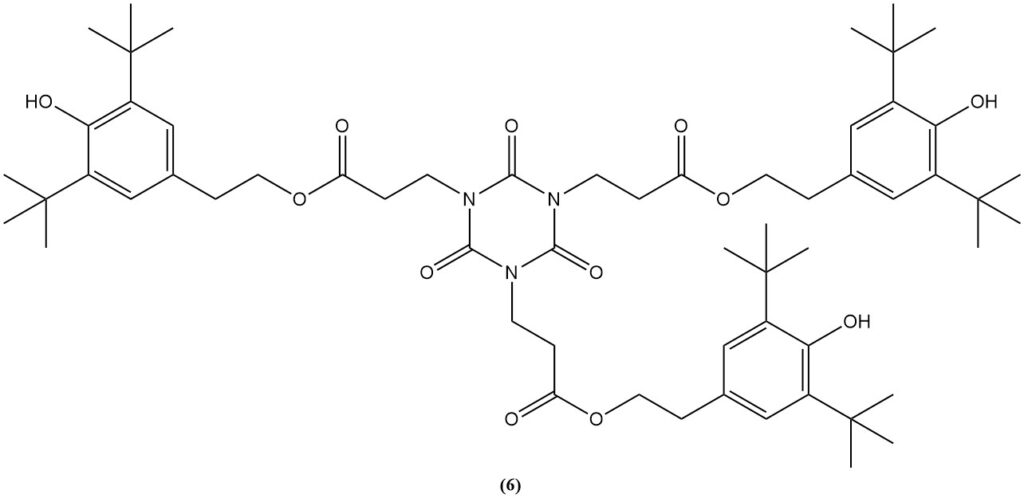
L’esterificazione del derivato carbossietilico con etanolo produce isocianurato di tris(2-carbetossietil) (5), un precursore per lo stabilizzatore alla luce commerciale e antiossidante (6).
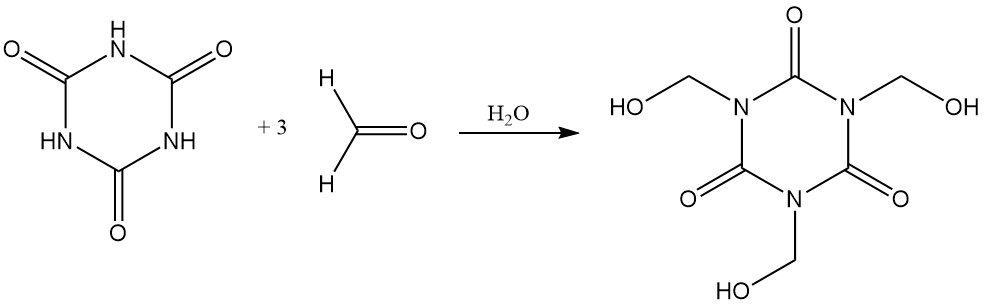
L’acido cianurico si dissolve facilmente in formaldeide acquosa formando tris (idrossimetil) isocianurato.
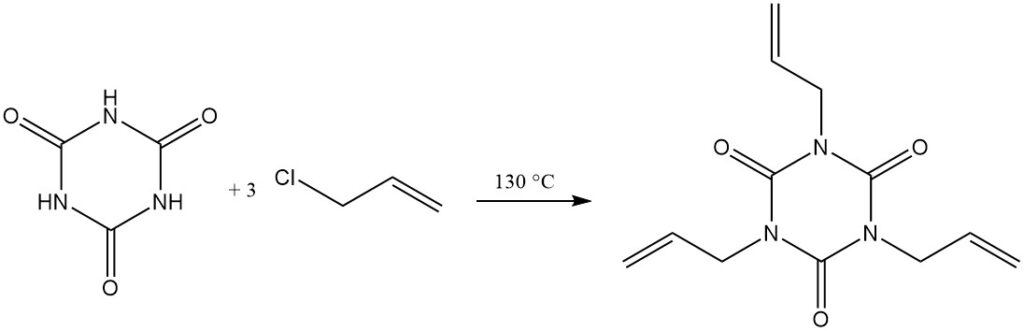
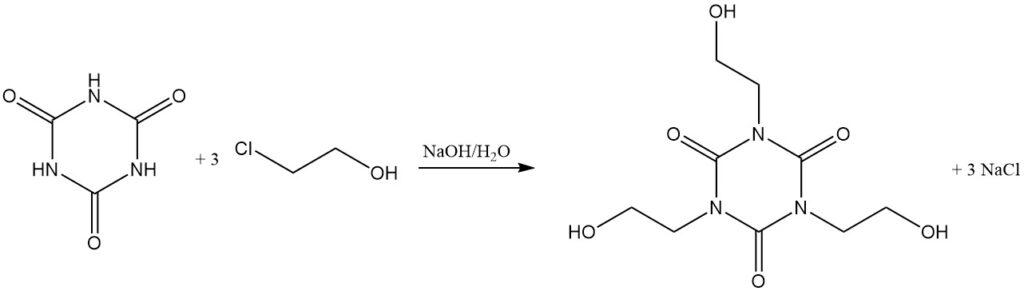
A temperature elevate e con un accettore di protoni, gli alogenuri alchilici reagiscono con l’acido cianurico. Esempi includono la reazione con cloruro di allile in diclorobenzene/trietilammina a 130 °C per formare triallil isocianurato e con 2-cloroetanolo in idrossido di sodio acquoso per formare tris (2-idrossietil) isocianurato.
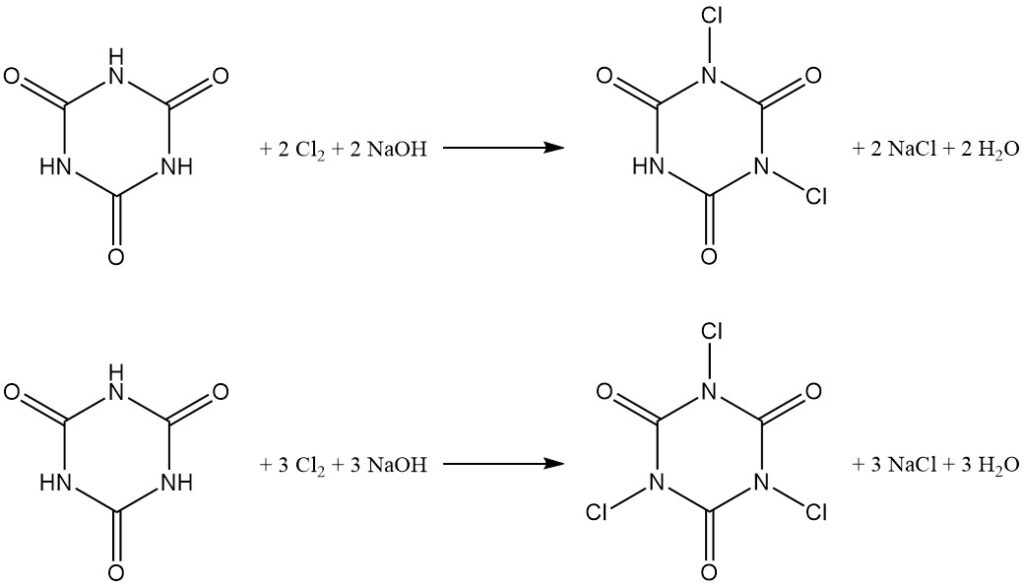
La clorurazione a pH controllato dell’acido cianurico in acqua produce derivati N,N’-dicloro e N,N’,N”-tricloro (vedere l’articolo sulle cloroammine).
La distribuzione del prodotto dipende dal rapporto molare tra idrossido di sodio e acido cianurico, con un rapporto 2:1 che favorisce l’acido N,N’-dicloroisocianurico (DCCA) e un rapporto 3:1 che favorisce l’acido N,N’,N”-tricloroisocianurico (TCCA) con una resa del 90%.
Al di sopra dei 200 °C, l’acido cianurico si decompone lentamente, accelerando al suo punto di fusione (320–330 °C). Il prodotto primario è l’acido isocianico. A temperature più elevate, le reazioni di decomposizione probabilmente comportano la scissione dell’anello tramite un intermedio di acido cianurico.
3. Produzione di acido cianurico
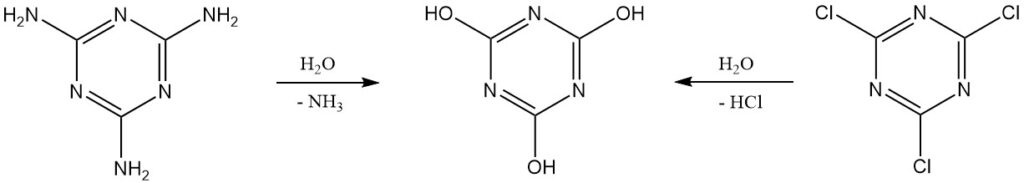
L’acido cianurico puro può essere prodotto in laboratorio mediante l’idrolisi del cloruro cianurico o della melammina. Un’ulteriore purificazione comporta la ricristallizzazione da dimetilformammide o utilizzando sali di sodio o ammonio.
L’acido cianurico viene prodotto commercialmente mediante la decomposizione termica (pirolisi) dell’urea a 200–300 °C, che genera ammoniaca come sottoprodotto.
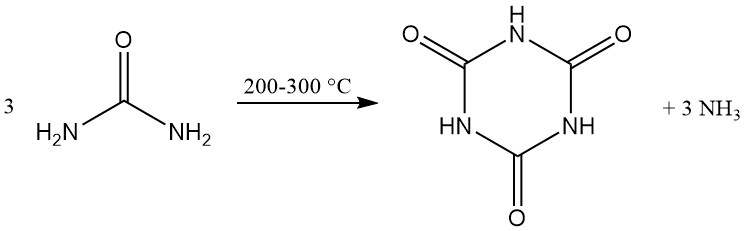
Numerosi metodi brevettati si concentrano sul miglioramento del trasferimento di calore e massa mediante la progettazione di reattori speciali o la modifica di miscele di reazione. I reattori utilizzati includono viti riscaldate, tamburi rotanti, nastri trasportatori, forni a tubo rotante e mulini a sfere.
Sono stati esplorati anche letti fluidizzati con particelle di AlF3 o cristalli di acido cianurico e riscaldamento a induzione ad alta frequenza di urea fusa.
Il problema dell’agglomerazione durante il processo viene risolto utilizzando polveri premiscelate con specifici rapporti tra urea e acido cianurico, cianurato di urea preformato o riciclando il prodotto grezzo.
Metalli o sali fusi possono essere utilizzati come mezzi di trasferimento del calore anziché il riscaldamento diretto. Solventi ad alto punto di ebollizione come eteri di poliglicole e solfolani che dissolvono l’urea ma non l’acido cianurico possono essere utilizzati per evitare il surriscaldamento localizzato e ridurre al minimo la formazione di acido isocianico.
L’acido cianurico grezzo contiene in genere fino al 30% di impurità come la melammina e i suoi precursori. I metodi di purificazione includono il trattamento acido e la separazione basata sulla solubilità.
Gli acidi minerali diluiti convertono le impurità in ammoniaca, anidride carbonica o acido cianurico stesso. Un altro metodo consiste nel disciogliere l’acido grezzo in una soluzione alcalina (NaOH o ammoniaca diluita) e quindi filtrare le impurità organiche. L’acido cianurico viene quindi precipitato aggiungendo acidi minerali.
4. Usi dell’acido cianurico
L’uso più importante dell’acido cianurico è nella produzione di isocianurati N-clorurati. Questi derivati contenenti cloro sono ampiamente utilizzati come disinfettanti e agenti igienizzanti in:
- Disinfettanti per piscine
- Candeggine per uso domestico
- Detersivi industriali e istituzionali
- Detersivi per lavastoviglie
L’acido cianurico è anche utilizzato per aiutare a stabilizzare il cloro nell’acqua delle piscine riducendone il tasso di disattivazione di un fattore di 5-10 se utilizzato a concentrazioni di 25-50 ppm.
È approvato per l’uso come fonte di azoto nei mangimi per ruminanti. L’acido cianurico è un precursore dell’acido isocianico.
Piccole quantità di acido cianurico sono utilizzate per ridurre le emissioni di NOx nei gas di scarico di motori diesel fissi e caldaie alimentate a carbone, petrolio o gas.
Diversi derivati isocianurati dell’acido cianurico sono utilizzati nell’industria della plastica. Esempi includono:
- Isocianurato di triallile: omopolimerizzato o copolimerizzato, funziona come agente di reticolazione in polietilene, cloruro di polivinile (PVC) e formulazioni di laminato.
- Isocianurato di tris(2-idrossietil): questo composto agisce come agente di reticolazione per poliuretani, poliesteri e resine alchidiche utilizzate in smalti per fili e vernici elettriche.
- Isocianurato di triglicidile: è un agente di reticolazione in resine epossidiche e un agente di indurimento per rivestimenti in polvere resistenti alle intemperie.
Il cianurato di melamina ha acquisito importanza commerciale come ritardante di fiamma privo di alogeni per resine poliammidiche. È anche utilizzato come potenziale lubrificante solido.
Il tris(2-carbossietil) isocianurato è utilizzato nella produzione di resine alchidiche idrosolubili. I suoi derivati esteri servono come plastificanti per PVC e lubrificanti.
5. Tossicologia dell’acido cianurico
L’acido cianurico è generalmente considerato un prodotto a basso rischio. È classificato come essenzialmente non tossico (orale e dermico acuto) e non irritante per la pelle e gli occhi.
Dati sulla tossicità acuta:
- LD50 (ratto, orale) > 5000 mg/kg (praticamente non tossico)
- LD50 (coniglio, dermico) > 5000 mg/kg (praticamente non tossico)
- LC50 (pesce) > 2000 mg/L (24h) (bassa tossicità)
- EC50 (Daphnia) > 2000 mg/L (bassa tossicità)
Dati sulla tossicità subacuta:
- NOEL (pesci): 1000 mg/L
- NOEL (alghe): 2500 mg/L
- Inibizione della riproduzione (Daphnia): 1000 mg/L
Sebbene l’acido cianurico abbia una bassa tossicità intrinseca, l’inalazione di polvere, il contatto con gli occhi e l’ingestione devono comunque essere evitati. Si tenga presente che si decompone in acido isocianico tossico sopra i 200 °C.
Riferimento
- Cyanuric Acid and Cyanuric Chloride; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_191
