Acetaldeide: proprietà, reazioni e usi
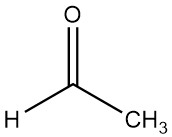
1. Cos’è l’acetaldeide?
L’acetaldeide, nota anche come etanale, è un composto chimico organico con formula CH3CHO. È un liquido volatile, bassobollente e altamente infiammabile, caratterizzato dal suo forte odore.
L’acetaldeide fu osservata per la prima volta da SCHEELE nel 1774 quando il biossido di manganese nero e l’acido solforico reagirono con l’alcol. La sua composizione fu poi spiegata da LIEBIG nel 1835, che ottenne acetaldeide pura ossidando etanolo con acido cromico.
Grazie alla sua notevole reattività chimica, l’acetaldeide svolge un ruolo importante come intermedio nella produzione di vari composti, tra cui acido acetico, anidride acetica, acetato di etile, acido peracetico, butanolo, 2-etilesanolo, pentaeritritolo, acetaldeidi clorurate (cloralio), gliossale, alchilammine, piridine e altre sostanze chimiche. La sua applicazione commerciale iniziale ha coinvolto la produzione di acetone tramite la sintesi dell’acido acetico, avvenuta tra il 1914 e il 1918 in Germania (Wacker-Chemie e Hoechst) e in Canada (Shawinigan).
L’acetaldeide è presente anche nei processi metabolici di piante e animali, sebbene in piccole quantità. Livelli più elevati di acetaldeide possono interrompere i processi biologici.
L’acetaldeide si trova naturalmente in tracce durante la fermentazione alcolica, contribuendo al sapore di bevande come birra, vino e liquori. Inoltre, è stata rilevata nei succhi vegetali, negli oli essenziali, nel caffè tostato e nel fumo di tabacco.
Per produrre acetaldeide vengono impiegati vari metodi commerciali. Tra questi rientrano la deidrogenazione o ossidazione dell’etanolo, l’aggiunta di acqua all’acetilene, l’ossidazione parziale degli idrocarburi e l’ossidazione diretta dell’etilene.
Sommario
2. Proprietà fisiche dell’acetaldeide
L’acetaldeide, con formula molecolare C2H4O e massa molare di 44,054 g/mol, è un liquido trasparente caratterizzato da un odore forte e soffocante. Quando diluito, emana un profumo leggermente fruttato.
L’acetaldeide è completamente solubile in acqua e nella maggior parte dei solventi organici. Non forma azeotropi con acqua, metanolo, etanolo, acetone, acido acetico o benzene.
Tuttavia, forma azeotropi binari con butano (punto di ebollizione -7 °C, contenente l’84% in peso di butano) ed etere dietilico (punto di ebollizione 18,9 °C, contenente il 23,5% in peso di etere).
Di seguito sono elencate alcune proprietà fisiche dell’acetaldeide:
- Punto di ebollizione a 101,3 kPa = 20,16 °C
- Punto di fusione = -123,5 °C
- Temperatura critica = 181,5 °C
- Densità relativa (t) = 0,8045-0,001325.t (t in °C)
- Indice di rifrazione (t) = 1,34240-0,0005635.t (t in °C)
- Viscosità del liquido a 20 °C = 0,21 mPa.s
3. Reazioni chimiche e usi dell’acetaldeide
L’acetaldeide è un composto notevolmente reattivo che presenta tutte le reazioni caratteristiche delle aldeidi, così come quelle associate a un gruppo alchilico in cui gli atomi di idrogeno sono attivati dalla presenza di un gruppo carbonilico in posizione α.
Quando riscaldata a temperature superiori a 420 °C, l’acetaldeide subisce una decomposizione, con conseguente formazione di metano e monossido di carbonio.
3.1. Reazioni di addizione
L’acetaldeide reagisce facilmente con l’acqua, formando un idrato instabile. Tuttavia, si sa che gli idrati solidi isolabili esistono solo con acetaldeidi clorurate. Gli alcoli possono aggiungersi all’acetaldeide, producendo emiacetali, che, in presenza di acidi e successiva rimozione di acqua, possono formare acetali quando combinati con alcol aggiuntivo.
I dioli portano alla formazione di acetali ciclici. Ad esempio, l’etilenglicole e l’acetaldeide producono 2-metil-1,3-diossolano, mentre l’1,3-propandiolo e l’acetaldeide producono 2-metil-1,3-diossano.

La reazione tra acetaldeide e soluzione acquosa di bisolfito di sodio produce un addotto cristallino, da cui può essere liberata acetaldeide.
L’ammoniaca secca reagisce con acetaldeide, dando origine a acetaldeide ammoniaca cristallina.
Acetaldeide e acido cianidrico subiscono una reazione per produrre lattonitrile (α-idrossipropionitrile), che è un potenziale intermedio nella produzione di acrilonitrile.
La reazione tra acetaldeide e anidride acetica produce diacetato di etilidene, un intermedio nel processo di acetato di vinile eseguito da Celanese Corp.
3.2. Derivati dell’addizione aldolica
In presenza di catalizzatori alcalini o con un leggero riscaldamento, due molecole di acetaldeide si combinano per formare acetaldolo. A temperature più elevate, l’acqua viene facilmente eliminata dall’acetaldolo, con conseguente formazione di crotonaldeide. Tuttavia, l’importanza industriale di un’ulteriore condensazione per formare resine aldeidiche, come la gommalacca sintetica, è diminuita.
L’urea e l’acetaldeide possono condensare in presenza di H2SO4, portando alla formazione di crotonilidendiurea (6-metil-4-ureidoesaidropirimidin-2-one), che viene utilizzata come fertilizzante azotato a lungo termine.

L’acetaldeide funge da intermedio nella sintesi del butadiene. Inizia con l’acetilene e procede attraverso l’acetaldolo e il suo prodotto di idrogenazione, 1,3-butandiolo. Questo processo è stato introdotto all’inizio del XX secolo ed è ancora praticato su scala commerciale in alcuni paesi dell’Europa orientale.
L’acroleina si ottiene tramite la condensazione aldolica di acetaldeide e formaldeide, seguita dall’eliminazione dell’acqua, simile alla formazione di crotonaldeide. Tuttavia, questo metodo non ha un significato commerciale contemporaneo. Al contrario, la produzione di pentaeritritolo da acetaldeide e una quantità quadrupla di formaldeide in presenza di Ca(OH)2 o NaOH ha una significativa importanza industriale.
3.3. Reazione con composti azotati
Le ammine primarie reagiscono con l’acetaldeide per formare basi di Schiff, rappresentate come CH3CH=NR. I composti azotati come idrossilammina, idrazina, fenilidrazina e semicarbazide possono reagire con l’acetaldeide, producendo composti facilmente cristallizzabili utilizzati per la determinazione analitica e la caratterizzazione delle aldeidi. Esempi includono semicarbazone (punto di fusione 162 – 163 °C), p-nitrofenilidrazone (punto di fusione 128,5 °C), 2,4-dinitrofenilidrazone (punto di fusione 168 °C) e ossima (punto di fusione 47 °C).
Metodi simili possono essere impiegati per la caratterizzazione di altre aldeidi e chetoni, poiché i loro derivati analoghi possiedono generalmente punti di fusione distinti e ben definiti.
La sintesi di piridina e derivati della piridina ha acquisito sempre più importanza. La 5-etil-2-metilpiridina può essere ottenuta facendo reagire l’ammoniaca acquosa con acetaldeide in presenza di ioni fluoruro. Può essere utilizzata anche la paraldeide, che rilascia gradualmente il monomero. In presenza di formaldeide o acroleina si forma una miscela di piridina e alchilpiridine.

3.4. Ossidazione
Una parte significativa dell’acetaldeide prodotta commercialmente viene impiegata nella produzione di acido acetico tramite ossidazione con ossigeno o aria.
L’acetaldeide monoperacetato è un prodotto intermedio che si decompone in acido peracetico e acetaldeide a temperature elevate e in presenza di quantità catalitiche di sali di ferro o cobalto. In presenza di sali di Mn2+, l’acido acetico può essere ottenuto dall’acetaldeide monoperacetato. Inoltre, l’anidride acetica può essere formata impiegando sali di Co2+ e Cu2+.

L’ossidazione con acido nitrico determina la formazione di gliossale, mentre le acetaldeidi alogenate possono essere preparate tramite alogenazione.
Monocloroacetaldeide, dicloroacetaldeide e tricloroacetaldeide, così come la tribromoacetaldeide (bromale), trovano utilità nella produzione di insetticidi (ad esempio, DDT, DDD), prodotti farmaceutici e coloranti.
3.5. Riduzione
L’acetaldeide può essere facilmente idrogenata per produrre etanolo. Prima del 1939, quando l’etilene prodotto petrolchimicamente divenne disponibile in Europa, questa reazione era impiegata industrialmente per produrre etanolo dall’acetaldeide e, di conseguenza, dall’acetilene.
Monoetilammina, dietilammina e trietilammina possono essere sintetizzate da acetaldeide, ammoniaca e idrogeno in presenza di un catalizzatore di idrogenazione. Per ulteriori informazioni, fare riferimento a la produzione di ammine alifatiche.
3.6. Reazioni varie
La reazione di Tishchenko dell’acetaldeide, catalizzata dall’alcolato di alluminio, determina la produzione del solvente commercialmente importante acetato di etile.
L’acetaldeide funge da “agente di intrappolamento dei radicali” nella polimerizzazione dei composti vinilici, controllando la lunghezza della catena dei polimeri.
3.7. Polimeri di acetaldeide
3.7.1. Paraldeide
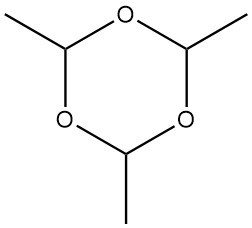
La paraldeide, 2,4,6-trimetil-1,3,5-triossano con un peso molecolare di 132,161, è un trimero ciclico dell’acetaldeide. Possiede un aspetto incolore ed emette un odore etereo e penetrante.
La paraldeide può essere sintetizzata dall’acetaldeide in presenza di catalizzatori acidi, come acido solforico, acido fosforico, acido cloridrico o scambiatori cationici acidi. In una reazione omogenea, l’acetaldeide viene aggiunta alla paraldeide contenente una piccola quantità di acido solforico con agitazione e raffreddamento.
Dopo il completamento, l’agitazione continua per stabilire l’equilibrio e l’acido solforico viene neutralizzato con precisione utilizzando un sale di sodio come acetato di sodio, carbonato di sodio o bicarbonato di sodio. La distillazione frazionata separa la miscela di reazione in acetaldeide, acqua e paraldeide.
Per la produzione continua, l’acetaldeide liquida a temperature di 15-20 °C o il vapore di acetaldeide a temperature di 40-50 °C viene fatto passare su uno scambiatore cationico acido, ottenendo un tasso di conversione superiore al 90%. La distillazione viene quindi impiegata per separare l’acetaldeide dalla paraldeide.
La depolimerizzazione comporta una lenta distillazione dell’acetaldeide in presenza di catalizzatori acidi. In alternativa, la paraldeide può essere decomposta nella fase gassosa utilizzando catalizzatori come HCl, HBr, H3PO4 o scambiatori cationici. La reazione di depolimerizzazione segue una velocità di primo ordine.
La paraldeide trova applicazioni nella sintesi chimica come fonte di acetaldeide, eliminando la formazione di resina e altre reazioni secondarie. Questa sintesi è utilizzata nella produzione di piridine e nella clorurazione del cloralio.
Tra il 1939 e il 1945, la paraldeide è stata utilizzata come carburante per motori.
3.7.2. Metaldeide

La metaldeide è il tetramero ciclico dell’acetaldeide. Forma prismi tetragonali con un punto di fusione di 246,2 °C (capillare chiuso) e una temperatura di sublimazione di 115 °C. Il calore di combustione a volume costante è di 3370 kJ/mol.
La metaldeide è insolubile in acqua, acetone, acido acetico e disolfuro di carbonio.
La depolimerizzazione della metaldeide in acetaldeide inizia a 80 °C e si completa sopra i 200 °C. Nel processo di depolimerizzazione vengono utilizzati catalizzatori acidi come H2SO4 o H3PO4 diluiti.
La metaldeide non presenta la tipica reattività dell’acetaldeide. È stabilizzata da carbonato di ammonio o altri composti debolmente basici che neutralizzano i potenziali catalizzatori acidi.
La metaldeide si ottiene, insieme a quantità significative di paraldeide, durante la polimerizzazione dell’acetaldeide in presenza di HBr e bromuri di metalli alcalino-terrosi come CaBr2 a temperature inferiori a 0 °C.
Tuttavia, le rese sono raramente superiori all’8%. Sono state segnalate rese più elevate del 14-20% quando è presente il 7-15% di un etere alifatico o ciclico a temperature comprese tra 0 e 20 °C. La metaldeide insolubile viene successivamente filtrata.
L’acetaldeide viene quindi distillata dal filtrato dopo la depolimerizzazione della paraldeide e può essere riciclata nuovamente nel processo di polimerizzazione. Tuttavia, questo riciclaggio di grandi quantità di acetaldeide comporta un aumento dei costi di processo a causa delle perdite.
La metaldeide in pellet è disponibile in commercio come combustibile secco (Meta). Quando combinata con l’esca, la metaldeide viene utilizzata come molluschicida.
3.7.3. Poliacetaldeide
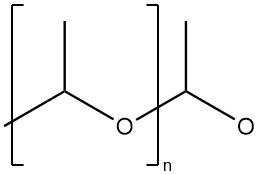
La poliacetaldeide è un polimero ad alta massa molecolare con una struttura acetalica (struttura poliossimetilene).
Utilizzando iniziatori cationici, si ottiene principalmente un polimero amorfo. In questo caso sono preferite temperature inferiori a -40 °C. Sopra -30 °C, vengono prodotte principalmente paraldeide e metaldeide.
L’attività dell’iniziatore dipende anche dal solvente utilizzato. Gli iniziatori adatti includono H3PO4 in etere e pentano, così come HCl, HNO3, CF3COOH, AlCl3 in etere e in particolare BF3 in etilene liquido. Anche Al2O3 e SiO2 sembrano essere buoni iniziatori.
Il polimero ha una consistenza simile alla gomma ed è solubile in comuni solventi organici. Si depolimerizza a temperatura ambiente, liberando acetaldeide. Evapora completamente entro pochi giorni o settimane. I composti acidi accelerano la depolimerizzazione e le ammine (ad esempio, la piridina) stabilizzano la poliacetaldeide in una certa misura.
3.8. Consumo
Negli Stati Uniti, a partire dal 1993, l’acetaldeide ha cessato di essere impiegata nei processi di produzione di acido acetico, butanolo e 2-etilesanolo, poiché ora vengono impiegati metodi alternativi per la loro produzione.
Tuttavia, la domanda di acetaldeide è aumentata per altre sostanze come l’acido peracetico e le basi piridiniche.
| Prodotti | Consumo (t) |
|---|---|
| Acido acetico/anidride acetica | 147.000 |
| Esteri acetici | 321.000 |
| Pentaeritritolo | 80.000 |
| Piridina e basi piridiniche | 83.000 |
| Peracetico acido | 23.000 |
| 1,3-butilene glicole | 14.000 |
| Altri | 98.000 |
Riferimento
- Acetaldeide; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_031.pub2
