Pyrogallol: production, réactions et utilisations

Le pyrogallol ou acide pyrogallique a été isolé pour la première fois par SCHEELE par distillation sèche de l’acide gallique (acide 3,4,5-trihydroxybenzoïque) en 1786. Les dérivés du pyrogallol sont présents dans de nombreux produits naturels, tels que le tanin, l’anthocyanine et les alcaloïdes.
Il forme des aiguilles ou folioles incolores, la couleur vire progressivement au gris foncé au contact de l’air ou de la lumière.
Table des matières
1. Production de Pyrogallol
Pyrogallolis produit commercialement par décarboxylation de l’acide gallique, qui est préparé par hydrolyse du tanin.
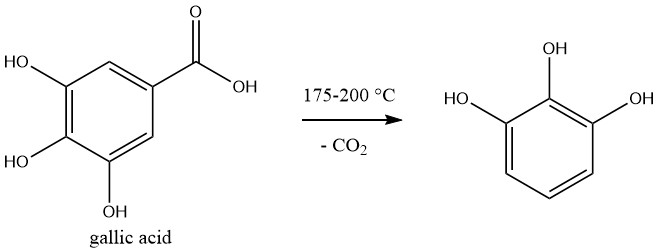
La réaction est effectuée en discontinu. Une solution aqueuse à 50 % d’acide gallique est chauffée à 175 – 200 °C dans un autoclave. Au cours de la réaction, la pression augmente jusqu’à 1,2 MPa. Une fois le dégagement de dioxyde de carbone terminé, la solution est refroidie.
La réaction se déroule quantitativement. La décoloration du mélange réactionnel avec du charbon suivi d’une distillation donne un produit brut qui est purifié par sublimation ou distillation sous vide.
Le pyrogallol est coûteux à obtenir car la matière première, l’acide gallique, est préparée à partir d’un produit naturel dont la disponibilité est limitée. Par conséquent, de nouvelles méthodes de production d’acide gallique ont été recherchées.
La condensation catalysée par une base du propane-1,2,3-tricarboxylate de triméthyle avec le diméthylcétal de l’acide mésoxalique, suivie d’une hydrolyse et d’une décarboxylation, donne de l’acide gallique avec un rendement de 74 %. La réaction du cétal et de l’ester glutarique donne du pyrogallol sans génération d’acide gallique.
D’autres méthodes de production de pyrogallol comprennent l’oxydation du résorcinol avec du peroxyde d’hydrogène, l’hydrolyse du 2,6-diamino-4-butylphénol, la déméthylation des 2,6-diméthoxyphénols substitués en 4, l’oxydation du 2,6-diméthylphénol, l’hydrolyse du 2,2, 6,6-tétrachlorocyclohexanone, désoximation du 1,2,3-cyclohexanetrion-1,3-dioxime et déshydrogénation du 1,2,3-trihydroxycyclohexane.
2. Réactions chimiques du pyrogallol
Le pyrogallol est l’agent réducteur le plus puissant parmi les polyhydroxybenzènes. La solution aqueuse basique absorbe rapidement l’oxygène gazeux pour former un précipité brun foncé.
En raison de cette propriété, le pyrogallol est souvent utilisé pour l’analyse quantitative de l’oxygène.
Les réactions du pyrogallol sont assez similaires à celles des phénols. Les groupes hydroxy sont éthérifiés et estérifiés par les procédés conventionnels pour donner des produits mono-, di- et trisubstitués.
Le chauffage du pyrogallol dans une solution aqueuse de bicarbonate de potassium donne principalement l’acide pyrogallol-4-carboxylique (acide 2,3,4-trihydroxybenzoïque); l’acide gallique est formé comme sous-produit.
La formylation, l’acylation et la réaction de Mannich produisent des cyclohexénones 4-substituées comme produit principal. La bromation avec du brome donne finalement la 1,2,6,6-tétrabromocyclohexène-3,4,5-trione.
La réaction avec le phosgène donne le carbonate de pyrogallol et avec le bromure de thionyle le 4,5,6-tribromopyrogallol.
Les réactions colorées très sensibles d’une solution aqueuse de pyrogallol avec des ions de métaux lourds sont utiles pour l’analyse quantitative des métaux. Les ions de métaux précieux (par exemple, Ag+, Au2+, Hg2+) sont réduits en métaux élémentaires.
Un complexe préparé à partir de diéthylzinc et de pyrogallol est utilisé comme catalyseur de polymérisation alternée de dioxyde de carbone et d’oxyde de propylène.
3. Utilisations du Pyrogallol
Le pyrogallol est utilisé en photographie, en lithographie et dans les teintures capillaires. Il est également utilisé comme antioxydant et stabilisant.
L’utilisation du pyrogallol dans le domaine des cosmétiques et des médicaments est actuellement en déclin en raison de sa toxicité prononcée.
Les références
- Phenol Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a19_313
