Cyclohexanone : propriétés, réactions, production et utilisations
Qu’est-ce que la cyclohexanone ?
La cyclohexanone, également connue sous le nom de cétohexaméthylène ou cétone pimélique, est un composé organique de formule chimique C6H10O. C’est un liquide incolore à jaune pâle avec une odeur similaire à celle de l’acétone qui est très soluble dans la plupart des solvants organiques.
Elle a d’abord été synthétisée par distillation sèche du pimélate de calcium, puis par Bouveault par déshydrogénation catalytique du cyclohexanol.
La cyclohexanone est produite industriellement à grande échelle comme matière première pour la fabrication du nylon.
Table des matières
1. Propriétés physiques de la cyclohexanone
La cyclohexanone est un liquide incolore dont l’odeur rappelle celle de la menthe poivrée et de l’acétone. Elle est très soluble dans le méthanol, l’éthanol, l’acétone, le benzène, le n-hexane, le nitrobenzène, l’éther diéthylique, le naphta, le xylène, l’éthylène glycol, l’acétate d’isoamyle, la diéthylamine et la plupart des solvants organiques.
La cyclohexanone peut dissoudre une variété de produits, tels que le nitrate de cellulose, l’acétate de cellulose, les éthers de cellulose, les résines vinyliques, le caoutchouc brut, les cires, les graisses, la gomme laque, les colorants basiques, les huiles, le latex, le bitume, le kaure et l’élémi. Elle forme un azéotrope avec l’eau qui bout à 96,6 °C avec une composition eau:cyclohexanone de 56:44.
Les propriétés physiques de la cyclohexanone sont présentées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [108-94-1] |
| Formule chimique | C6H10O |
| Poids moléculaire | 98,15 g/mol |
| Point de fusion | -47 °C |
| Point d'ébullition point | 156,4 °C |
| Pression de vapeur | 0,52 kPa à 20 °C |
| Densité | 0,9455 g/cm3 |
| Indice de réfraction | 1,4552 |
| Coefficient de dilatation | 9,14 × 10-4 |
| Viscosité dynamique | 1,803 mPa · s à 30 °C |
| Chaleur spécifique | 1,811 j/g |
| Tension superficielle | 33,51 mN/m à 30 °C |
| Chaleur de fusion | 1,501 kJ/mol |
| Chaleur de combustion | -3,521 MJ/mol |
| Chaleur de vaporisation | 44,92 kJ/mol |
| Chaleur de formation | -272 kJ/mol |
| Point d'éclair | 54 °C |
| Température d'auto-inflammation | 420 °C |
| Solubilité dans l'eau à 20 °C | 9,0 g/100 g d'eau |
2. Réactions de la cyclohexanone
En raison de la présence d’un groupe carbonyle, la cyclohexanone subit une variété de réactions typiques des cétones aliphatiques. Environ 0,02 % de la molécule existe dans le tautomère énol à température ambiante.
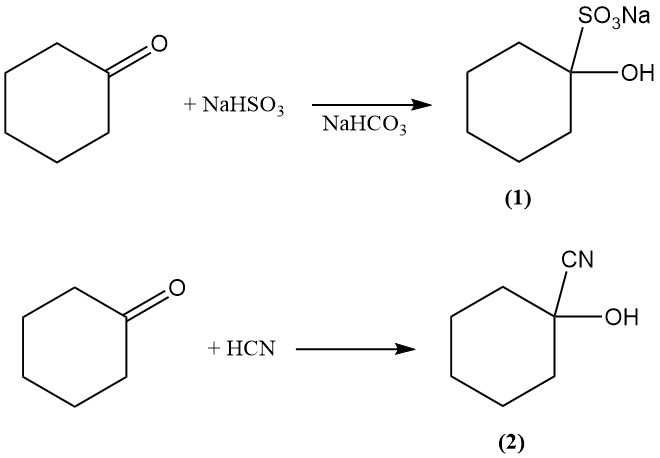
La réaction d’addition de la cyclohexanone avec le bisulfite et le cyanure d’hydrogène produit respectivement du 1-hydroxycyclohexane-1-sulfonate (1) et du 1-hydroxycyclohexane-1-carbonitrile (2).
La réaction de Grignard forme des alcools tertiaires après hydrolyse.
L’hydrogénation ou la réduction catalytique de la cyclohexanone à l’aide de borohydrure de sodium ou d’hydrure d’aluminium et de lithium donne du cyclohexanol, tandis que des conditions plus rigoureuses forment du cyclohexane.
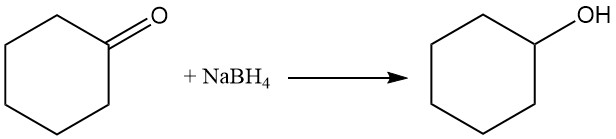
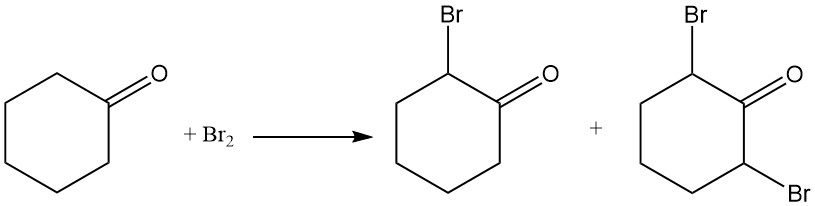
La cyclohexanone réagit avec le chlore ou le brome pour former des composés halogénés en position α ou en positions 2 et 6.
Il peut facilement subir une condensation aldolique catalysée par une base avec lui-même ou avec d’autres aldéhydes ou cétones.
La cyclohexanone forme des énamines lorsqu’elle réagit avec des amines secondaires.
Les réactions industrielles importantes de la cyclohexanone sont la formation d’oxime de cyclohexanone par réaction avec l’hydroxylamine et l’oxydation avec l’acide nitrique en acide adipique.
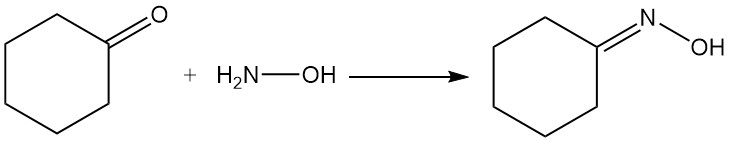
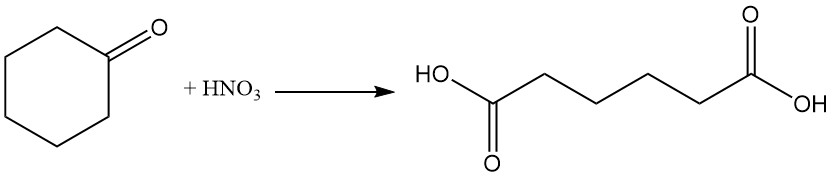
3. Production industrielle de cyclohexanone
La cyclohexanone est produite commercialement par les principaux procédés suivants :
- Déshydrogénation du cyclohexanol
- Oxydation du cyclohexane
- Hydrogénation du phénol
La plupart des installations à grande échelle utilisent la technologie d’oxydation du cyclohexane pour produire un mélange de cyclohexanol et de cyclohexanone. DSM en Hollande et Allied Signal Corp. aux États-Unis sont les seules grandes usines restantes qui utilisent encore l’hydrogénation du phénol.
Des procédés catalytiques et non catalytiques sont utilisés pour oxyder le cyclohexanol en cyclohexanone.
3.1. Production de cyclohexanone par hydrogénation du phénol
La distribution des produits d’hydrogénation du phénol, y compris le cyclohexanol, la cyclohexanone ou leur mélange, dépend du choix du catalyseur et des conditions de réaction.
La figure 1 illustre la production de cyclohexanone en phase vapeur à partir du phénol.
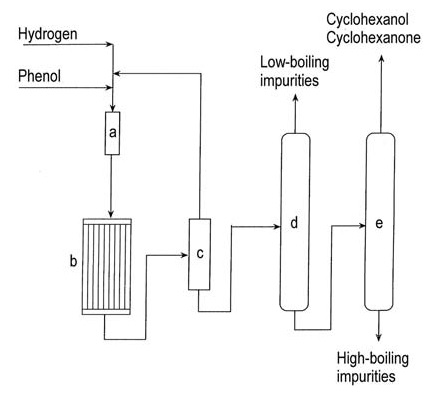
a) Évaporateur de phénol ; b) Réacteur d'hydrogénation ; c) Condenseur ; d) Colonne d'élimination des vapeurs à bas point d'ébullition ; e) Colonne de récupération du cyclohexanol/cyclohexanone
L’hydrogénation du phénol en cyclohexanone en phase vapeur utilise divers catalyseurs à base de métaux nobles supportés, notamment le palladium, le platine, l’iridium, le ruthénium, le rubidium et l’osmium. La réaction se produit à 140–170 °C sous pression atmosphérique et atteint un rendement de 95 % à conversion complète.
L’hydrogénation commerciale en phase liquide du phénol à l’aide de palladium sur un catalyseur au carbone produit > 99 % de cyclohexanone à une conversion de 90 % dans des conditions douces.
3.2. Production de cyclohexanone par déshydrogénation de cyclohexanol
La déshydrogénation de la cyclohexanone produit de la cyclohexanone, qui est un précurseur du caprolactame.
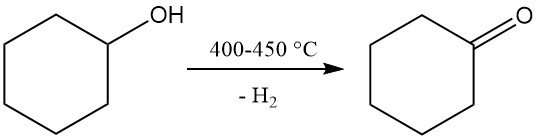
La déshydrogénation en phase vapeur non catalytique du cyclohexanol est réalisée à une température de 400 à 450 °C. Les vapeurs générées sont refroidies, l’hydrogène est séparé et la cyclohexanone brute, contenant du cyclohexène et de l’eau comme sous-produits, est purifiée par distillation. La pureté de la cyclohexanone obtenue atteint 98 à 99 %.
La déshydrogénation catalytique du cyclohexanol en cyclohexanone à l’aide de catalyseurs tels que l’oxyde de chrome-cuivre, le chromate de cuivre, le nickel, le sulfure de zinc, le zinc-fer, le carbonate de cobalt et d’autres métaux se produit dans des conditions plus douces et donne de meilleurs rendements.
3.3. Production de cyclohexanone par oxydation du cyclohexane
L’oxydation à l’air en phase liquide du cyclohexane en cyclohexanol et en cyclohexanone est généralement réalisée, soit sans catalyse, soit avec un catalyseur au cobalt soluble, dans une série de réacteurs agités ou dans un oxydant à tour unique à une température de 140 à 180 °C et une pression de 0,8 à 2 MPa.
L’hydroperoxyde de cyclohexyle est un intermédiaire dans cette réaction et est converti par les oxydants en cyclohexanol, cyclohexanone et sous-produits.
Lorsque du chrome (III) est ajouté à l’oxydant à air, il catalyse la déshydratation de l’hydroperoxyde de cyclohexyle en cyclohexanone et en eau, ce qui conduit à une sélectivité plus élevée pour la cyclohexanone.
Une autre méthode pour augmenter le rapport cyclohexanone/cyclohexanol dans le produit final consiste à décomposer l’hydroperoxyde de cyclohexyle avec une phase caustique aqueuse contenant quelques ppm de cobalt.
Un diagramme de flux de ce procédé caustique est présenté à la figure 2.
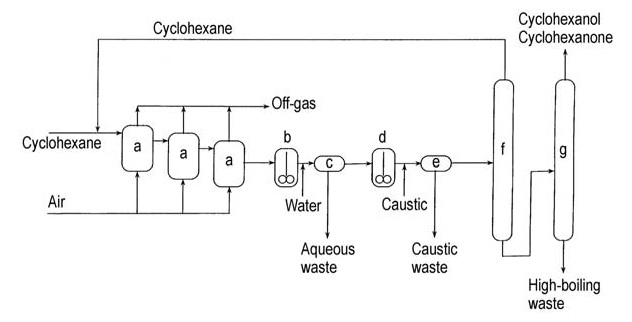
a) Oxydateurs à air ; b) Décanteur de lavage à l'eau ; c) Décantation ; d) Réacteur de décomposition caustique ; e) Décantation caustique ; f) Colonne de récupération du cyclohexane ; g) Colonne de récupération du cyclohexanol/cyclohexanone
Le produit brut de ce procédé contient un mélange de cyclohexanone et de cyclohexanol, qui peut être séparé par distillation et converti en cyclohexanone par déshydrogénation pour augmenter le rendement global de cyclohexanone.
4. Utilisations de la cyclohexanone
Plus de 97 % de toute la cyclohexanone produite est utilisée comme matière première pour la production d’acide adipique et de caprolactame, qui sont utilisés dans la fabrication industrielle du nylon.
La cyclohexanone est également utilisée comme solvant pour les laques, les résines, les polymères et d’autres composés. Elle est également utilisée comme matière première dans la synthèse d’insecticides, d’herbicides et de produits pharmaceutiques.
La cyclohexanone est utilisée dans la fabrication de bandes magnétiques et vidéo.
La conformité à la règle 66 de Californie permet son utilisation comme substitut d’isophorone pour les applications de solvants de résine et de polymère.
5. Toxicologie de la cyclohexanone
La cyclohexanone présente une faible toxicité par exposition orale, cutanée et par inhalation. Le contact avec le liquide ou la vapeur peut provoquer une lésion cornéenne transitoire. Un contact prolongé ou important avec la peau peut provoquer une irritation et une délipidation.
L’exposition par inhalation a provoqué une congestion pulmonaire, un œdème et une hémorragie. Des concentrations élevées de vapeur ou une exposition répétée peuvent entraîner une dépression du système nerveux central.
Les valeurs de DL50 variaient de 0,93 à 1,54 g/kg (ip) et de 1,8 à 2,1 g/kg (intragastrique) dans les études sur les animaux, les cobayes présentant la sensibilité la plus élevée.
Bien que des résultats d’activité génétique positifs et négatifs existent, les preuves de cancérogénicité restent peu concluantes. La cyclohexanone a démontré une non-tératogénicité chez les rats et les souris.
Les études d’inhalation sur deux générations chez le rat n’ont révélé aucun effet indésirable sur la croissance, le développement ou la reproduction à 1000 ppm pendant une génération ou à 250/500 ppm pendant deux générations.
L’exposition de la progéniture à 1 400 ppm a entraîné des effets réversibles, notamment une léthargie, une diminution de la fertilité des mâles, ainsi que la survie et le poids de la progéniture.
Une NOEL d’au moins 500 ppm a été établie. La PEL de l’OSHA et la TLV de l’ACGIH pour la cyclohexanone sont de 25 ppm (100 mg/m³) avec une mention d’absorption cutanée.
Les précautions standard de manipulation des solvants volatils s’appliquent, notamment la ventilation, l’évitement de l’inhalation et du contact avec la peau, la prévention de l’ingestion et la protection des yeux.
Références
- Cyclohexanol and Cyclohexanone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_217.pub2
- Cyclohexanol and Cyclohexanone. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471238961.0325031206091908.a01
- https://www.sciencedirect.com/science/article/abs/pii/0041008X7990454X
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse2329.pub2
- https://pubchem.ncbi.nlm.nih.gov/compound/Cyclohexanone
