Cyclohexanol : propriétés, réactions, production et utilisations
Qu’est-ce que le cyclohexanol ?
Le cyclohexanol est un composé organique dont la formule chimique est C6H12O. Il s’agit d’un liquide incolore et visqueux ou d’un solide cristallin à l’odeur camphrée qui est très soluble dans la plupart des solvants organiques.
Le cyclohexanol est un produit chimique important qui est produit à grande échelle commerciale.
Table des matières
1. Propriétés physiques du cyclohexanol
Le cyclohexanol est une substance incolore qui forme des aiguilles cristallines hygroscopiques avec une odeur de camphre. À l’état pur, il fond à 25,15 °C à température ambiante.
Le cyclohexanol est très soluble dans la plupart des solvants organiques, tels que les alcools, les cétones, les éthers et les hydrocarbures alicycliques et aromatiques. Il dissout de nombreuses huiles, cires, gommes et résines et forme un azéotrope avec l’eau et le phénol.
Les propriétés physiques les plus importantes du cyclohexanol sont présentées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [108-93-0] |
| Formule chimique | C6H11OH |
| Masse moléculaire | 100,16 g/mol |
| Point de fusion | 25,15 °C |
| Point d'ébullition | 161,1 °C |
| Pression de vapeur | 0,15 kPa à 20 °C 0,48 kPa à 35 °C |
| Densité | 0,9493 g/cm3 |
| Indice de réfraction | 1,4656 |
| Coefficient de dilatation | 8,25 × 10-4 |
| Viscosité dynamique | 41,07 mPa · s à 30 °C 17,20 mPa · s à 45 °C |
| Chaleur spécifique | 1,747 J/g |
| Tension superficielle à 30 °C | 33,47 mN/m |
| Chaleur de fusion | 1,791 kJ/mol |
| Chaleur de combustion | -3,722 MJ/mol |
| Chaleur de vaporisation | 45,51 kJ/mol |
| Chaleur de formation | -352 kJ/mol |
| Point d'éclair | 68 °C |
| Température d'auto-inflammation | 300 °C |
| Solubilité dans l'eau à 20 °C | 3,6 g/100 g d'eau |
2. Réactions chimiques du cyclohexanol
Le cyclohexanol subit la plupart des réactions typiques des alcools secondaires. Il forme des esters avec les acides organiques et des halogénures de cyclohexyle avec les acides halogénés. Les esters commerciaux les plus importants du cyclohexanol sont le phtalate de dicyclohexyle, l’adipate de dicyclohexyle et l’acrylate de cyclohexyle.
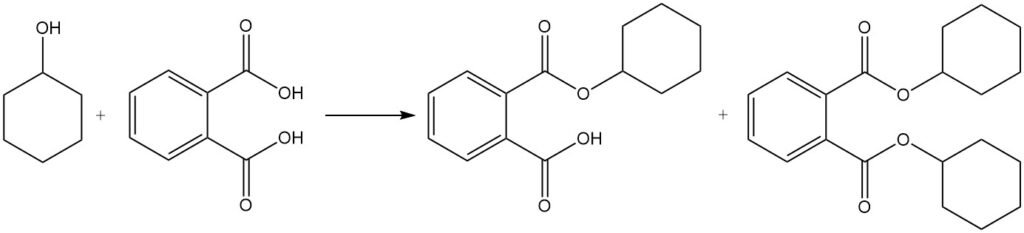
La réaction du cyclohexanol avec l’acide phtalique produit des phtalates de cyclohexyle et de dicyclohexyle, qui sont utilisés comme plastifiants.
La déshydratation du cyclohexanol avec de l’acide sulfurique ou le traitement en phase vapeur avec de l’alumine à 300–400 °C produit du cyclohexène.
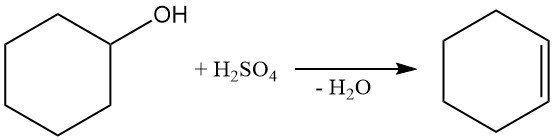
Le cyclohexanol réagit avec le bromure de sodium et l’acide sulfurique pour produire du bromocyclohexane avec un rendement > 50 %.
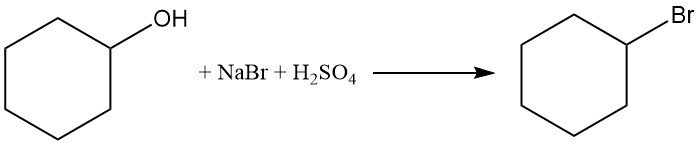
Une oxydation douce ou une déshydrogénation catalytique donne de la cyclohexanone, qui peut être davantage oxydée en acide adipique en utilisant de l’acide nitrique à 75-80 °C et 1-4 bar. Cette réaction est importante sur le plan industriel.
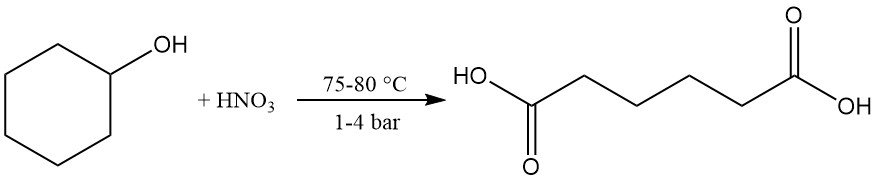
La réaction du cyclohexanol avec l’ammoniac produit de la cyclohexylamine.
3. Production industrielle du cyclohexanol
Le cyclohexanol a été produit industriellement par hydrogénation du phénol, qui forme également de la cyclohexanone. Dans les années 1940, l’oxydation à l’air en phase liquide du cyclohexane catalysée par des métaux de transition a été développée pour synthétiser un mélange cyclohexanol-cyclohexanone. Le choix du catalyseur a influencé le rapport du produit.
Dans les années 1950, Scientific Design a produit du cyclohexanol de manière sélective par oxydation à l’air en phase liquide modifiée par l’acide borique du cyclohexane, en passant par un hydroperoxyde de cyclohexyle intermédiaire. Vers 1990, Asahi a produit du cyclohexanol à partir de cyclohexène, qui est obtenu par hydrogénation partielle du benzène.
3.1. Production de cyclohexanol par hydrogénation du phénol
Le choix des catalyseurs métalliques dans l’hydrogénation du phénol détermine la distribution du produit, soit le cyclohexanol, la cyclohexanone ou leur mélange.
Le cyclohexanol peut être produit avec des rendements élevés par hydrogénation du phénol en phase vapeur et en phase liquide.
Le cyclohexanol est produit avec un rendement de 98 % par hydrogénation en phase vapeur du phénol à l’aide de catalyseurs à base de nickel, souvent supportés sur de l’alumine ou de la silice.
Un diagramme de flux de l’hydrogénation en phase vapeur du phénol est présenté dans la figure 1.
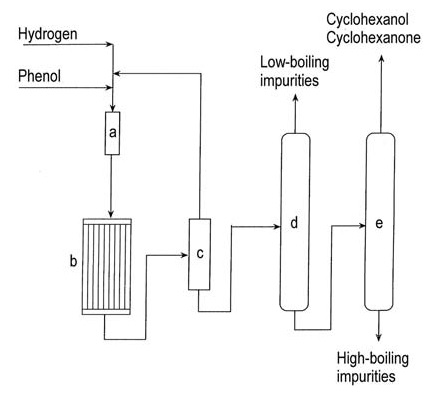
a) Évaporateur de phénol ; b) Réacteur d'hydrogénation ; c) Condenseur ; d) Colonne d'élimination des vapeurs à bas point d'ébullition ; e) Colonne de récupération du cyclohexanol/cyclohexanone
L’hydrogénation commerciale en phase liquide du phénol dans des conditions douces avec un catalyseur au nickel de Raney atteint une sélectivité de 99,9 % pour le cyclohexanol.
3.2. Production de cyclohexanol par oxydation en phase liquide du cyclohexane
L’oxydation en phase liquide du cyclohexane en cyclohexanol et en cyclohexanone est apparue dans les années 1940. Ce procédé est réalisé dans des réacteurs agités à 140–180 °C et 0,8–2 MPa et utilise soit une catalyse au cobalt, soit des conditions non catalysées.
L’hydroperoxyde de cyclohexyle est un intermédiaire qui se forme pendant la réaction et est ensuite converti en cyclohexanol et en cyclohexanone.
Le choix du catalyseur influence le rapport cyclohexanol/cyclohexanone, les catalyseurs au cobalt produisant un rapport cyclohexanol/cyclohexanone de 3,5. Divers composés oxygénés sont produits comme sous-produits.
Le rendement en cyclohexanol peut être amélioré en maintenant des niveaux élevés d’hydroperoxyde dans l’effluent de l’oxydant.
Les méthodes et conditions utilisées pour décomposer les intermédiaires hydroperoxydes influencent le rapport cyclohexanol/cyclohexanone obtenu. (voir tableau 2)
| Solution/Modification | Catalyseur | Température (°C) | Rapport (cyclohexanol : cyclohexanone) |
|---|---|---|---|
| A | aucun | 155 | 0,8 |
| A | Cr | 155 | 0,4 |
| A | Ni | 155 | 1,4 |
| A | V | 155 | 1,4 |
| A | Co | 155 | 3,0 |
| A | Mn | 155 | 3,3 |
| B | Co | 160 | 2,5 |
| A - hydrogénation de l'hydroperoxyde de cyclohexyle | Pd | 150 | 5 - 10 |
| A - phase aqueuse caustique séparée | Co | 120 | 0,2 |
* A = hydroperoxyde de cyclohexyle dans le cyclohexane ; B = hydroperoxyde de cyclohexyle dans les queues d'oxydant à l'air.
3.3. Production de cyclohexanol par oxydation modifiée du cyclohexane par l’acide borique
Dans les années 1950, Scientific Design a modifié le procédé d’oxydation à l’air du cyclohexane en ajoutant de l’acide métaborique anhydre au premier réacteur d’oxydation (figure 2). L’hydroperoxyde de cyclohexyle est piégé sous forme d’ester de perborate de cyclohexyle, puis réagit avec le cyclohexane pour former un ester de borate et du cyclohexanol.
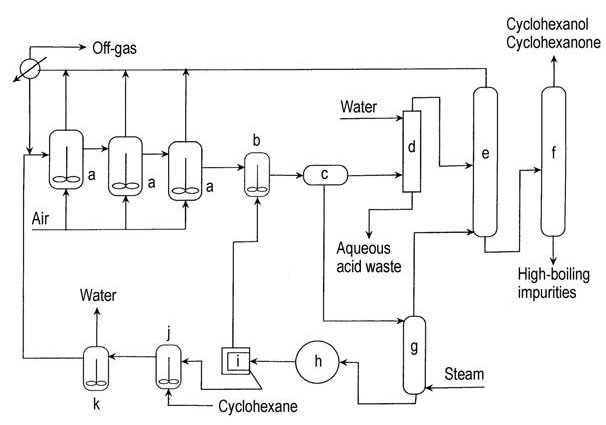
a) Oxydateurs à air ; b) Cuve d'hydrolyse d'ester ; c) Décanteur ; d) Colonne d'extraction ; e) Colonne de récupération du cyclohexane ; f) Colonne de raffinage ; g) Colonne de stripping ; h) Cristallisoir sous vide ; i) Centrifugeuse à acide borique ; j) Réservoir de boues d'acide borique ; k) Déshydrateur
Cet ester stable résiste à la suroxydation et est ensuite hydrolysé en cyclohexanol et en acide borique. L’acide borique est déshydraté en acide métaborique, qui est recyclé vers l’oxydant à air.
La chimie du procédé est similaire à celle de l’oxydation du cyclohexane catalysée par un métal, mais le cycle cyclohexyle est protégé de l’oxydation.
Malgré des coûts d’investissement et d’exploitation plus élevés par rapport aux autres méthodes, le procédé à l’acide borique donne des rendements en cyclohexanol et en cyclohexanone plus élevés, jusqu’à 88 %, avec une sélectivité élevée en cyclohexanol de 91 %. L’Institut Français du Pétrole a développé cette technologie.
Les principaux fabricants actuels qui utilisent ce procédé sont Solutia, DuPont (Royaume-Uni), Bayer et Mitsubishi. L’usine originale de Rhône-Poulenc basée sur cette technologie est désormais fermée.
3.4. Production de cyclohexanol par hydratation de cyclohexène
En 1972, l’hydrogénation sélective du benzène en cyclohexène a été brevetée pour la première fois. Par la suite, des brevets pour l’hydratation du cyclohexène en cyclohexanol à l’aide de divers catalyseurs ont suivi.
Asahi a commercialisé ce procédé en 1990 avec une usine de 100 t/a. Le procédé comprend trois étapes : l’hydrogénation sélective du benzène, la séparation du cyclohexène du benzène et du cyclohexane non convertis et l’hydratation du cyclohexène (Figure 3).
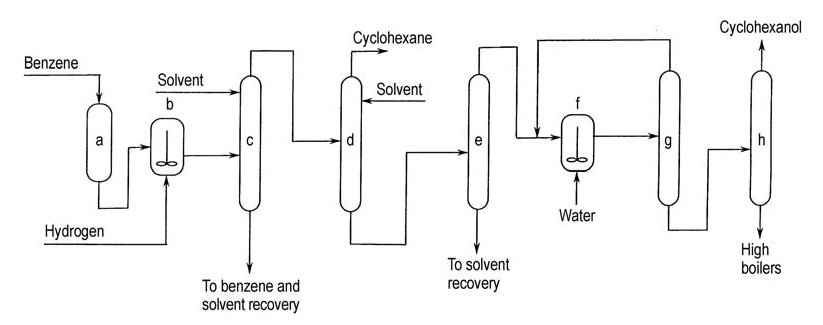
a) Purification du benzène ; b) Hydrogénation partielle ; c) Séparation du benzène non converti du cyclohexène et du cyclohexane ; d) Séparation du cyclohexène du cyclohexane ; e) Séparation du cyclohexène du solvant d'extraction ; f) Hydratation du cyclohexène ; g) Recyclage du cyclohexène non converti ; h) Purification du cyclohexanol
L’hydrogénation du benzène utilise un catalyseur hétérogène spécialisé au nickel et fonctionne à environ 50 % de conversion pour produire un mélange d’environ 35 % de cyclohexène, 15 % de cyclohexane et 50 % de benzène non converti.
Les impuretés telles que le soufre et le fer ont un impact significatif sur la sélectivité, c’est pourquoi il est nécessaire d’utiliser du benzène purifié et de revêtir le récipient d’hydrogénation d’un matériau inerte.
Le mélange cyclohexane-cyclohexène-benzène subit deux distillations extractives successives. Le cyclohexane récupéré peut être reconverti en benzène ou vendu à d’autres producteurs de caprolactame et d’acide adipique.
L’hydratation du cyclohexène en cyclohexanol utilise également un catalyseur hétérogène dans un réacteur à boues. L’équilibre limite la conversion à environ 14 %.
Le rendement du benzène en cyclohexanol est exceptionnellement élevé, dépassant probablement 95 %. Bien que les sous-produits soient minimes, l’investissement dépasse les usines d’oxydation de cyclohexane conventionnelles.
4. Utilisations du cyclohexanol
Le cyclohexanol est utilisé industriellement dans la production d’acide adipique principalement, qui est utilisé dans la fabrication du nylon-6,6 et de la cyclohexanone, qui est un précurseur du caprolactame.
En 1992, le marché américain du cyclohexanol (à l’exclusion des intermédiaires en nylon) a atteint 10 000 tonnes.
Les principales applications du cyclohexanol sont :
- Comme solvant pour les laques, les vernis, les huiles, les résines alkydes, les gommes, les gommes laques, l’éthylcellulose, les colorants acides et les résines naturelles.
- Dans la préparation d’esters pour plastifiants, par exemple le phtalate de dicyclohexyle.
- Dans l’industrie de la lessive et dans les savons et détergents synthétiques, comme homogénéisateur et stabilisateur.
- Dans les décapants pour peinture et vernis.
- Dans la production de cyclohexylamine, qui est un inhibiteur de corrosion.
- Dans les industries des insecticides, des parfums, des produits de polissage et du ciment de caoutchouc.
- Dans l’industrie textile, comme solvant de teinture et auxiliaire d’ébullition.
5. Toxicologie du cyclohexanol
Le cyclohexanol présente une faible toxicité orale et une légère irritation cutanée. L’exposition oculaire provoque une irritation grave et des lésions cornéennes transitoires. L’inhalation de concentrations élevées de vapeur (environ 1 000 ppm) chez les lapins entraîne une irritation conjonctivale et respiratoire, une léthargie, une incoordination, une narcose et de légères convulsions.
Les études de toxicité pour la reproduction chez la souris indiquent une augmentation de la mortalité de la progéniture après la consommation maternelle de cyclohexanol pendant la gestation. Une atrophie testiculaire avec perte de cellules spermatogènes a été signalée chez les rats et les gerbilles après une administration sous-cutanée répétée.
Des effets similaires se sont produits chez les lapins après une exposition orale. Cependant, une étude n’a pas réussi à démontrer une atrophie testiculaire chez les rats malgré une administration orale à forte dose.
L’ACGIH a établi une TLV-TWA de 50 ppm (environ 200 mg/m³) avec une notation cutanée.
La manipulation appropriée du cyclohexanol nécessite une ventilation adéquate, l’évitement d’une exposition prolongée, la prévention de l’ingestion et une protection oculaire.
Références
- Cyclohexanol and Cyclohexanone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_217.pub2
- Cyclohexanol and Cyclohexanone. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471238961.0325031206091908.a01
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse2329.pub2
- https://www.sciencedirect.com/science/article/abs/pii/B9780323851596501093
- https://onlinelibrary.wiley.com/doi/abs/10.1002/recl.19630820107
- https://onlinelibrary.wiley.com/doi/10.1002/0471740039.vec0746
- https://www.sciencedirect.com/science/article/abs/pii/S1460156705800200
- https://pubchem.ncbi.nlm.nih.gov/compound/Cyclohexanol
