Chlorure d’allyle : production, réactions et utilisations

Le chlorure d’allyle (cas 107-05-1) est un chloropropène qui a été produit pour la première fois en 1857 par Auguste Cahours et August Wilhelm Hofmann en faisant réagir du chlorure de phosphore avec de l’alcool allylique. Le nom « allyl » est dérivé du mot latin « allium », qui signifie « ail ». Le chlorure d’allyle a une odeur caractéristique d’ail qui peut être détectée même en petites quantités.
À la fin des années 1930, IG Farbenindustrie et la Shell Development Company ont mis au point un procédé de production de chlorure d’allyle à grande échelle en chlorant le propène à haute température. Ce procédé a permis des rendements élevés de chlorure d’allyle et a été rapidement adopté par d’autres sociétés, notamment Dow, Solvay et Asahi-Kashima.
Le chlorure d’allyle est utilisé dans une variété d’applications, y compris la production d’épichlorhydrine, de glycérine et de pesticides. Il est également utilisé comme monomère dans la production de plastiques et de résines.
Table of Contents
1. Propriétés physiques du chlorure d’allyle
Le chlorure d’allyle est un liquide incolore et mobile avec une odeur pénétrante et piquante. Il a un poids moléculaire de 76,53 et un point de fusion de -134 degrés Celsius. Son point d’ébullition à 101,3 kPa est de 44,4 degrés Celsius. Son indice de réfraction à 25 degrés Celsius est de 1,413.
Le tableau ci-dessous montre la dépendance à la température des propriétés physiques du chlorure d’allyle
| Température (°C) | Densité (g/cm³) | Capacité calorifique spécifique (kJ kg⁻¹ K⁻¹) | Viscosité (mPa·s) | Tension superficielle (mN/m) |
|---|---|---|---|---|
| 10 | 0,950 | 1.633 | 368 | 28.2 |
| 15 | 0,944 | 1.666 | 347 | 27.4 |
| 20 | 0,938 | 1.700 | 336 | 26,7 |
| 25 | 0,931 | 1.733 | 315 | 25,9 |
| 30 | 0,925 | 1.771 | 307 | 25.2 |
| 40 | 0,911 | 1.816 | 282 | 24.4 |
| 50 | 0,898 | 1.868 | 257 | 23,7 |
La pression de vapeur du chlorure d’allyle peut être calculée à l’aide de l’équation suivante :
log(p) = 19,1403 – 2098 / T – 4,2114 × log(T)
où p est la pression de vapeur en kPa et T est la température en Kelvin.
Le chlorure d’allyle est miscible avec la plupart des solvants d’usage général, tels que l’octane, le toluène et l’acétone. La solubilité du chlorure d’allyle dans l’eau à 20 degrés Celsius est de 0,36 % et la solubilité de l’eau dans le chlorure d’allyle est de 0,08 %.
Les données azéotropiques pour le chlorure d’allyle sont présentées dans le tableau 2.
| Composant | pb à 101,3 kPa, °C | Chlorure d'allyle, fraction massique, % |
|---|---|---|
| Eau | 43 | 97,8 |
| Méthanol | 40 | 90 |
| Éthanol | 44 | 95 |
| 2-Propanol | 45 | 98 |
| Acide formique | 45 | 92,5 |
2. Réactions chimiques du chlorure d’allyle
Le chlorure d’allyle est un composé très réactif qui subit diverses réactions d’addition, de polymérisation et de substitution. L’atome de chlore dans le chlorure d’allyle peut également être facilement remplacé par d’autres groupes. Cela fait du chlorure d’allyle une matière première polyvalente pour la synthèse d’une large gamme de composés.
2.1. Réactions d’addition
Le chlorure d’allyle peut s’ajouter à une variété de composés, y compris l’oxygène, les halogènes, les halogénures d’hydrogène, les silanes, les boranes, les carboranes et le trichlorure de phosphore. Ces réactions peuvent être utilisées pour préparer une variété de dérivés allyliques.
Par exemple, lorsque le chlorure d’allyle réagit avec l’oxygène dans la phase liquide à env. 120 °C et en présence d’acétates métalliques ou de peroxyde d’hydrogène, il donne de la monochlorhydrine de glycérol.
Lorsque le chlorure d’allyle réagit avec les halogènes, il donne les composés trihalogénés correspondants. La réaction avec l’acide hypochloreux, qui donne des dichlorohydrines de 2,3- et 1,3-glycérol (qui sont ensuite déshydrochlorées avec un alcali pour donner de l’épichlorhydrine), est d’une grande importance industrielle.
Le chlorure d’allyle réagit avec les halogénures d’hydrogène pour former des composés 1,2-dihalogéno. En présence de peroxydes, la réaction avec l’acide bromhydrique donne du 1-bromo-3chloro-propane (effet Kharasch), mais dans une solution de peroxyde d’hydrogène très concentrée, il se forme du 1,2-dibromo-3-chloropropane.
Des réactions d’addition de silanes, de boranes, de carboranes et de trichlorure de phosphore, ainsi que des cycloadditions de cations allyle avec des alcènes, sont également connues. Le chlorure d’allyle polymérise avec le dioxyde de soufre pour former des polysulfones.
2.2. Polymérisation
Le chlorure d’allyle peut polymériser pour former du poly(chlorure d’allyle), une résine dure et incolore. Cette résine est utilisée dans une variété d’applications, y compris les peintures, les adhésifs et les mastics.
2.3. Réactions de substitution
L’atome de chlore dans le chlorure d’allyle peut être facilement remplacé par d’autres groupes, tels que l’iodure, le cyanure, l’isothiocyanate, le sulfure, les polysulfures et les alkylthiols. Ces réactions peuvent être utilisées pour préparer une variété de dérivés allyliques avec des propriétés différentes.
Par exemple, lorsque le chlorure d’allyle réagit avec le sulfite de sodium, il donne du sulfonate d’allyle de sodium. L’allylsulfonate de sodium est un composé polyvalent qui est utilisé dans une variété d’applications, y compris les cosmétiques, les produits pharmaceutiques et les additifs alimentaires.
En plus de ces réactions courantes, le chlorure d’allyle peut également subir diverses autres réactions, telles que la carbonylation, la formation de polycarbonates organiques et la formation d’éthers allyliques.
Le chlorure d'allyle est un composé dangereux et doit être manipulé avec précaution. C'est un liquide inflammable qui peut irriter la peau et les yeux. C'est aussi un cancérigène présumé. Si vous travaillez avec du chlorure d'allyle, il est important de porter un équipement de protection, comme des gants, des lunettes et un respirateur.
3. Production de chlorure d’allyle
3.1. Procédé de chloration au propène
La production extensive de chlorure d’allyle se produit par le processus de chloration à haute température (300 – 600 ° C) du propène :
CH2 = CH–CH3 + Cl2 → CH2 = CH–CH2Cl + HCl ⇒ ΔH(298k) = -113 kJ/mol
Pendant ces températures élevées, le processus de chloration progresse via un mécanisme de chaîne radicalaire. Ce mécanisme substitue majoritairement l’atome d’hydrogène situé en position allyle par du chlore, donnant ainsi du chlorure d’allyle.
3.1.1. Réactions secondaires et sous-produits
À des températures inférieures à 200 ° C, la réaction du propène avec le chlore implique principalement l’ajout à la double liaison, entraînant la formation de 1,2-dichloropropane. Lorsque la température dépasse 300 ° C, la formation de chlorure d’allyle a lieu, faisant du 1,2-dichloropropane un sous-produit. Des produits de chloration supplémentaires se forment également en petites quantités :
CH3–CH = CH2 + Cl2 → CH3–CHCl–CH2Cl ⇒ ΔH298 = -184 kJ/mol
ClCH2–CH = CH2 + Cl2 → CH2Cl–CH = CHCl + HCl ⇒ ΔH298 = -101 kJ/mol
CH3–CH = CH2 + Cl2 → CH3–C(Cl) = CH2 + HCl ⇒ ΔH298 = -121 kJ/mol
CH3–CH = CH2 + Cl2 → CH3–CH = CHCl + HCl
3.1.2. Paramètres de processus critiques
Dans la chloration à l’échelle industrielle du propène en chlorure d’allyle, les facteurs les plus influents sont la température et le rapport propène-chlore. La pression et le temps de séjour ont un impact minimal sur le rendement en chlorure d’allyle.
Pour éviter la production de 1,2-dichloropropane en dessous de 200 °C, la température de mélange du propène et du chlore doit être maintenue au-dessus de 250 – 300 °C. Les rendements les plus élevés de chlorure d’allyle sont obtenus dans des réacteurs industriels fonctionnant à une température maximale de 500 à 510 °C.
Si la température dépasse cette plage, une pyrolyse spontanée se produit, entraînant de la suie et des goudrons à point d’ébullition élevé. Dans des conditions expérimentales à environ 600 ° C, du benzène se forme, entraînant une réduction du rendement en chlorure d’allyle.
3.1.3. Rapport propène-chlore
Une augmentation de l’excès de propène entraîne une réduction de la formation de sous-produits. Cependant, cela amplifie les dépenses de traitement du propène. Par conséquent, les conditions de réaction optimales sont façonnées par des facteurs économiques, y compris le besoin de sous-produits de dichlorure à utiliser comme nématicides. Ces sous-produits peuvent également servir de matières premières pour la synthèse de solvants de type C1 ou C2.
3.1.4. Pression du réacteur et temps de séjour
La pression du réacteur a un impact minimal sur le rendement et la distribution du produit. Il est déterminé uniquement par la baisse de pression dans le système de circulation du propène. De même, le temps de séjour exerce une influence limitée sur le rendement en chlorure d’allyle.
Le chlore réagit complètement en 1 à 3 secondes à des températures élevées de 300 à 600 °C et un temps de séjour excessif entraîne la décomposition thermique du chlorure d’allyle.
3.1.5. Conception du réacteur et sélection des matériaux
Les réacteurs à l’échelle industrielle fonctionnent principalement de manière adiabatique, bien que des rendements optimaux puissent être atteints avec un fonctionnement isotherme. En raison de la nature rapide et exothermique de la réaction, la perte de chaleur à travers les parois du réacteur est très faible.
Le type de réacteur le plus simple et le plus traditionnel est le réacteur tubulaire, souvent équipé de fonctions de dispersion de gaz et d’élimination de la suie. De nombreuses autres configurations de réacteurs sont reconnues, chacune s’efforçant de faciliter un mélange rapide et approfondi des réactifs pour atténuer la formation de 1,3-dichloropropène.
Dans des conditions d’écoulement très turbulentes, le propène et le chlore sont introduits dans la zone de réaction à des vitesses allant jusqu’à 300 m/s. L’importance des conditions de mélange précises est soulignée par un réacteur à cyclone, dans lequel des rendements similaires sont atteints à un rapport molaire de 3: 1 par rapport à un rapport de 5: 1 avec des conceptions alternatives. Plusieurs réacteurs ont des chemises de refroidissement.
En utilisant une cascade de réacteurs avec du chlore distribué, des taux de conversion du chlore allant jusqu’à 86 % peuvent être atteints. Un tel agencement permet des températures de préchauffage élevées en raison de rapports propène:chlore plus élevés dans le réacteur initial.
3.1.6. Préparation de la matière première
La pureté du propène et du chlore est très importante. Les impuretés dans le propène déclenchent la formation de sous-produits et la perte de chlore. Notamment, le propane favorise le développement de dérivés chlorés (1-chloropropane, 2-chloropropane) difficiles à séparer.
Pour la charge d’alimentation, du propène de pureté de qualité polymère, à environ 99,5%, est souvent utilisé. Pour garantir une pureté suffisante, le chlore est revaporisé. Cependant, cela introduit des traces de gaz inertes, entraînant une perte de propène lors de la ventilation. Le propène et le chlore doivent être aussi exempts d’eau que possible.
3.1.7. Présentation du processus
Un processus similaire à celui utilisé par Shell est représenté sur la figure 1.
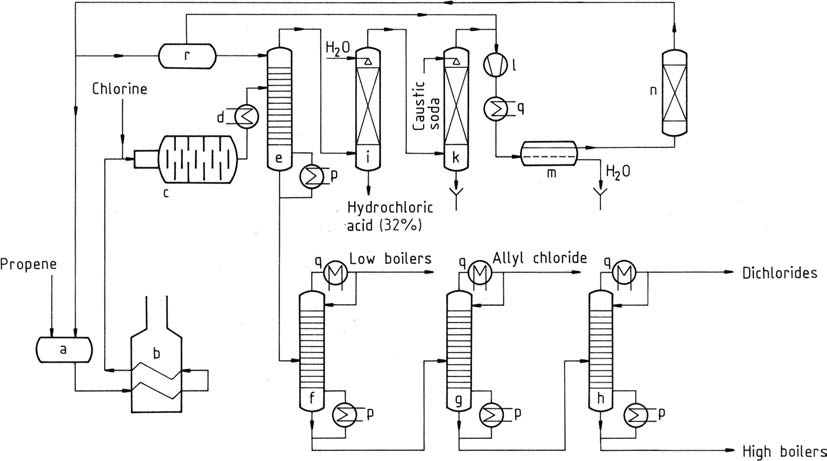
Le propène liquide est vaporisé, suivi d’un préchauffage à des températures de 350 à 400 °C (b). Ce mélange, accompagné de chlore gazeux, est introduit dans le réacteur (c) par un jet de mélange.
La réaction complète du chlore fait grimper la température à 500 – 510 °C (dans des conditions optimales). Même dans les meilleures circonstances, une formation minimale de carbone se produit, catalysant la chloration. Un film protecteur de carbone vitreux se forme sur les parois du réacteur.
Ce matériau, composé de substances hautement chlorées et de goudron, nécessite un nettoyage périodique toutes les 4 à 8 semaines. Souvent, des chaînes de réacteurs parallèles sont utilisées pour maintenir une production partielle pendant le nettoyage, ou un fonctionnement alterné des deux chaînes peut être poursuivi.
Le flux gazeux sortant du réacteur de chloration subit un prérefroidissement (d) et est dirigé vers un préfractionneur (e). La température de tête de ce préfractionneur, maintenue autour de -40 °C, est gérée par une alimentation en propène liquide. Celui-ci sépare les hydrocarbures chlorés, le produit de fond étant dépourvu de propène et de chlorure d’hydrogène.
Le mélange gazeux de tête est séparé par absorption d’eau (i), produisant du chlorure d’hydrogène aqueux de qualité commerciale et du propène. Le propène est ensuite lavé avec de la soude caustique dans un épurateur (k) pour éliminer les traces de chlorure d’hydrogène.
Après compression à 1,2 MPa (12 bars), le propène est condensé dans un condenseur (l, q). Le propène liquide est séché par adsorption (n) et l’eau est éliminée (m) puis renvoyée au stockage (a).
Le produit de fond du préfractionneur contient 80 % de chlorure d’allyle, 3 % de 2-chloro-1-propène et d’autres composants à bas point d’ébullition, ainsi que 16 % de dichlorures (principalement du 1,2-dichloropropane et du cis- et trans-1,3-dichloro -1-propène), et 1 % de 1,2,3-trichloropropane et d’autres fractions à point d’ébullition élevé. Ces fractions peuvent encore être séparées par distillation (f, g, h).
3.1.8. Sélection des matériaux pour la construction
Le choix des matériaux pour la synthèse du chlorure d’allyle (circulation du propène) dépend des spécificités du procédé, de la température et de la pression. L’acier au carbone standard peut être utilisé lorsque les flux de produits maintiennent une faible teneur en eau.
Si le chlore n’est pas préchauffé, l’acier au carbone peut également être utilisé dans la zone du réacteur. Pourtant, dans la région du réacteur, la résistance au chlore à haute température nécessite des matériaux tels que les aciers au chrome-nickel, le nickel et les alliages de cupronickel.
Les revêtements en graphite et en PTFE sont idéaux pour l’absorption du chlorure d’hydrogène, tandis que l’acier caoutchouté convient à l’épurateur de soude caustique. L’acier au carbone suffit pour l’ensemble de l’usine de fractionnement des hydrocarbures chlorés, bien que les environnements avec des volumes d’eau importants exigent des matériaux coûteux tels que le nickel et le cupronickel. Le chlorure d’allyle sec peut être stocké dans des récipients en acier sans problème de corrosion.
3.2. Autres processus de production
Des procédés alternatifs ont été proposés pour la synthèse du chlorure d’allyle, mais aucun de ces procédés n’a été mis en œuvre à l’échelle commerciale.
3.2.1. Chloration catalytique du propène
La chloration du propène dans cette méthode utilise des catalyseurs contenant du tellure, ce qui donne des rendements en chlorure d’allyle allant jusqu’à 82 %. Le sous-produit principal est 17 % de 2-chloropropane (chlorure d’isopropyle). Tout propène n’ayant pas réagi et le chlorure d’hydrogène généré pendant la réaction peuvent être convertis en chlorure d’allyle dans une étape ultérieure impliquant une oxychloration.
3.2.2. Déshydrochloration du 1,2-dichloropropane
Le procédé de déshydrochloration du 1,2-dichloropropane conduit à un rendement modeste de seulement 55 % de chlorure d’allyle, accompagné d’une quantité importante de monochloropropènes. Malgré le démarrage avec des quantités abondantes de dichloropropane, qui sont produites lors de la production d’oxyde de propène, ce procédé n’a aucune utilisation commerciale.
3.2.3. Oxychloration
L’oxychloration a été développée comme une approche pour produire du chlorure d’allyle en utilisant du chlorure d’hydrogène facilement disponible au lieu du chlore comme matière première. Divers systèmes catalytiques ont été proposés, notamment le palladium, le vanadium, le tellure, le cuivre, le lithium, le manganèse, ainsi que leurs chlorures, oxydes et leurs combinaisons respectifs.
Alors que bon nombre de ces processus d’oxychloration commencent à partir du propène, quelques-uns commencent à partir du propane.
Un procédé, évalué dans une usine pilote par Hoechst, implique la réaction de propène, de chlorure d’hydrogène, d’oxygène et de 2-chloropropane (qui peut être produit dans un réacteur auxiliaire ou introduit à l’extérieur) dans un réacteur primaire à lit fluidisé fonctionnant à des températures de 200 – 260 °C et pression relative de 0,1 MPa (1 bar) (ΔH = -218 kJ/mol).
Le mélange catalytique comprend du tellure, du pentoxyde de vanadium, de l’acide phosphorique et un composé azoté en tant que promoteur. Une partie du flux de catalyseur est traitée avec de l’air et de l’acide nitrique dans un courant latéral pour éliminer la formation de coke et maintenir une réactivité constante.
Dans un réacteur séparé, le 2-chloropropane est produit à partir de propène, de chlorure d’hydrogène et d’une solution de chlorure ferrique. Le propène, le 2-chloropropane et le chlorure d’hydrogène n’ayant pas réagi sont séparés et recyclés.
Le rendement en chlorure d’allyle varie de 88% à 94% sur la base de l’apport de propène. La pureté du propène n’est pas très critique dans ce cas.
Certaines approches d’oxychloration présentent des inconvénients inhérents. Par exemple, les activités des catalyseurs déclinent rapidement en raison de la volatilité des sels métalliques employés, nécessitant de grands volumes de réacteur en raison de la faible conversion par passe.
De plus, l’extraction du chlorure d’allyle fortement dilué du mélange réactionnel sans perte excessive de propène par oxydation pose des défis. Une solution à cela consiste à utiliser du dioxyde de manganèse à la fois comme catalyseur et comme transporteur d’oxygène. Les principales réactions se produisant dans le réacteur primaire sont les suivantes :
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
C3H6 + Cl2 → C3H5Cl + HCl
Le catalyseur est ensuite réoxydé et activé à l’oxygène :
MnCl2 + O2 → MnO2 + Cl2
Ce procédé permet d’obtenir des rendements en chlorure d’allyle allant de 71 % à 81 % sur la base de la consommation de propène.
4. Utilisations du chlorure d’allyle
Le chlorure d’allyle est un intermédiaire important dans l’industrie pétrochimique. Il est principalement utilisé pour produire de l’épichlorhydrine, qui est utilisée pour fabriquer des résines époxy. Le chlorure d’allyle est également une matière première pour la synthèse de divers autres produits chimiques, tels que le glycérol, les esters, les éthers allyliques et les allylamines.
D’autres composés qui peuvent être fabriqués à partir de chlorure d’allyle comprennent l’isothiocyanate d’allyle (huile de moutarde synthétique), le sulfonate d’allyle, l’allylsilane et le cyclopropane.
Voici une ventilation plus détaillée des utilisations du chlorure d’allyle :
- Épichlorhydrine: Le chlorure d’allyle est utilisé pour produire de l’épichlorhydrine, qui est un composé polyvalent avec une large gamme d’applications. L’épichlorhydrine est utilisée pour fabriquer des résines époxy, qui sont utilisées dans une variété de produits, y compris des adhésifs, des revêtements et des composites. L’épichlorhydrine est également utilisée pour fabriquer du glycérol, qui est un liquide sucré et incolore utilisé dans une variété de produits, notamment des aliments, des cosmétiques et des produits pharmaceutiques.
- Estérification: Le chlorure d’allyle est utilisé dans l’estérification des acides phtalique, phosphorique et carboxylique. Ce processus produit des esters, qui sont des composés avec une large gamme d’applications. Les esters sont utilisés dans les parfums, les arômes et les plastiques. Ils sont également utilisés comme solvants et comme intermédiaires dans la production d’autres produits chimiques.
- Éthers allyliques et allylamines : Le chlorure d’allyle est utilisé pour produire des éthers allyliques et des allylamines. Les éthers allyliques sont des composés à odeur caractéristique utilisés dans les parfums et les arômes. Les allylamines sont des composés avec une large gamme d’applications. Ils sont utilisés dans les produits pharmaceutiques, les produits chimiques agricoles et les plastiques.
- Autres composés : le chlorure d’allyle peut également être utilisé pour produire d’autres composés, tels que l’isothiocyanate d’allyle, le sulfonate d’allyle, l’allylsilane et le cyclopropane. L’isothiocyanate d’allyle est un composé à forte odeur utilisé dans les produits phytosanitaires et les préparations pharmaceutiques. Le sulfonate d’allyle est utilisé comme additif de bain de galvanoplastie et dans la production de fibres de carbone. L’allylsilane est utilisé pour la production d’additifs pour l’industrie du caoutchouc. Le cyclopropane est un anesthésique utilisé en chirurgie.
5. Manipulation et protection de l’environnement du chlorure d’allyle
Le chlorure d’allyle est une substance hautement réactive, toxique et inflammable. Il est donc soumis à des réglementations strictes dans de nombreux pays concernant ses émissions dans l’atmosphère. Le chlorure d’allyle doit être manipulé dans des systèmes fermés afin de se conformer à ces réglementations.
Les mélanges gazeux contenant du chlorure d’allyle ou des sous-produits dérivés du processus de production doivent être purifiés par condensation, absorption, adsorption ou combustion avant d’être évacués. Une technique efficace pour transférer le chlorure d’allyle d’un récipient à un autre est la technique de compensation.
La contamination du sol, des eaux souterraines, des cours d’eau ou des eaux usées doit être évitée à tout prix. Toute contamination potentielle doit être signalée immédiatement aux autorités.
L’élimination des déchets contenant du chlorure d’allyle ne pose aucun risque majeur lorsque des incinérateurs spécialisés comme ceux utilisés pour l’élimination des solvants sont utilisés. Les gaz de combustion de ces incinérateurs doivent être traités dans des absorbeurs ou des épurateurs pour éliminer le chlorure d’hydrogène qui se forme.
En raison de sa forte volatilité et de son faible point d’éclair, les installations de production et de traitement du chlorure d’allyle doivent se conformer à des réglementations strictes en matière de sécurité incendie et explosion.
La combustion d’hydrocarbures chlorés produit du chlorure d’hydrogène, de sorte que les pompiers qui interviennent dans des incendies impliquant du chlorure d’allyle doivent être équipés de combinaisons de protection et d’appareils respiratoires. Une alimentation en air inadéquate pendant la combustion peut entraîner la formation de monoxyde de carbone.
Le chlorure d’allyle est hautement réactif et peut réagir vigoureusement, exothermiquement et même de manière explosive avec d’autres substances. C’est notamment le cas des métaux alcalins et alcalino-terreux, mais aussi de l’aluminium et du zinc et des oxydants forts, comme l’acide sulfurique concentré.
Les halogénures anhydres (par exemple, les chlorures) des métaux mentionnés ci-dessus réagissent également vigoureusement avec le chlorure d’allyle. Une attention particulière doit être accordée aux aspects de sécurité de ces réactions exothermiques dans les usines qui produisent ou traitent le chlorure d’allyle.
En 1996, l’Union européenne a classé le chlorure d’allyle comme « dangereux pour l’environnement » et « très toxique pour les organismes aquatiques ».
6. Toxicologie et santé au travail
Dans des études de laboratoire impliquant des rats et des lapins, les valeurs de DL50 indiquent que la consommation orale de 460 mg/kg de chlorure d’allyle s’est avérée mortelle pour les rats, tandis que l’application percutanée de 3,7 mg/kg a entraîné la mortalité chez les lapins. De plus, l’inhalation de chlorure d’allyle à une concentration de 11 mg/L pendant 2 heures a entraîné la mort des rats.
- Le chlorure d’allyle est un produit chimique toxique qui peut être absorbé par inhalation, ingestion et à travers la peau.
- C’est un puissant irritant de la peau et des muqueuses, et peut provoquer des symptômes tels qu’irritation des yeux, toux, essoufflement et engourdissement.
- À des concentrations élevées, le chlorure d’allyle peut provoquer un œdème pulmonaire (liquide dans les poumons), des lésions cardiaques, des lésions hépatiques et des lésions rénales.
- Il est également soupçonné d’être cancérigène et mutagène.
- La valeur limite d’exposition (TLV) pour le chlorure d’allyle est de 1 ppm (moyenne pondérée dans le temps sur 8 h). Cela signifie que la concentration moyenne de chlorure d’allyle dans l’air ne doit pas dépasser 1 ppm pour une journée de travail de 8 heures.
- La limite d’exposition à court terme pour le chlorure d’allyle est de 2 ppm. Cela signifie que la concentration de chlorure d’allyle dans l’air ne doit pas dépasser 2 ppm pendant une période de 15 minutes.
- Le chlorure d’allyle a une odeur piquante, mais cette odeur n’est pas un signal d’avertissement fiable. Le seuil de perception d’odeur pour le chlorure d’allyle est de 3 à 6 ppm, ce qui est considérablement au-dessus des concentrations de travail admissibles.
- Il existe peu de recherches sur les effets du chlorure d’allyle sur la santé humaine. Cependant, les preuves disponibles suggèrent qu’il s’agit d’un produit chimique toxique susceptible de causer divers problèmes de santé, notamment le cancer et des troubles de la reproduction.
Il est important de noter que les informations contenues dans le texte ne sont qu’un résumé de la toxicité connue du chlorure d’allyle. Les effets réels de l’exposition au chlorure d’allyle peuvent varier en fonction du niveau d’exposition de l’individu, de la durée de l’exposition et d’autres facteurs.
Références
- Allyl Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_425
- https://www.solvay.com/sites/g/files/srpend221/files/2021-01/PSS-Allyl-Chloride-Epichlorohydrin.pdf
FAQ
Qu'est-ce que le chlorure d'allyle ?
Le chlorure d’allyle, également connu sous le nom de 3-chloropropène, est un composé organique de formule chimique C3H5Cl. C’est un liquide incolore à jaune pâle qui revêt une importance dans le domaine de la chimie organique en raison de sa réactivité et de ses applications industrielles.
Quel est l'autre nom du chlorure d'allyle ?
Un autre nom pour le chlorure d’allyle est le 3-chloropropène. Ce nom alternatif reflète sa structure moléculaire, où un atome de chlore est attaché au troisième atome de carbone dans une molécule de propène.
Quelle est la densité du chlorure d'allyle ?
La densité du chlorure d’allyle est de 0,939 g/mL à 25 °C.
A quoi sert le chlorure d'allyle ?
Le chlorure d’allyle est principalement utilisé pour produire de l’épichlorhydrine, qui est utilisée pour fabriquer des résines époxy. Le chlorure d’allyle est également une matière première pour la synthèse de divers autres produits chimiques, tels que le glycérol, les esters, les éthers allyliques et les allylamines.
Comment se forme le chlorure d'allyle ?
Le chlorure d’allyle est produit par la chloration à haute température du propène, un processus connu sous le nom de chloration au propène. Cela implique de remplacer un atome d’hydrogène sur le carbone allylique par un atome de chlore. Plusieurs autres méthodes, telles que la chloration catalytique et l’oxychloration, sont également employées pour sa production.
Le chlorure d'allyle est-il toxique ?
Oui, le chlorure d’allyle est toxique et peut présenter des risques pour la santé en cas d’inhalation, de contact avec la peau ou d’ingestion. Il peut provoquer une irritation du système respiratoire, de la peau et des yeux. Une exposition prolongée ou des concentrations élevées peuvent entraîner des effets plus graves sur la santé. Des mesures de protection appropriées doivent être prises lors de la manipulation du chlorure d’allyle.
Quelle est l'odeur du chlorure d'allyle ?
Le chlorure d’allyle a une odeur piquante d’ail. L’odeur peut être détectée à de très faibles concentrations.
Avec quoi réagit le chlorure d'allyle ?
Le chlorure d’allyle est très réactif et peut subir diverses réactions chimiques. Il peut réagir avec une gamme de substances, y compris l’eau, les alcools, les amines et d’autres nucléophiles. Il est particulièrement réactif avec les métaux, les métaux alcalins et alcalino-terreux, ainsi qu’avec les agents oxydants forts comme l’acide sulfurique concentré. Ces réactions impliquent souvent des réactions de substitution ou d’addition au niveau du carbone allylique.
