Benzène : propriétés, réactions et utilisations
Le benzène (C6H6) est un liquide incolore et inflammable avec une odeur sucrée. Il s’agit d’un composé aromatique à cycle unique, ce qui signifie que ses atomes de carbone sont disposés dans un cycle avec des liaisons simples et doubles alternées. Le benzène est thermiquement stable et chimiquement réactif, ce qui en fait un précieux précurseur de nombreux autres produits chimiques.
Le benzène est principalement utilisé pour produire du styrène, du phénol et du cyclohexane, qui entrent dans la fabrication de plastiques, de résines et d’autres produits. Il est également utilisé comme solvant, mais son utilisation a diminué en raison de sa forte toxicité. Le benzène est également un composant de l’essence, où il est utilisé pour augmenter l’indice d’octane.
Le benzène a été isolé pour la première fois par Michael Faraday en 1825 et les procédés de production commerciale ont été développés au milieu du XIXe siècle. Aujourd’hui, le benzène est principalement obtenu à partir du pétrole.
Table des matières
1. Propriétés physiques du benzène
La structure Kekulé du benzène, un cycle à six carbones avec des liaisons simples et doubles alternées, ne peut expliquer ses propriétés. Le benzène est plus stable que prévu, son spectre RMN est inhabituel et ses longueurs de liaison sont intermédiaires entre les liaisons simples et doubles. Il est également plus réactif que les simples hydrocarbures.
Ces propriétés suggèrent que le benzène possède une structure hybride, avec des électrons délocalisés.
Le tableau 1 donne les propriétés physiques importantes du benzène :
| Propriété | Valeur |
|---|---|
| Poids moléculaire | 78,11 g/mol |
| Odeur | Doux |
| Couleur | Incolore |
| Densité à 20 °C | 0,879 g/cm³ |
| Point de fusion | 5,53 °C |
| Point d'ébullition | 80,01 °C |
| Indice de réfraction à 20 °C | 1.501 |
| Densité critique | 0,309 g/cm³ |
| Pression critique | 48,9 bars |
| Température critique | 288,9 °C |
| Point d'éclair | -11 °C |
| Température d'inflammation | 595 °C |
| Limites d'explosion dans l'air (vol%) | 1,4 à 6,7 |
| Viscosité à 20 °C | 0,654 mPa·s |
| Solubilité dans l'eau | Légèrement soluble |
| Solubilité dans les solvants organiques | Miscible avec la plupart des solvants organiques |
2. Propriétés chimiques du benzène
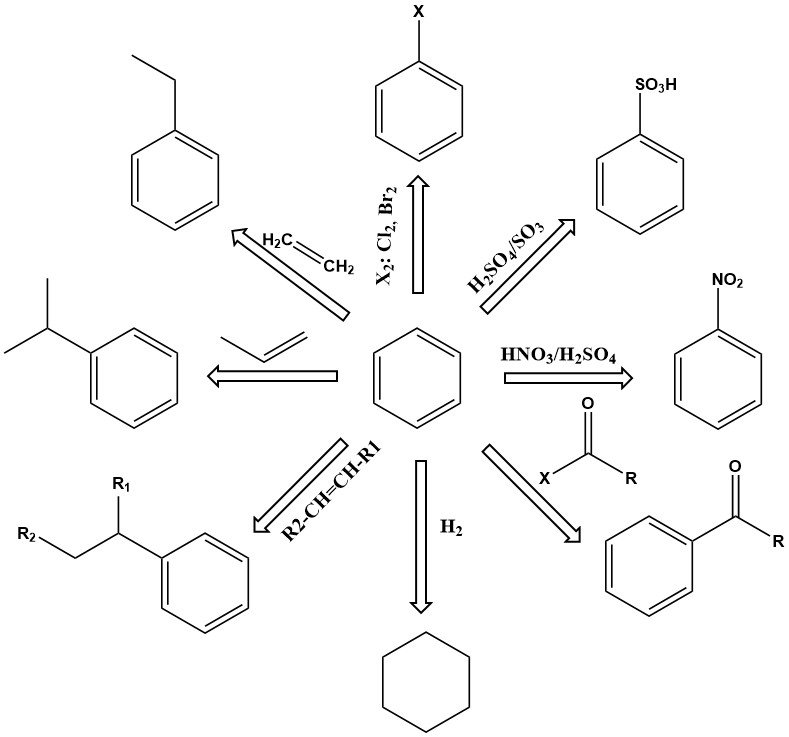
Le benzène, en tant qu’unité de base des composés aromatiques, est un produit chimique industriel majeur avec une large gamme d’applications. Il est thermiquement stable et subit diverses réactions, notamment la substitution, l’addition et la déshydrogénation, pour produire une myriade de produits utiles.
Les réactions de substitution du benzène sont de première importance. Selon les conditions de réaction, un ou plusieurs atomes d’hydrogène du cycle benzénique peuvent être échangés contre des groupes nitro, acide sulfonique, amine, hydroxyle, chlore, brome ou autres. Les produits comprennent le phénol, le nitrobenzène, le chlorobenzène, l’acide benzènesulfonique et bien d’autres.
D’autres réactions importantes du benzène impliquent une addition, comme l’alkylation et l’hydrogénation. Ces réactions se déroulent généralement à température et pression élevées, nécessitant parfois des catalyseurs actifs.
Par exemple, l’éthylbenzène est produit par alkylation du benzène avec de l’éthylène en présence d’un catalyseur de chlorure d’aluminium.
Le cumène est un autre produit d’addition primaire important du benzène, produit par l’alkylation catalytique en phase vapeur du benzène avec du propène sur des catalyseurs à l’acide phosphorique ou au kieselguhr à 200-250 °C et sous une pression manométrique de 2,7-4,2 MPa.
L’hydrogénation est également une réaction d’addition. L’un des plus importants est l’hydrogénation du benzène pour produire du cyclohexane.
La déshydrogénation de l’éthylbenzène en styrène est une réaction commerciale importante. Cette réaction endothermique nécessite une température élevée pour se dérouler cinétiquement et thermodynamiquement.
Le benzène est une matière première essentielle pour la production de nombreux autres produits chimiques importants, notamment les plastiques, les résines, les détergents et les produits pharmaceutiques. La plupart des réactions discutées dans ce chapitre sont des réactions primaires du benzène. Un nombre incalculable de réactions et de produits dépendent du benzène, directement ou indirectement, comme source.
3. Matières premières pour le benzène
Le benzène et ses homologues, tels que le toluène et les xylènes, se trouvent dans le pétrole brut en petites quantités, ce qui rend la séparation physique et la récupération peu pratiques. Les fractions de pétrole brut d’Arabie saoudite et du Royaume-Uni ont de faibles teneurs en benzène, toluène et xylène (BTX), mais des teneurs plus élevées en naphtène.
Les bruts plus lourds et les bruts synthétiques issus des sables bitumineux peuvent avoir des teneurs aromatiques plus élevées dans la fraction naphta léger. Une analyse de la fraction naphta C5-150 °C provenant d’un brut conventionnel et d’un naphta synthétique dérivé des sables bitumineux de l’Athabasca montre que le naphta synthétique a des teneurs en aromatiques et en naphtène inférieures à celles de la fraction brute conventionnelle.
Cependant, la fraction de naphta la plus élevée du brut synthétique a une teneur en aromatiques considérablement plus élevée (32 contre 19 %), bien que la teneur en naphtène soit plus faible. Cela est probablement dû à la désalkylation ou à l’ouverture du cycle des composés aromatiques de masse moléculaire plus élevée présents dans le bitume.
- Visitez le lien pour un article détaillé sur la production de benzène →
4. Utilisations du benzène
Le benzène est utilisé pour produire de l’éthylbenzène, du cumène et du cyclohexane, qui représentent 75 à 80 % de sa consommation en tant que matière première chimique.
L’éthylbenzène est déshydrogéné en styrène, le monomère de polymères importants tels que les résines acrylique-butadiène-styrène et le caoutchouc styrène-butadiène.
Le cumène est utilisé pour produire du phénol et de l’acétone. Le phénol est principalement utilisé pour les résines phénoliques.
Le cyclohexane est utilisé pour produire de l’acide adipique, utilisé dans la fabrication des nylons.
Environ 5 % du benzène est nitré en nitrobenzène, qui est ensuite hydrogéné en aniline.
Le benzène peut également être oxydé en anhydride maléique, un précurseur des résines polyester.
D’autres produits benzéniques comprennent les benzènes halogénés et les alkylbenzènes linéaires, qui sont utilisés pour fabriquer des détergents.
5. Toxicologie et santé au travail du benzène
Le benzène est un composé toxique pouvant provoquer des effets aigus et chroniques. Il est absorbé par inhalation, ingestion ou absorption cutanée. Une intoxication aiguë peut entraîner des maux de tête, de la confusion, une perte de contrôle musculaire et une irritation des voies respiratoires et gastro-intestinales. Des concentrations plus élevées peuvent entraîner une perte de conscience ou la mort. Une exposition chronique peut entraîner une anémie et une leucémie.
L’inhalation est la principale source d’intoxication au benzène. L’ingestion peut provoquer une irritation de la bouche, de l’œsophage et de l’estomac. L’absorption cutanée n’est pas une source importante d’intoxication.
Plusieurs études ont étudié la toxicité du benzène. Il est absorbé sélectivement par les poumons et retenu dans divers tissus corporels. Le benzène est métabolisé lentement, formant des intermédiaires toxiques. La susceptibilité individuelle à l’empoisonnement varie.
L’exposition au benzène a été associée à la leucémie, à la pancytopénie et à l’anémie aplasique. Des recherches supplémentaires sont nécessaires pour déterminer la relation causale exacte.
Les émissions de benzène proviennent de l’essence automobile, de la carbonisation du charbon et, historiquement, des solvants contenant du benzène.
La prévention de l’intoxication au benzène implique de bonnes pratiques de laboratoire et d’usine, la minimisation des concentrations dans les zones de travail et l’utilisation de mesures de protection.
Les organismes de réglementation ont établi des limites d’exposition pour le benzène et l’ont classé comme substance potentiellement cancérigène.
Des réglementations récentes visent à réduire les émissions de composés organiques volatils, notamment le benzène, provenant des raffineries de pétrole et des usines chimiques.
Les études et les efforts réglementaires en cours reflètent l’engagement actif dans la compréhension et le contrôle de la toxicité du benzène.
Des recherches continues et des mesures strictes sont nécessaires pour atténuer les risques associés à l’exposition au benzène.
Référence
- Benzene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_475
