Acide tartrique : propriétés, réactions, production et utilisations
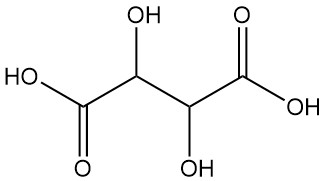
L’acide tartrique, également connu sous le nom d’acidum tartaricum, acide 2,3-dihydroxybutanedioïque (nomenclature IUPAC), est un acide organique cristallin blanc présent naturellement dans de nombreux fruits de formule C4H6O6. La molécule possède deux centres carbonés asymétriques avec deux groupes acide carboxylique et un dialcool dans la même molécule, ce qui donne quatre stéréoisomères.
Énantiomères :
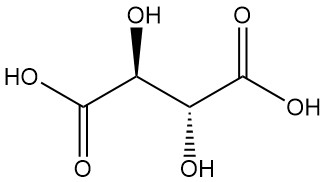
- L(+)-acide tartrique et D(-)-acide tartrique sont des isomères optiquement actifs, qui font tourner le plan de la lumière polarisée. Ces molécules en image miroir (énantiomères) partagent des propriétés physiques et chimiques identiques, à l’exception de rotations optiques opposées.
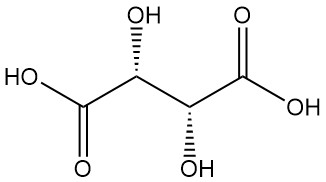
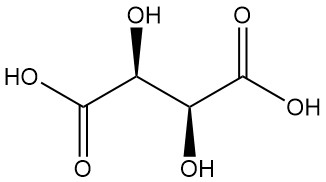
Diastérééomères :
- L’acide DL-tartrique (mélange racémique) est une combinaison synthétique équimolaire de formes L(+) et D(-). Il est optiquement inactif en raison d’une compensation interne.
- L’acide méso-tartrique (acide tartrique insoluble) est un autre diastéréoisomère optiquement inactif doté de propriétés physiques distinctes par rapport aux formes active et racémique. Ni les acides racémiques ni les méso-tartriques sont des acides optiquement actifs.
L’acide tartrique, connu depuis l’Antiquité pour son sel de potassium (tartre), a été isolé pour la première fois par Scheele au XVIIIe siècle. Berzelius en détermina la structure en 1830. Les travaux révolutionnaires de Pasteur (1848-1860) sur les sels de l’acide tartrique révolutionnèrent la chimie organique.
Il a expliqué le lien entre les formes racémiques et optiquement actives en séparant les cristaux de tartrate de sodium et d’ammonium et en démontrant leurs rotations optiques correspondantes.
L’acide L(+)-tartrique est la forme naturelle prédominante et la variante produite commercialement. On le trouve sous forme d’acide ou de sel dans diverses plantes, notamment dans le raisin, où il s’accumule sous forme de bitartrate de potassium (tartre) lors de la fermentation du vin. Ce précipité insoluble est la principale source de production commerciale d’acide L(+)-tartrique.
Table des matières
1. Propriétés physiques de l’acide tartrique
Les propriétés physiques de l’acide L(+)-tartrique naturel sont données dans le tableau 1, et elles sont identiques à celles de l’acide D(-)-tartrique.
L’acide tartrique est un solide inodore avec un fort goût acide et stable dans l’air.
Les solutions d’acide tartrique ont une rotation optique qui varie en fonction de la concentration, comme représenté par l’équation suivante :
[α] =15,050-0,1535c
où c est la concentration d’acide tartrique comprise entre 20 et 50 % en poids/vol.
Le tableau 2 présente la solubilité à différentes températures.
À différentes températures (°C), la densité relative des solutions d’acide tartrique est répertoriée dans le tableau 3.
| Propriété | Valeur |
|---|---|
| Masse moléculaire | 150,09 g/mol |
| Forme cristalline | Aiguilles monocliniques anhydres (au-dessus de 5 °C) |
| Densité | 1,7598 g/cm³ |
| Point de fusion | 169-170 °C |
| Apparence | Cristaux incolores |
| Décomposition | Au-dessus de 220 °C (odeur de sucre caramélisé) |
| Solubilité | |
| Eau | Très soluble |
| Alcool (18 °C) | 20,4 g pour 100 g |
| Éther diéthylique (18 °C) | 0,3 g pour 100 g |
| Rotation optique à 20 % poids/vol | +11,98° ( -11,98° pour l'acide D(-)-tartrique) |
| Enthalpie de combustion | 1 149,9 kJ/mol |
| Capacité thermique spécifique (0-100 °C) | 1 237 kJ kg⁻¹ K⁻¹ |
| Constantes de dissociation acide (25 °C) |
K₁ = 1,17 × 10⁻³ K₂ = 5,0 × 10⁻⁵ |
| Points d'ébullition des solutions |
Solution à 25 % : 102,2 °C Solution à 50 % : 106,7 °C |
| Indice de réfraction au point de fusion (170 °C) | 1.464 |
| Température (°C) | 0 | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Solubilité (g/100 g H₂O) | 115 | 120 | 125 | 139 | 156 | 176 | 195 | 218 | 244 | 273 | 307 | 343 |
| Température (°C) | Densité |
|---|---|
| 1 | 1.0045 |
| 10 | 1.0469 |
| 20 | 1.0969 |
| 30 | 1.1505 |
| 40 | 1.2078 |
| 50 | 1.2696 |
2. Réactions chimiques de l’acide tartrique
L’acide L(+)-tartrique fond entre 170 et 180 °C et s’isomérise (réorganise sa structure) en acide métatartrique sans perte d’eau. Un chauffage supplémentaire donne des anhydrides amorphes. Ces anhydrides se transforment en acide tartrique lorsqu’ils sont bouillis avec de l’eau.
Au-dessus de 220 °C, l’acide tartrique se décompose, gonfle et s’enflamme, laissant un résidu carboné.
L’acide tartrique est très sensible aux agents oxydants. L’oxydation de l’acide tartrique par le peroxyde d’hydrogène et le sulfate ferreux (réactif de Fenton) produit de l’acide dioxosuccinique.
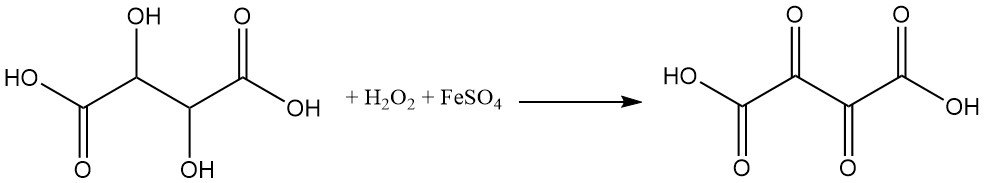
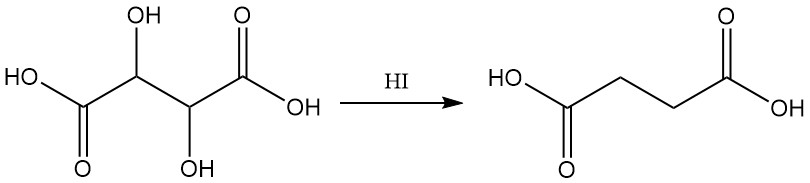
La réduction avec de l’acide iodhydrique donne de l’acide succinique.
Les tartrates en solution réagissent avec le nitrate d’ammonio-argent pour produire de l’argent métallique.
L’acide tartrique est utilisé comme agent complexant pour inhiber la précipitation des sels de métaux lourds par les bases.
L’ébullition prolongée de solutions d’acide L(+)-tartrique avec des alcalis (KOH ou NaOH) entraîne la formation de substances racémiques et acides méso-tartriques.
3. Ressources naturelles d’acide tartrique
L’acide L(+)-tartrique est le seul isomère produit commercialement à grande échelle. La matière première exclusive provient de résidus naturels générés lors de la vinification. Ces résidus contiennent principalement de l’acide tartrique sous forme de bitartrate de potassium (crème de tartre) et, dans une moindre mesure, du tartrate de calcium.
Les sources d’acide tartrique sont les suivantes :
- Tartre est un précipité rougeâtre qui se dépose sur les parois des cuves à vin à mesure que la concentration d’éthanol augmente. Il contient une concentration élevée (80 à 90 %) de bitartrate de potassium.
- Lies : ces sédiments se déposent au fond des cuves à vin et contiennent une concentration plus faible (19 à 38 %) de bitartrate de potassium.
- Lies séchées : ce sont des lies transformées avec une teneur plus élevée (55 à 70 %) en bitartrate de potassium.
- Sous-produit de distillerie : les distilleries obtiennent ce matériau à partir de lies de vin ou de marc de raisin (les restes solides après pressurage du raisin). Après avoir éliminé l’alcool par distillation, les lies ou le marc sont traités avec de l’hydroxyde de calcium pour précipiter le tartrate de calcium.
4. Production d’acide tartrique
Bien qu’il existe plusieurs isomères de l’acide tartrique, l’acide L(+)-tartrique est le seul isomère produit commercialement à grande échelle. Une très petite quantité d’acide racémique est également synthétisée pour des applications spécifiques.
4.1. Production d’acide L(+)-tartrique
Les principaux producteurs d’acide L(+)-tartrique sont situés en Espagne, en France et en Italie. Par exemple, la Société Legré-Mante, créée en 1784, représente l’un des plus anciens producteurs.
Toutes les méthodes de production d’acide L(+)-tartrique reposent sur la décomposition du tartrate de calcium avec l’acide sulfurique. Historiquement, deux méthodes concurrentes étaient utilisées pour obtenir la matière première (tartrate de calcium) : le procédé acide Scheurer-Kestner et le procédé neutre Scheele-Lowitz (incluant la variante Desfosses).
Actuellement, le procédé neutre, plus économique, est la méthode dominante.
La matière première séchée (tartre ou lies) est d’abord broyée puis torréfiée à 160 °C pendant 2 heures dans une torréfaction. Cette étape élimine les impuretés organiques qui pourraient rendre la filtration difficile dans les étapes ultérieures.
Le produit torréfié à chaud est transféré dans un réacteur, où il est dilué avec de l’eau et neutralisé avec de l’hydroxyde de calcium jusqu’à un pH de 5. La température de réaction est maintenue à 70 °C.
Pour améliorer l’efficacité de la réaction et minimiser les pertes, un excès de 10 % de chlorure de calcium ou de sulfate de calcium est ajouté par rapport à la quantité stoechiométrique requise. La réaction chimique suivante a lieu :
2 KHC4H4O6 + Ca(OH)2 + CaCl2 → 2 CaC4H4O6 + 2 KCl + 2 H2O
Le tartrate de calcium formé est séparé du liquide restant (liqueur mère) par filtration à l’aide d’un filtre rotatif puis lavé. Si la matière première provient de distilleries, cette étape initiale peut être contournée.
Dans la deuxième étape, le tartrate de calcium obtenu est décomposé dans une solution aqueuse à l’aide d’acide sulfurique. Cette réaction donne une solution d’acide tartrique et du sulfate de calcium insoluble :
CaC4H4O6 + H2SO4 → H2C4H4O6 + CaSO4
Un excès d’environ 5% d’acide sulfurique par rapport à la quantité d’acide tartrique est utilisé pour optimiser la réaction. Le mélange obtenu est filtré et lavé pour éliminer les impuretés.
La solution d’acide tartrique rouge, d’une concentration d’environ 200 g/L, est ensuite concentrée dans des évaporateurs sous vide à 70 °C pour atteindre une concentration de 650 g/L. Une concentration supplémentaire sous vide à 70 °C se produit jusqu’à ce que des cristaux commencent à se former (à environ 1 300 g/L).
Ce mélange de cristaux liquides est ensuite transféré vers des cristalliseurs pour un refroidissement lent, favorisant un rendement cristallin maximal. Après refroidissement, le mélange est séché dans des centrifugeuses pour séparer les cristaux de la liqueur mère.
La liqueur mère, contenant encore de l’acide tartrique, subit des cycles répétés d’évaporation, de granulation et de séchage pour maximiser le rendement en acide tartrique granulé. Les granulés obtenus sont refroidis pour former une solution d’acide tartrique à 650 g/L.
Cette solution subit un traitement ultérieur, notamment une décoloration avec du charbon actif et une purification chimique pour éliminer l’excès de fer et d’acide sulfurique, le tout effectué à 70 °C. Il est ensuite filtré et concentré sous vide jusqu’à début de cristallisation.
Le mélange est ensuite transféré vers des cristalliseurs ou refroidi pour maximiser le rendement cristallin. Le mélange est ensuite séparé par centrifugation. La liqueur mère, contenant de l’acide tartrique résiduel, subit d’autres cycles d’évaporation, de granulation et de séchage avant d’être retraitée.
Les granulés purifiés sont séchés à l’étuve à 140 °C puis tamisés en différentes granulométries allant de 2000 μm à moins de 100 μm (poudre).
Bien que le processus décrit ci-dessus soit la méthode principale, d’autres processus de production ont été explorés. Il s’agit notamment de la production par fermentation d’acide L(+)-tartrique et de la synthèse chimique de l’acide DL-tartrique racémique.
4.2. Production d’acide L(+)-tartrique par fermentation
Alors que la méthode de production conventionnelle de l’acide L(+)-tartrique repose sur des réactions chimiques, des recherches sont en cours sur des alternatives basées sur la fermentation.
Deux souches bactériennes principales ont été explorées à cet effet :
- Acetobacter suboxydans : Cette espèce bactérienne a été étudiée pour sa capacité à convertir le glucose en acide L(+)-tartrique.
- Nocardia tartaricans : Cette bactérie est prometteuse dans la conversion de l’acide cis-époxysuccinique et de ses dérivés sodiques en produit souhaité.
4.3. Synthèse chimique de l’acide DL-tartrique racémique
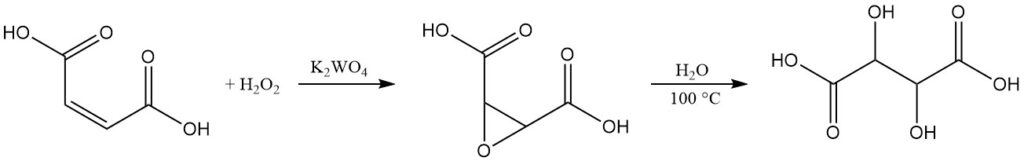
Alors que l’acide L(+)-tartrique domine le marché commercial, il existe un procédé de production à petite échelle pour l’acide DL-tartrique racémique.
Cette méthode commence par l’acide maléique ou ses sels. Dans une solution aqueuse, l’acide maléique subit une oxydation en utilisant du peroxyde d’hydrogène à 35 % en présence de tungstate de potassium comme catalyseur. Cette réaction donne de l’acide époxy-succinique, un produit intermédiaire.
En faisant bouillir le mélange réactionnel, l’acide époxy-succinique s’hydrolyse pour former de l’acide tartrique racémique. Après refroidissement, le produit final est isolé par centrifugation, lavage et séchage.
Plusieurs variantes de ce processus ont été explorées et documentées dans des publications scientifiques. Cette activité de recherche se reflète également dans de nombreuses demandes de brevet déposées pour cette méthode.
Actuellement, la production commerciale d’acide DL-tartrique racémique reste limitée, avec une seule petite unité de production en activité en Afrique du Sud.
5. Dérivés de l’acide L(+)-tartrique
L’acide tartrique forme facilement de nombreux sels et esters, certains trouvant des applications commerciales importantes. Cette section traite des composés les plus connus.
5.1. Tartrate de potassium et de sodium
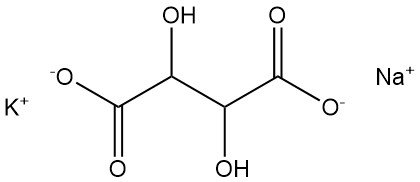
Le tartrate de sodium et de potassium, également connu sous le nom de sel de Seignette ou sel de Rochelle, a été découvert en 1672 par Pierre Seignette.
Propriétés physiques :
- Formule : KNaC4H4O6 · 4 H2O
- Numéro CAS : [6381-59-5]
- Masse molaire : 282,23 g/mol
- Densité : 1,79 g/cm³
- Point de fusion : 70 à 80 °C (se décompose à 220 °C)
- Solubilité : 26 g/100 ml d’eau à 0 °C, 66 g/100 ml d’eau à 26 °C
La matière première pour la production de tartrate de sodium et de potassium est du tartre avec une teneur minimale en acide tartrique de 68 %.
Cette solution est diluée avec de l’eau, neutralisée avec de la soude chaude, décolorée avec du charbon actif, puis filtrée. Le filtrat est concentré par évaporation, puis cristallisé par refroidissement pour produire le sel solide, qui est séparé, lavé, séché et tamisé avant emballage.
La granulométrie commerciale varie de 2 000 μm à < 250 µm (poudre).
5.2. Bitartrate de potassium
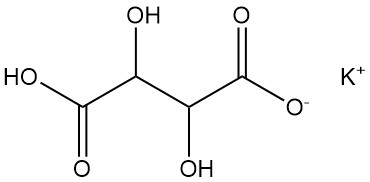
Le bitartrate de potassium est communément appelé crème de tartre.
Propriétés physiques :
- Formule : KHC4H4O6
- Numéro CAS : [868-14-4]
- Densité : 1,96 g/cm³
- Solubilité : 0,57 g/100 ml d’eau à 20 °C, 6,1 g/100 ml d’eau à 100 °C
Il est principalement obtenu à partir des solution-mères restantes après la production du sel de Rochelle. Le bitartrate de potassium est décoloré, purifié, filtré, acidifié avec de l’acide chlorhydrique ou de l’acide sulfurique, précipité, centrifugé, séché, broyé et conditionné sous forme de poudre fine.
5.3. Tartrate d’antimoine de potassium
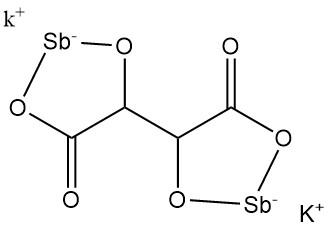
Le tartrate d’antimoine de potassium (tartre émétique) a été découvert en 1631 par Adrien de Mynsicht.
Propriétés physiques :
- Formule : KSbC4H2O6 · 1,5 H2O
- Numéro CAS : [28300-74-5]
- Masse molaire : 333,93 g/mol
- Densité : 2,61 g/cm³
- Solubilité : 8,7 g/100 ml d’eau à 25 °C, 35,7 g/100 ml d’eau à 100 °C
Le tartrate d’antimoine de potassium est produit par la réaction de l’oxyde d’antimoine avec la crème de tartre dans l’eau, suivie de la concentration de la solution résiduelle et la cristallisation. Après filtration, les cristaux sont séchés et pulvérisés.
5.4. Acide métatartrique
L’acide métatartrique est produit en chauffant l’acide tartrique à 170-180 °C. Cette conversion implique une estérification interne au sein des molécules d’acide tartrique, conduisant à un produit plus ou moins polymérisé. L’acide métatartrique possède des propriétés inhibitrices exceptionnelles contre la précipitation des sels d’acide tartrique.
6. Utilisations de l’acide tartrique
L(+)-acide tartrique et ses dérivés sont utilisés dans diverses industries, notamment l’alimentation, les produits pharmaceutiques, la viniculture et autres.
L’acide L(+)-tartrique (E 334) est utilisé :
- comme agent acidifiant dans les moûts de vin, les bonbons, les gelées, les confitures, les nectars de fruits, les glaces, les gélatines et les pâtes, améliorant ainsi leurs profils aromatiques.
- pour conserver les fruits, les légumes ou le poisson en tant qu’antioxydant synergique, stabilisant le pH, la couleur, le goût et la valeur nutritionnelle.
- Comme antioxydant dans les graisses et les huiles.
- Dans la préparation de boissons gazeuses.
- En tant qu’excipient ou support pour les ingrédients pharmaceutiques actifs, aidant à corriger la basicité.
- En tant qu’agent acidifiant pour comprimés et poudres moussants en raison de sa stabilité et de sa haute solubilité
- Comme retardateur dans l’industrie du ciment, notamment avec le plâtre et le gypse.
- Dans le polissage et le nettoyage des métaux.
La crème de tartre (E 336) est utilisée pour accélérer la précipitation des sels d’acide tartrique dans le vin, dans la production de levures chimiques et comme laxatif dans certaines formulations médicamenteuses. .
Le sel de Seignette (E 337) est utilisé dans les procédés de galvanoplastie pour améliorer le dépôt et le rendement, en électronique et en piézoélectricité, comme agent réducteur dans l’argenture des miroirs, et comme un constituant de la solution de Fehling. Il est également utilisé comme régulateur de combustion dans la production de papier à cigarettes, comme laxatif dans certains produits pharmaceutiques et comme mordant dans les industries du textile et du cuir.
En petites quantités, le tartrate d’antimoine de potassium est utilisé comme expectorant dans les sirops contre la toux et aide au traitement de certaines maladies tropicales.
L’acide métatartrique est utilisé pour inhiber la cristallisation du tartrate dans les vins de table.
Les tartrates de monoglycérides et diglycérides d’acides gras sont utilisés comme émulsifiants dans l’industrie de la boulangerie.
7. Toxicologie de l’acide tartrique
Contrairement à l’acide citrique, l’acide tartrique n’est pas directement impliqué dans le cycle de Krebs (voie de production d’énergie) du corps humain.
L’acide L(+)-tartrique, la forme naturelle, se trouve dans les fruits et le vin. Après prise orale, environ 20 % sont éliminés par les urines, tandis qu’une part importante subit une dégradation bactérienne par le microbiote intestinal. Aucune trace n’est détectable dans les selles.
L’acide tartrique absorbé est rapidement éliminé de la circulation sanguine et soit excrété par les reins, soit métabolisé dans divers tissus.
Des études à long terme chez des rats utilisant du tartrate de L(+)-sodium n’ont révélé aucun signe de toxicité ou de cancérogénicité. De plus, aucun effet négatif sur la fonction rénale ou la pathologie n’a été observé à une dose quotidienne de 3 g/kg de poids corporel.
L’acide racémique (DL)-tartrique a été moins étudié et les recherches suggèrent qu’il se comporte différemment de l’isomère L (+) naturel.
L’acide DL-tartrique est éliminé de la circulation sanguine à un rythme plus lent et s’accumule pendant une période plus longue dans les reins, provoquant potentiellement une prise de poids dans ces organes. En raison de cet effet néphrotoxique, la forme DL n’est pas approuvée pour une utilisation alimentaire ou pharmaceutique.
Références
- Tartaric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a26_163
- Tartaric Acid; Van Nostrand’s Encyclopedia of Chemistry. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471740039.vec2453
- Organic Acids in Fruits. https://onlinelibrary.wiley.com/doi/abs/10.1002/9781119431077.ch8
- Tartaric acid. https://www.sciencedirect.com/science/article/abs/pii/B9780128190968000197
