Acide fumarique : propriétés, production et utilisations
Qu’est-ce que l’acide fumarique ?
L’acide fumarique, également connu sous le nom d’acide trans-butènedioïque, est un acide dicarboxylique de formule C4H4O4. Il est largement présent dans la nature et se présente sous la forme d’un solide cristallin blanc au goût fruité.
L’acide fumarique a été isolé pour la première fois à partir de la fumeterre (Fumaria officinalis) par Winckler en 1832. Il a ensuite été identifié sous divers noms, notamment l’acide bolétique, l’acide glaucinium, l’acide lichénique et l’acide paramaléique.
L’acide fumarique est aujourd’hui produit industriellement, bien qu’il soit moins important que l’anhydride maléique.
Table des matières
1. Propriétés physiques de l’acide fumarique
L’acide fumarique cristallise sous forme de prismes monocliniques. Il est soluble dans l’éthanol et l’acide sulfurique concentré, légèrement soluble dans l’éther éthylique et l’acétone, et insoluble dans le chloroforme et le benzène. Une solution aqueuse à 0,05 % d’acide fumarique à 25 °C a un pH de 3,0-3,2.
Les propriétés physiques importantes de l’acide fumarique sont résumées dans le tableau ci-dessous.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [110-17-8] |
| Formule chimique | C4H4O4 |
| Poids moléculaire | 116,07 g/mol |
| Point de fusion | 286–287 °C (tube fermé) |
| Température de sublimation | 200 °C |
| Densité (solide) | 1,635 g/cm3 |
| Chaleur de sublimation (92 °C) | 136,1 kJ/mol |
| pKa1 | 3,02 |
| pKa2 | 4,38 |
| Solubilité dans 100 g d'eau | 0,428 g (à 15,5 °C) |
| 9,97 g (à 100 °C) | |
| Point d'éclair | 273 °C (coupelle ouverte) 230 °C (coupelle fermée) |
| Température d'auto-inflammation | 375 °C (poudre) |
2. Propriétés chimiques de l’acide fumarique
L’acide fumarique se sublime sans se décomposer à 200 °C ou légèrement au-dessus, mais lorsqu’il est chauffé au-dessus de 230 °C, il se décompose pour former de l’anhydride maléique, de l’eau et une quantité importante de résidus. La présence de pentoxyde de phosphore catalyse la formation d’anhydride maléique.
L’acide fumarique est l’isomère trans de l’acide maléique et partage de nombreuses propriétés chimiques avec lui. Cependant, les réactions se déroulent généralement lentement pour l’acide fumarique, en partie en raison de sa plus faible solubilité dans l’eau.
Contrairement à l’acide maléique, l’acide fumarique peut former un chlorure d’acide. (pour plus de détails sur les réactions, consultez l’article sur l’acide maléique.)
3. Production d’acide fumarique
L’acide fumarique est principalement fabriqué par l’isomérisation de l’acide maléique ou de l’anhydride maléique (Figure 1). Ces matières premières proviennent souvent de flux d’eau de lavage générés lors de la production d’anhydride maléique ou d’anhydride phtalique, avec une concentration minimale préférée en acide maléique de 30 %.
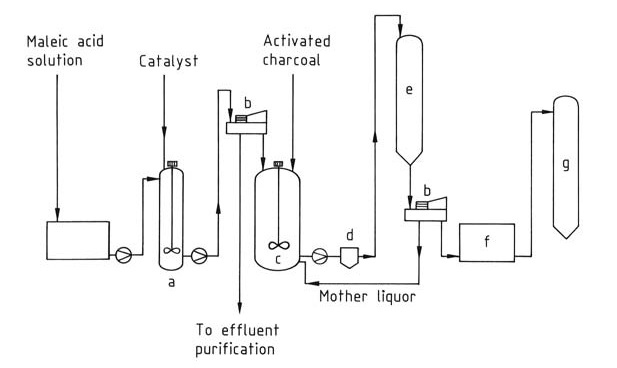
a) Cuve d'isomérisation ; b) Centrifugeuse ; c) Cuve de dissolution ; d) Filtre ; e) Cristallisoir ; f) Sécheur ; g) Silo
Le processus d’isomérisation convertit l’acide maléique de manière presque quantitative en acide fumarique moins soluble, qui est ensuite séparé par filtration. Cette conversion peut être réalisée par traitement thermique ou à l’aide de catalyseurs. Plusieurs catalyseurs ont été explorés, notamment :
- Les acides minéraux (par exemple, acide chlorhydrique)
- Les composés à base de soufre comme les thiocyanates, les thiazoles, les thiosemicarbazides et les thiourées
- Les composés bromés combinés à des peroxydes (par exemple, le persulfate)
Parmi ceux-ci, la thiourée est le catalyseur le plus couramment utilisé dans l’industrie.
L’eau de lavage du matériau de départ peut contenir des impuretés qui ont un impact sur la qualité et le rendement du produit. Ce problème peut être évité en prétraitant thermiquement l’eau de lavage, en ajoutant de l’urée en même temps que la thiourée comme catalyseur, ou en ajoutant des sulfites ou du gaz de dioxyde de soufre, puis des acides minéraux.
L’acide fumarique brut obtenu est purifié par recristallisation dans l’eau et traitement au charbon actif. Ces processus de purification entraînent une perte de produit d’environ 10 %.
La production d’acide fumarique est généralement une opération par lots, bien qu’il existe des processus continus. Il est recommandé de choisir un équipement en acier austénitique résistant à la corrosion, en particulier si l’acide chlorhydrique n’est pas impliqué dans le processus.
L’élimination de la liqueur mère restante de l’étape d’isomérisation présente un défi en raison de la présence d’impuretés solubles et du catalyseur utilisé. La combustion est une solution potentielle pour ce flux de déchets.
Une méthode de production alternative, employée aux États-Unis, utilise la fermentation de monosaccharides ou d’amidon avec des souches fongiques spécifiques telles que Mucor, Aspergillus et Rhizopus.
4. Utilisations de l’acide fumarique
L’acide fumarique est un additif alimentaire courant (E297) utilisé comme acidulant ou agent acidifiant pour rehausser la saveur de produits tels que les boissons, les produits de boulangerie (en particulier le pain de seigle et le pain au levain) et les garnitures. De plus, il agit comme conservateur en prolongeant la durée de conservation d’articles tels que les tortillas de blé.
L’acide fumarique a été utilisé dans les médicaments oraux et fait l’objet de recherches pour son rôle potentiel dans le traitement du psoriasis.
Il est utilisé comme intermédiaire dans la production de divers produits chimiques et dans les cosmétiques (par exemple, les sels de bain et les nettoyants pour prothèses dentaires).
L’acide fumarique est souvent préféré à l’acide maléique pour la production de polyesters et de copolymères. Au cours du processus de production de ces produits, l’isomérisation conduit à un mélange presque égal d’isomères trans et cis des acides dicarboxyliques, quel que soit le matériau de départ (acide maléique ou fumarique).
Cependant, l’acide fumarique est préféré en raison de son profil de sécurité (nature inoffensive). Dans certains cas, l’utilisation de l’acide fumarique peut entraîner des effets spécifiques, comme une augmentation de la dureté de certaines résines.
L’acide fumarique (Fumaril) et le fumarate de fer (II) sont utilisés comme additifs spécialisés dans les aliments pour animaux.
5. Toxicologie de l’acide fumarique
L’acide fumarique est un produit naturel avec un profil de sécurité favorable (non toxique) basé sur diverses études.
Les études animales indiquent une faible toxicité aiguë. Les valeurs de DL50 orales chez les rats dépassent 10 g/kg de poids corporel, et l’application cutanée chez les lapins jusqu’à 20 g/kg n’était pas mortelle.
L’administration à long terme d’acide fumarique à 8 mg/kg de poids corporel par jour pendant un an chez l’homme n’a pas provoqué de changements dans le sang, l’urine ou la fonction hépatique.
Aucune preuve d’effets génotoxiques (dommages à l’ADN), de cancérogénicité (causant le cancer) ou de toxicité pour la reproduction n’a été observée dans les expériences.
Cependant, l’acide fumarique peut agir comme un irritant local. Il est classé comme légèrement irritant pour la peau et modérément irritant pour les yeux et les muqueuses en cas de contact.
Références
- Maleic and Fumaric Acids; ULLMANN’S Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_053
- https://pubchem.ncbi.nlm.nih.gov/compound/Fumaric-Acid
