Acide Citrique: production, réactions et utilisations
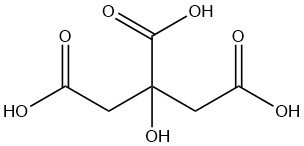
L’acide citrique est un acide organique faible présent naturellement dans les agrumes, en particulier les citrons et les limes. C’est un solide cristallin incolore à température ambiante de formule C6H8O7.
L’acide citrique est un acide tricarboxylique. Il a été isolé et cristallisé en 1784 par SCHEELE, qui a précipité le citrate de calcium en ajoutant de la chaux au jus de citron. La présence de trois groupes carboxyle et d’un groupe hydroxyle a été reconnue par LIEBIG en 1838.
L’acide citrique a été préparé pour la première fois à partir de citrate de calcium en 1860 au Royaume-Uni. En 1880, l’acide citrique était produit à partir de citrate de calcium en France, en Allemagne et aux États-Unis.
Les agrumes contiennent de l’acide citrique en grande quantité, de 5% dans le fruit à 9% dans le jus. L’acide citrique se trouve également dans de nombreux autres fruits. En plus des fruits, l’acide citrique se trouve dans presque toutes les espèces végétales et animales.
Le cycle de l’acide citrique, également connu sous le nom de cycle de Krebs ou cycle de l’acide tricarboxylique, est essentiel dans l’oxydation des sucres et des acétates en dioxyde de carbone et en eau, libérant de l’énergie pour les fonctions physiologiques.
Table des matières
1. Production d'acide citrique
Pendant environ 50 ans, l’acide citrique a été obtenu exclusivement à partir d’agrumes non mûrs. Dans le sud de l’Italie, toute une industrie avec des vergers et des installations de transformation était consacrée à cet effet.
Le jus a été pressé à partir de fruits non mûrs et mélangé avec de la chaux (CaO) pour précipiter le citrate de calcium. Le solide a été traité avec de l’acide sulfurique pour précipiter le sulfate de calcium et former une solution à partir de laquelle l’acide citrique a été cristallisé.
Le rendement en produit purifié était d’environ 2 à 3 % en poids du fruit ; des huiles d’agrumes ont également été obtenues. Cette procédure a été remplacée par la fermentation.
1. Production d’acide citrique par fermentation
La méthode la plus économique pour produire de l’acide citrique depuis les années 1930 est la fermentation, qui utilise des souches d’A. niger pour convertir les glucides en acide citrique. La fermentation en surface et la fermentation submergée sont utilisées dans les usines de production à grande échelle.
Certaines usines plus petites utilisent la fermentation à l’état solide à base de glucides présents dans les déchets agricoles ou les sous-produits agricoles.
Les processus biochimiques qui conduisent à l’excrétion d’acide citrique font l’objet d’études par de nombreux chercheurs depuis déjà plus d’un siècle.
Le rendement théorique à partir de 100 kg de saccharose est de 123 kg d’acide citrique monohydraté ou 112 kg d’acide anhydre. Cependant, comme A. niger utilise du sucre pour sa croissance et sa respiration, le rendement industriel réel du processus de fermentation est inférieur. Elle varie entre 60 et 85 % de la valeur théorique, en fonction de facteurs tels que la pureté du substrat, la souche particulière d’A. niger et le contrôle de la fermentation.
1.1. Fermentation à l’état solide
Dans la fermentation à l’état solide, un résidu agricole qui contient des hydrates de carbone est étalé dans des tranchées et humidifié avec de l’eau.
Les résidus agricoles possibles sont, par exemple, le marc de pomme, la bagasse de manioc, la cosse de café, les épis de maïs, le marc de raisin, les déchets de kiwi, d’okara, d’orange, d’ananas et de canne à sucre.
Des nutriments peuvent être ajoutés à l’eau si nécessaire et la tranchée est ensuite inoculée avec une souche d’Aspergillus capable de transformer les glucides en acide citrique.
Lors de l’épuisement des glucides, le milieu est lavé avec de l’eau pour extraire l’acide citrique, qui est en outre traité dans un processus de récupération et de purification approprié.
1.2. Fermentation superficielle
En fermentation de surface, A. niger est cultivé sur un substrat liquide dans des bacs empilés verticalement dans une chambre. Les bacs sont remplis manuellement ou automatiquement. La chambre et les bacs sont stérilisés à la vapeur après introduction du substrat.
Pendant la fermentation, la chambre est refroidie par l’introduction d’air humide et stérile à une température contrôlée. Le liquide et les micro-organismes sont éliminés manuellement ou automatiquement des bacs. Les bacs sont nettoyés avant l’introduction du lot suivant.
Le substrat pour la fermentation est un hydrate de carbone, généralement de la mélasse ou un sucre, tel que des sucres de betterave crue, de betterave raffinée ou de canne, ou un sirop. Les sirops de glucose peuvent être préparés à partir de blé, de maïs, de pomme de terre ou d’un autre amidon. La teneur en sucre du sirop peut varier d’environ 10 à 25 % en poids.
Certains nutriments inorganiques, tels que le nitrate d’ammonium, le phosphate de potassium, le sulfate de magnésium, le sulfate de zinc et le ferrocyanure de potassium, sont ajoutés.
Le pH est ajusté entre 3 et 7, selon la source de glucides. La stérilisation peut être discontinue ou continue ; ce dernier utilise moins d’énergie et est généralement plus rapide. Après la stérilisation, la température est ajustée selon les besoins.
La surface du substrat stérile dans les bacs est inoculée avec des spores d’A. niger, qui germent et recouvrent la surface du liquide d’un tapis de moisissure.
Après deux à trois jours, la surface est complètement recouverte et la production d’acide citrique commence, se poursuivant à un rythme presque constant jusqu’à ce que 80 à 90 % du sucre soient consommés.
La fermentation se poursuit ensuite plus lentement pendant quatre à dix jours supplémentaires. A la fin, les bacs sont vidés et le mycélium est séparé du liquide. Le mycélium est lavé et est généralement commercialisé comme ingrédient alimentaire; le liquide est traité dans le processus de récupération.
1.3. Fermentation submergée
La fermentation submergée a lieu dans de grandes cuves de fermentation. C’est le processus privilégié pour les nouveaux investissements depuis la seconde moitié du XXe siècle en raison de la baisse des coûts de main-d’œuvre et d’investissement et d’une zone de construction plus compacte.
Les cuves de fermentation sont généralement hautes et étroites pour maximiser le transfert d’oxygène, et peuvent être équipées de dispositifs de mélange. Le mélange est particulièrement nécessaire lorsque l’hydrolyse de la charge d’alimentation glucidique est effectuée dans la cuve de fermentation.
Lors de l’utilisation d’une charge liquide moins visqueuse, l’utilisation de cuves de fermentation à air pulsé est plus économique. Des spargers, situés au fond de la cuve ou sous l’agitateur, fournissent de l’air qui peut être enrichi en oxygène.
L’air est fourni par un compresseur et passe à travers un filtre stérile ; si nécessaire, l’air est refroidi. Le processus étant exothermique, la cuve doit être équipée de surfaces d’échange thermique, qui peuvent être des parois extérieures ou des serpentins internes. Des orifices sont prévus pour introduire le substrat, l’inoculum et la vapeur ou d’autres agents stérilisants ; des orifices d’échantillonnage et d’échappement sont également fournis.
Le substrat est préparé dans une cuve séparée et son pH ajusté ; les micronutriments peuvent être ajoutés dans cette cuve ou directement dans le fermenteur. Le substrat est stérilisé par une opération discontinue ou, plus couramment, par une opération continue.
Le fermenteur est stérilisé, chargé de substrat et ensemencé. Le processus de fermentation proprement dit se déroule en deux étapes. Une petite partie du substrat est utilisée pour remplir un fermenteur de graines, qui contient généralement un dixième du volume d’un fermenteur principal.
Après stérilisation et refroidissement à 25–35 °C, des spores d’A. niger sont ajoutées. Les spores germent et les boulettes mycéliennes commencent à se développer dès le premier jour de fonctionnement. Entre-temps, un fermenteur principal est rempli de substrat, stérilisé et refroidi.
Le contenu du fermenteur de graines est ensuite pompé dans le fermenteur principal où la conversion des glucides commence immédiatement. La fermentation dans le fermenteur principal nécessite 3 à 7 jours, selon le substrat et les conditions de traitement utilisées.
Une fois terminé, l’alimentation en air est arrêtée pour empêcher les micro-organismes de consommer l’acide citrique et le contenu est pompé vers des filtres rotatifs sous vide ou des filtres à bande pour séparer le mycélium du liquide.
Comme dans le processus de fermentation en surface, le mycélium est lavé et est généralement commercialisé comme ingrédient alimentaire.
Presque tout l’acide citrique dans le monde est vendu sous forme de produits cristallins. Pour produire des cristaux d’acide citrique de qualité alimentaire, l’acide citrique est d’abord isolé du bouillon de fermentation, suivi d’une purification de la solution brute d’acide citrique. Enfin, la solution d’acide citrique purifiée est cristallisée et conditionnée.
2. Réactions chimiques de l'acide citrique
L’acide citrique perd de l’eau à 175 °C pour former de l’acide aconitique, qui perd du dioxyde de carbone pour donner de l’anhydride itaconique. L’anhydride itaconique se réarange en anhydride citraconique ou ajoute de l’eau pour former de l’acide itaconique,
L’addition d’eau à l’anhydride citraconique donne l’acide citraconique. L’évaporation d’une solution d’acide citraconique en présence d’acide nitrique donne de l’acide mésaconique, l’isomère trans de l’acide citraconique.
L’oxydation avec permanganate de potassium de l’acide citrique à 35 °C donne l’acide 1,3-acétonedicarboxylique, à 85 °C le produit est l’acide oxalique. La fusion avec l’hydroxyde de potassium produit des acides oxalique et acétique.
L’acide citrique forme des sels mono-, di- et tribasiques cristallins avec de nombreux cations. Le degré d’hydratation de ces sels varie ; par exemple, le citrate trisodique peut cristalliser avec 2 ou 5,5 molécules d’eau. Des mélanges de cations métalliques donnent des sels complexes, tels que ZnNa3H(C6H5O7)2 et ZnNa4 (C6H5O7)2.
L’acide citrique forme des complexes stables avec de nombreux métaux; certains, comme les citrates de ferroammonium, peuvent être cristallisés. Le cuivre donne un complexe ressemblant au complexe cuivre-acide tartrique de la solution de Fehling. Ces complexes ont été étudiés par diverses méthodes classiques.
L’acide citrique peut chélater de nombreux ions métalliques en solution en formant des liaisons entre le métal et les groupes carboxyle ou hydroxyle de la molécule d’acide citrique. Parfois, deux ou plusieurs molécules d’acide citrique sont impliquées dans l’interaction avec l’ion métallique. Cette propriété est précieuse pour empêcher les précipitations (par exemple, anneau de baignoire du savon), modifier le potentiel chimique et modifier d’autres propriétés chimiques.
L’acide citrique est facilement estérifié avec de nombreux alcools dans les conditions habituelles en présence d’un catalyseur, tel que l’acide sulfurique, l’acide p-toluènesulfonique ou une résine échangeuse d’ions acide ; l’estérification avec des alcools bouillant au-dessus de 150°C ne nécessite aucun catalyseur.
Le chlorure de benzyle et le citrate de sodium donnent des esters di- ou tribenzyliques. Les citrates de triméthyle, de triéthyle et de tributyle sont utilisés comme plastifiants dans les matériaux d’emballage alimentaire.
Les alcools dihydriques, les phénols dihydriques et les alcools polyhydriques, tels que le mannitol, le sorbitol et le glycérol, forment des polyesters avec l’acide citrique. Dans certains cas, la réaction d’estérification peut être arrêtée avant la fin, laissant au moins l’un des fragments d’acide carboxylique libre pour former un sel ; le polyester résultant peut être soluble dans l’eau.
Les chlorures et anhydrides d’acide réagissent avec le groupe hydroxyle de l’acide citrique ; habituellement l’ester d’acide citrique est utilisé et l’ester allylique est formé. Les chlorures d’acide dicarboxylique donnent des bis (esters d’acide citrique).
Les époxydes, tels que l’oxyde d’éthylène, l’oxyde de propylène et l’oxyde de styrène, forment des polymères en réagissant avec l’acide citrique ou ses esters au niveau des groupes hydroxyle et carboxyle disponibles.
L’ammoniac, les amines, les amides et les carbamides réagissent avec l’acide citrique comme ils le font avec les acides carboxyliques simples. Les aldéhydes forment des adduits avec l’acide citrique ; par exemple, le formaldéhyde donne l’acide anhydrométhylènecitrique acide 5-oxo-1,3-dioxolane-4,4-diacétique.
3. Utilisations de l'acide citrique
L’acide citrique et ses sels de sodium ou de potassium sont utilisés dans de nombreux produits alimentaires, principalement les boissons gazeuses, les boissons emballées à sec, les boissons aux fruits, les confitures, les gelées et les fruits en conserve.
Ils sont également importants dans la production d’huiles végétales et dans la préservation de la couleur, de la saveur et de la teneur en vitamines des fruits et légumes frais et surgelés.
Dans les applications pharmaceutiques, ils sont principalement utilisés dans les comprimés effervescents et comme anticoagulant dans le stockage du sang.
L’acide citrique est largement utilisé dans le nettoyage, par exemple pour les chaudières et les échangeurs de chaleur. Sa capacité de chélation aide à éliminer le tartre.
De nombreuses applications industrielles de l’acide citrique utilisent sa puissante action séquestrante avec divers métaux de transition, tels que le fer, le cuivre, le nickel, le cobalt, le chrome et le manganèse.
L’acide citrique est utilisé comme adjuvant de détergence, en particulier dans les formulations liquides.
Ses solutions peuvent éliminer le dioxyde de soufre des gaz et chélater les micronutriments dans les engrais.
Les esters d’acide citrique sont des plastifiants pour les récipients en plastique de qualité alimentaire.
Référence
- Citric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a07_103.pub3
